Original
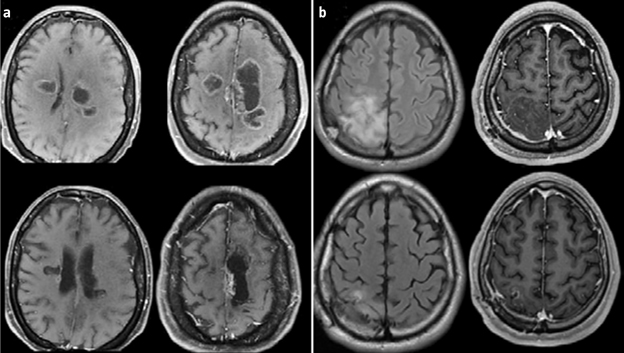
Radioterapia más temozolomida o PCV en pacientes con oligodendroglioma anaplásico con codeleción 1p19q
A. González-Aguilar, I. Reyes-Moreno, R.P. Peiro-Osuna, A. Hernández-Hernández, A. Gutiérrez-Aceves, J. Santos-Zambrano, V. Guerrero-Juárez, M. López-Martínez, E. Castro-Martínez [REV NEUROL 2018;67:293-297] PMID: 30289152 DOI: https://doi.org/10.33588/rn.6708.2018009Volumen 67 | Número 08 | Nº de lecturas del artículo 24.654 | Nº de descargas del PDF 144 | Fecha de publicación del artículo 16/10/2018
 Castellano
Castellano
 English
English