Evolution of cognitive impairment after a traumatic brain injury: is there any improvement after controlling the practice effect?
Introduction. The importance of knowing the pattern of evolution of cognitive deficits in the first months after a traumatic brain injury (TBI) has encouraged the development of numerous longitudinal studies. However, the results of most of them should be taken with caution due to the lack of adequate control of practice effects that can lead to overestimating the genuine recovery of cognitive processes.
Aim. To describe the cognitive changes between the acute and subacute phases of the TBI controlling the effect of the practice.
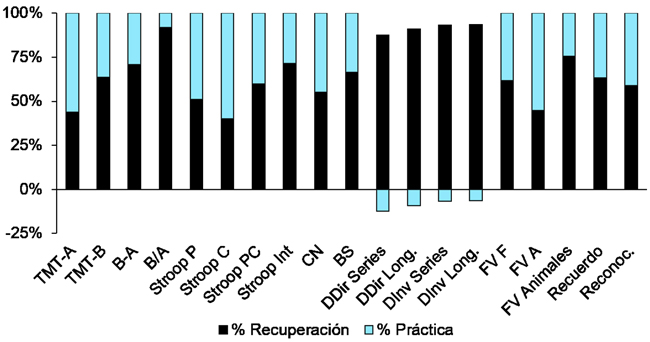
Patients and methods. Twenty-two patients were assessed in two different time points after TBI (immediately and after six months) using the following tests: Trail Making Test (A, B, B/A, B-A), Stroop Test (W, C, CW, interference), Digit Symbol-Coding, Symbol Search, Digits Forward and Backward, Verbal Fluency and Short-term Memory. To control for the practice effects, a transformation of the scores was performed applying the procedure proposed by Calamia et al.
Results. Before controlling the practice effects, the scores of all tests improved (p > 0.001). However, afterward, the improvement remained only in the Trail Making Test-B, B/A and B-A, Digit Symbol-Coding, Symbol Search, Stroop CW and Digits Backward.
Conclusions. The lack of control of practice effects in longitudinal studies can generate misleading interpretations about the evolution of cognitive deficits. The pattern of recovery after a TBI varies depending on the cognitive process.
Key words. Cognitive performance. Evolution. Longitudinal design. Practice. Recovery. Traumatic brain injury.
|
 Castellano
Castellano
 English
English