Introducción
Desde la introducción de la terapia antirretroviral a mediados de los años noventa, la esperanza de vida de los pacientes con virus de la inmunodeficiencia humana (VIH) seropositivos se ha incrementado por encima de los 20 años. Una de las patologías más relevantes es la demencia por el VIH y su espectro clínico, conocido como trastorno neurocognitivo asociado al VIH. A pesar de que su incidencia y prevalencia han disminuido considerablemente con la introducción del tratamiento antirretroviral, las formas leves o moderadas se han visto acentuadas. Los trastornos neurológicos relacionados con esta entidad continúan siendo objeto de estudio por su repercusión personal y socioeconómica. Un 20-60% de los pacientes no tratados, así como un 10% de los tratados, presentan trastorno neurocognitivo, lo que sugiere que la progresión podría ser independiente del tratamiento. La presentación de trastorno neurocognitivo asociado al VIH es variable y puede manifestarse con un curso agudo o subagudo [1-6]. Existen tres categorías clínicas de trastorno neurocognitivo asociado al VIH [7]:
- Trastorno neurocognitivo asintomático (30-35%): implica la alteración de al menos una desviación estándar por debajo de la media de la población en dos o más dominios neurocognitivos. Esta afectación no interfiere con las actividades básicas la vida diaria. Es de al menos un mes de evolución y se descartan otras posibles causas.
- Trastorno neurocognitivo leve-moderado sintomático: difiere del trastorno neurocognitivo asintomático en que en este caso sí que interfiere con las actividades básicas de la vida diaria.
- Demencia asociada a VIH (2-3%): implica un marcado empeoramiento adquirido en el funcionamiento cognitivo, con alteración de al menos dos desviaciones estándares por debajo de la media de la población en dos o más dominios neurocognitivos, y conlleva una marcada interferencia con las actividades básicas de la vida diaria.
Las formas leves pueden pasar inadvertidas por el facultativo o incluso por el paciente, y llevan a un deterioro progresivo y no controlado, con incapacidad del paciente para las actividades básicas de la vida diaria, mala adhesión terapéutica y empeoramiento de su calidad de vida.
Se han propuesto test neuropsicológicos con el propósito de realizar un test de cribado en este subgrupo de pacientes. El Minimental State Examination (MMSE) es una herramienta poco sensible para estos pacientes, puesto que fue diseñada para pacientes con demencia de predominio cortical, a diferencia de la demencia por el VIH, que es de predominio subcortical [1-6]. La HIV Dementia Scale se ha empleado como test de cribado de trastornos neurocognitivos asociados al VIH en pacientes con VIH, pero los resultados no son concluyentes [8] debido a sesgos culturales. En este sentido se desarrolla la escala internacional de demencia para el VIH, de fácil y rápida ejecución [9-12]. La escala cognitiva de Montreal (MOCA) es una herramienta de cribado que mide diferentes dominios cognitivos en un tiempo relativamente breve y se ha propuesto como un método de cribado razonable [13,14].
Debido a la carencia de test específicos para la población con VIH y la controversia existente, se han analizado distintas combinaciones de test. Las pruebas neuropsicológicas que mejor se adaptan a nuestra población española son la Brief Neurocognitive Scale (BNCS) [15] y el Neu Screening [16]. El creciente interés por los trastornos neurocognitivos asociados al VIH ha favorecido el desarrollo de nuevas herramientas de diagnóstico por neuroimagen y de biomarcadores implicados en su aparición [17]. El esfuerzo en busca de las claves de la toxicidad del VIH en el sistema nervioso central permitirá elaborar estrategias que disminuyan la morbilidad y mejoren la calidad de vida. Un primer paso es cuantificar la magnitud del problema en nuestra área sanitaria.
Nuestra hipótesis es que, a pesar de la introducción del tratamiento antirretroviral y el buen control clínico, la población con VIH es más susceptible de padecer un deterioro neurocognitivo (especialmente formas asintomáticas o leves) frente a la población general.
Nuestro propósito es valorar si existe una asociación entre la infección por el VIH y el trastorno neurocognitivo, así como estimar su prevalencia entre los pacientes con VIH con buen control clínico y carga vírica indetectable, para mejorar el conocimiento sobre el deterioro cognitivo en estos pacientes y proponer medidas de seguimiento.
Sujetos y métodos
Estudio analítico, observacional y transversal que compara dos poblaciones: 24 pacientes con VIH y 21 controles sanos.
Mediante un muestreo oportunista no aleatorizado, entre enero y abril de 2018 se incluyeron pacientes mayores de 18 años de ambos sexos diagnosticados de VIH en seguimiento por consultas de enfermedades infecciosas de nuestro hospital, que aceptaron participar, con buen control clínico y carga vírica indetectable en la última analítica de control. También se incluyeron controles sanos con sexo, edad y nivel de estudios equiparables a la población de estudio.
Se excluyó a pacientes con VIH que no firmaran el consentimiento informado, con estadio dida, abuso de tóxicos activo, patología grave del sistema nervioso central, antecedente de traumatismo craneoencefálico, mala situación clínica, discapacidad por alteración importante en los sentidos o mal control en los últimos seis meses (modificación del tratamiento, carga vírica detectable).
De los 30 pacientes con VIH reclutados, cuatro fueron excluidos por presentar carga vírica detectable en el último control analítico y dos por mantener consumo activo de sustancias, por lo que completaron el cribado neuropsicológico 24 pacientes con VIH y 21 pacientes control asintomáticos y libres de enfermedad.
Entrevista y test neuropsicológicos
Durante la entrevista se recogieron datos sociodemográficos y clínicos, incluyendo hábitos tóxicos, nivel de estudios, actividad laboral, tratamiento y comorbilidades. Los datos analíticos se obtuvieron retrospectivamente mediante acceso a su historia clínica electrónica o en papel. También se recogieron los datos en relación con neuroimagen.
En primer lugar se realizó una entrevista de tres preguntas para conocer si el paciente era o no sintomático (si presentaba queja subjetiva):
- ¿Experimenta con frecuencia pérdida de memoria (p. ej., no recuerda acontecimientos especiales pasados, incluso los más recientes, citas, etc.)?
- ¿Ha notado que es más lento al razonar, hacer planes o solucionar problemas?
- ¿Tiene dificultad para mantener centrada la atención (p. ej., en una conversación, un libro o una película)?
Para cada pregunta, los pacientes podían contestar ‘nunca’, ‘casi nunca’ o ‘sí, definitivamente’. Se consideró anormal cuando los pacientes respondieron al menos una pregunta ‘sí, definitivamente’.
A continuación se empleó la escala de ansiedad y depresión hospitalaria como método de cribado de ansiedad o depresión, y se consideró ≤ 7 una puntuación negativa, y ≥ 8, positiva.
La batería de test neuropsicológicos llevados a cabo para valorar las funciones cognitivas fue:
- Incluidas en el Neu Screening [16]: Trail Making Test, parte A (TMT-A), Trail Making Test, parte B (TMT-B) y Controlled Oral Word Association Test (COWAT-FAS).
- Incluidas en la BNCS [15]: TMT-A, TMT-B y Digit Symbol Substitution Test.
Además, entre los pacientes con VIH+ se realizó el MOCA a 23 de 24 pacientes (con un punto de corte de 26 puntos para la normalidad).
Se llevó a cabo el TMT-A para evaluar la velocidad de procesamiento, la flexibilidad mental y la atención; el TMT-B para evaluar las funciones ejecutivas (atención compleja, planificación, flexibilidad cognitiva e inhibición de respuesta) [18,19]; el COWAT-FAS, en su forma fonémica, para valorar la fluidez verbal; y el Symbol Digit Modalities Test [20], para evaluar la memoria de trabajo, la velocidad de procesamiento de información, la atención selectiva, focal y sostenida, la función visuoespacial y las praxis constructivas.
El cribado se consideró positivo con ≥ 1 test alterado para aumentar la sensibilidad. Se determinó el diagnóstico de posible trastorno neurocognitivo en los pacientes con resultado en un test (de los tres del Neu Screening) por debajo de los valores normativos en función de la edad y el nivel de estudios, o probable trastorno neurocognitivo en dos o más de los test incluidos en cada uno de ellos. Lo mismo se realizó en función de los test componentes de la BNCS.
Análisis estadístico
El ajuste a la normalidad de cada una de las variables se realizó mediante la prueba de Kolmogorov-Smirnov y la tabla de Lilliefors. Las variables cuantitativas con distribución normal se expresaron como media y desviación estándar. Para su comparación se utilizó la prueba t de Student para datos no apareados. Las variables sin distribución normal se expresaron como mediana y rango intercuartílico, y se compararon con la prueba U de Mann-Whitney. Las variables dicotómicas se expresaron como porcentajes y se compararon con la prueba chi cuadrado o el test exacto de Fisher. Como índice de asociación se empleó la odds ratio (OR), con su intervalo de confianza al 95% (IC 95%). La prueba de concordancia entre pruebas se realizó con el test kappa. Se realizó el test de correlación lineal con la p de Pearson entre variables cuantitativas. Se consideró estadísticamente significativo un valor p ≤ 0,05. Se utilizó el programa informático SPSS v. 23.
Consideraciones éticas
El protocolo de estudio fue aprobado por el comité ético (CEIC de Aragón) y cumplía todos los estándares científicos y éticos establecidos por el Acuerdo de Helsinki. Previamente al reclutamiento, todos los pacientes fueron informados y firmaron formalmente el consentimiento informado.
Resultados
Estudio descriptivo
Población con VIH
Las características sociodemográficas, hábitos tóxicos, comorbilidades, tratamientos, datos en relación con la infección por el VIH y resultados de los test neuropsicológicos y de ansiedad y depresión se detallan en la tabla I.
Tabla I. Características sociodemográficas y clínicas de las poblaciones estudiadas.
|
| |
|
VIH+ (n = 24)
|
VIH– (n = 21)
|
Edad (años) a
|
|
46,8 ± 9,2
|
46,62 ± 2
|
Nivel de estudios
|
Primarios
|
41,7% (n = 10)
|
42,9% (n = 9)
|
Secundarios
|
33,3% (n = 8)
|
28,6% (n = 6)
|
Universitarios
|
25% (n = 6)
|
28,6% (n = 6)
|
Actividad laboral
|
Paro
|
16,7% (n = 4)
|
14,3% (n = 3)
|
Activo
|
75% (n = 18)
|
85,7% (n = 18)
|
Jubilado
|
8,3% (n = 2)
|
0%
|
Hábito tabáquico
|
No fumador
|
20,8% (n = 5)
|
71,4% (n = 15)
|
Exfumador
|
25 (n = 6)
|
14,3% (n = 3)
|
Fumador
|
54% (n = 13)
|
14,3% (n = 3)
|
Consumo de alcohol
|
Nunca
|
58% (n = 14)
|
19% (n = 4)
|
< 30 g/día
|
41,7% (n = 10)
|
81% (n = 17)
|
Benzodiacepinas
|
|
25% (n = 6)
|
0%
|
Antidepresivos
|
|
8,3% (n = 2)
|
4,8% (n = 1)
|
Antecedente de virus de la hepatitis C
|
29% (n = 7)
|
0%
|
Antecedente de virus de la hepatitis B
|
20,8% (n = 5)
|
0%
|
Antecedente de lúes
|
|
29,2% (n = 7)
|
0%
|
Antecedente de tuberculosis
|
|
16,7% (n = 4)
|
0%
|
Antecedente de ictus
|
|
12,5% (n = 3)
|
0%
|
Años de evolución (si hay VIH) a
|
|
11,5 ± 10,8
|
|
Nadir de CD4/mm3 (si hay VIH) b
|
|
510 (303)
|
–
|
CD4 actual/mm3 (si hay VIH) b
|
|
711 (287)
|
–
|
CD4/CD8 actual (si hay VIH) a
|
|
1,02 ± 0,50
|
–
|
Terapia antirretroviral (si hay VIH)
|
2 ITIAN + 1 II
|
45,8% (n = 11)
|
–
|
2 ITIAN + 1 ITINN
|
16,7% (n = 4)
|
–
|
2 ITIAN + 1 IP
|
25% (n = 6)
|
–
|
Otros
|
12,5% (n = 3)
|
–
|
Inhibidores de la integrasa
|
|
45,8% (n = 11)
|
–
|
Puntuación en ansiedad a
|
|
5,81 ± 3,80
|
0,30 ± 0,22
|
Puntuación en depresión a
|
|
4,62 ± 3,20
|
2,13 ± 2,36
|
Segundos en el Trail Making Test parte A a
|
29 ± 24
|
23 ± 8
|
Segundos en el Trail Making Test parte B a
|
52 ± 16
|
70 ± 44
|
COWAT-FAS (n.º de palabras en un minuto) a
|
37,52 ± 12,40
|
35,20 ± 2,76
|
Aciertos en el Digit Symbol a
|
|
42,50 ± 14,60
|
49,67 ± 23,00
|
Puntuación de la escala cognitiva de Montreal a
|
28 ± 6
|
–
|
COWAT-FAS: Controlled Oral Word Association Test; II: inhibidores de la integrasa; IP: inhibidor de la proteasa; ITIAN: inhibidores de la transcriptasa inversa análogos a nucleótidos/nucleósidos; ITINN: inhibidores de la transcriptasa inversa no análogos a nucleósidos; VIH: virus de la inmunodeficiencia humana. a Media ± desviación estándar; b Mediana (rango intercuartílico).
|
Podemos destacar los niveles de CD4 actuales en los pacientes con VIH: la mediana fue de 711 ± 287 (los pacientes con VIH con cribado positivo tenían 650 ± 243, frente a los que tenían cribado negativo, 712 ± 296, sin diferencias estadísticamente significativas). También se recogieron los niveles nadir de CD4, con mediana de 510 ± 303 (cribado positivo, 358 ± 319, frente a cribado negativo, 550 ± 300, sin diferencias estadísticamente significativas).
Los esquemas de tratamiento de los pacientes con VIH fueron los siguientes:
- Dos inhibidores de la transcriptasa inversa análogos de los nucleósidos/nucleótidos (ITIAN) + un inhibidor de la integrasa en 11 pacientes (dos de los cuales tuvieron cribado positivo, y nueve, cribado negativo)
- Dos ITIAN + un inhibidor de la transcriptasa inversa no análogo de los nucleósidos/nucleótidos en cuatro pacientes (uno de los cuales tuvo cribado positivo, y tres, cribado negativo).
- Dos ITIAN + un inhibidor de la proteasa en seis pacientes (dos con cribado positivo y nueve con cribado negativo).
- Tres pacientes tenían regímenes terapéuticos diferentes o más simplificados por efectos adversos u otros motivos.
- En total, 11 pacientes estaban tratados con inhibidores de la integrasa.
- Sólo un paciente estaba tratado con efavirenz.
En relación con la neuroimagen previa, los pacientes disponían de tomografía axial computarizada cerebral. Tres tenían como antecedente ictus isquémico lacunar en el territorio de los ganglios de la base (ya conocido); dos, leve atrofia corticosubcortical; y el resto era normal. No hubo asociación estadística con los resultados del cribado neurocognitivo.
Manifestó queja subjetiva (al menos una pregunta de la entrevista inicial con respuesta afirmativa) el 62,5% [15].
Respecto a los resultados de los test neuropsicológicos:
- Cribado de deterioro cognitivo (Figs. 1 y 2):
- a) Neu Screening. Normal: 62,5% (n = 15); posible deterioro cognitivo (un test mal): 16,7% (n = 4); probable deterioro cognitivo (dos o más test mal): 20,8% (n = 5).
- b) BNCS. Normal: 66,7% (n = 16); posible deterioro cognitivo (un test mal): 16,7% (n = 4); probable deterioro cognitivo (dos o más test mal): 16,7% (n = 4).
- c) MOCA. Normal: 66,7% (n = 16); alterado: 29,2% (n = 7).
- Cribado de trastorno ansioso-depresivo (Fig. 3):
- a) Ansiedad. Normal: 66,7% (n = 16); posible trastorno ansioso: 33,3% (n = 8).
- b) Depresión. Normal: 83,3% (n = 20); posible trastorno depresivo: 16,7% (n = 4).
Figura 1. Resultados en el Neu Screening. Se muestran los diferentes resultados tanto en población con VIH como en controles. Se agrupan los resultados en test normal, posible trastorno neurocognitivo (si hay un test alterado) y probable trastorno neurocognitivo (si hay dos o más test alterados). No hubo diferencias significativas entre grupos. TNC: trastorno neurocognitivo; VIH: virus de la inmunodeficiencia humana.

Figura 2. Resultados en la Brief Neurocognitive Scale. Se muestran los diferentes resultados tanto en población con VIH como en controles. Se agrupan los resultados en test normal, posible trastorno neurocognitivo (si hay un test alterado) y probable trastorno neurocognitivo (si hay dos o más test alterados). No hubo diferencias significativas entre grupos. TNC: trastorno neurocognitivo; VIH: virus de la inmunodeficiencia humana.

Figura 3. Síntomas de ansiedad y depresión en pacientes con virus de la inmunodeficiencia humana (VIH) y controles, valorados a través de la escala hospitalaria de ansiedad y depresión, con los puntos de corte previamente explicados. Se objetiva una prevalencia de síntomas de ansiedad y depresión superiores en el grupo de pacientes con VIH+ frente a la población control. No hubo diferencias significativas.

La depresión fue un factor más frecuente en la población con VIH+ con valores en la escala de ansiedad y depresión hospitalaria de 4,92 ± 3,00 frente a 0,30 ± 0,98 (p < 0,01).
Población sin VIH
Características sociodemográficas y datos relacionados con sus hábitos tóxicos se detallan en la tabla I.
Respecto a los resultados de los test neuropsicológicos:
- Cribado de trastorno neurocognitivo (Figs. 1 y 2).
- a) Neu Screening. Normal: 42,9% (n = 9); posible deterioro cognitivo (un test mal): 42,9% (n = 9); probable deterioro cognitivo: 14,3% (n = 3).
- b) BNCS. Normal: 66,7% (n = 14); posible deterioro cognitivo (un test mal): 23,8% (n = 5); probable deterioro cognitivo (dos o más test mal): 9,5% (n = 2).
- Cribado de trastorno ansioso-depresivo (Fig. 3):
- a) Ansiedad: 15%.
- b) Depresión: 0%.
Estudio analítico
La tabla II compara las diferentes características sociodemográficas, clínicas y analíticas, y los resultados de los test para ansiedad, depresión y neuropsicológicos entre los pacientes con VIH con cribado positivo y pacientes con VIH con cribado negativo, y se encuentran diferencias significativas con las medianas de los resultados del MOCA (p < 0,001), el TMT-A (p = 0,003) y el TMT-B (p = 0,001).
Tabla II. Comparación entre pacientes con VIH con cribado positivo y cribado negativo de características sociodemográficas y clínicas.
|
| |
Cribado positivo
|
Cribado negativo
|
Edad (años) a
|
|
46,40 ± 11,36
|
46,8 ± 8,0
|
Años de evolución a
|
|
15,4 ± 13,8
|
11 ± 9
|
Vía de transmisión
|
Sexual
|
26,7% (n = 4)
|
46,7% (n = 14)
|
ADVP
|
26,7% (n = 4)
|
3,3% (n = 1)
|
Nadir de CD4/mm3
|
|
358 ± 319
|
550 ± 300
|
CD4/mm3 actual
|
|
650 ± 243
|
712,1 ± 296
|
CD4/CD8 actual
|
|
0,85 ± 0,28
|
1,07 ± 0,50
|
Antecedente de virus de la hepatitis C
|
26,7% (n = 4)
|
10% (n = 3)
|
Antecedente de virus de la hepatitis B
|
13,3% (n = 2)
|
10% (n = 3)
|
Antecedente de lúes
|
|
13,3% (n = 2)
|
16,7% (n = 5)
|
Antecedente de tuberculosis
|
|
0%
|
13,3% (n = 4)
|
Terapia antirretroviral
|
2 ITIAN + 1 II
|
13,3% (n = 2)
|
30% (n = 9)
|
2 ITIAN + 1 ITINN
|
6,7% (n = 1)
|
10% (n = 3)
|
2 ITIAN + 1 IP
|
20% (n = 3)
|
10% (n = 3)
|
Otros
|
13,3% (n = 2)
|
3,3% (n = 1)
|
Inhibidores de la integrasa
|
|
13,3% (n = 2)
|
26,7% (n = 8)
|
Puntuación en ansiedad a,b
|
|
8,3 ± 4,3
|
2,13 ± 2,88
|
Puntuación en depresión a,b
|
|
4,20 ± 4,77
|
2,13 ± 2,36
|
Segundos en el Trail Making Test parte A a,b
|
35 ± 23
|
23 ± 8
|
Segundos en el Trail Making Test parte B a,b
|
110 ± 80
|
51 ± 33
|
Controlled Oral World Association Test-FAS a
|
31,9 ± 13,0
|
39,95 ± 11,37
|
Aciertos en el Digit Symbol a
|
|
35,4 ± 15,5
|
49,80 ± 10,56
|
ADVP: adicción a drogas por vía parenteral; II: inhibidores de la integrasa; IP: inhibidor de la proteasa; ITIAN: inhibidores de la transcriptasa inversa análogos a nucleótidos/nucleósidos; ITINN: inhibidores de la transcriptasa inversa no análogos a nucleósidos; VIH: virus de la inmunodeficiencia humana. a Media ± desviación estándar; b Se objetivó una diferencia estadísticamente significativa entre las puntuaciones de ansiedad y depresión presentes en pacientes con VIH con cribado neurocognitivo positivo y negativo (p < 0,01). También se encontraron diferencias significativas entre los pacientes con VIH con cribado positivo y negativo en los segundos para realizar el Trail Making Test parte A (p = 0,003) y parte B (p = 0,001).
|
Se analizó la posible asociación entre la toma de inhibidores de integrasa y la presencia de quejas subjetivas, resultado de los diferentes test neuropsicológicos, síntomas de ansiedad y depresión, así como del Neu Screening o la BCNS con posible o probable deterioro, sin hallar diferencias significativas.
Se estudió la asociación entre deterioro cognitivo posible y probable (con el Neu Screening y la BNCS) o cribado positivo/negativo y el estado serológico con VIH positivo o negativo, sin obtener resultados significativos.
Las OR de las principales variables cualitativas asociadas con el trastorno neurocognitivo no fueron significativas, a excepción del sexo femenino (OR = 4,571; IC 95%: 1,182-17,670).
Se encontró una asociación estadísticamente significativa entre cribado positivo y síntomas de ansiedad (p < 0,001) y depresión (p = 0,02).
Encontramos una correlación entre niveles nadir de CD4 y medias del Digit Symbol y del test de fluencia fonética (Figs. 4 y 5);
- Digit Symbol: r = 0,435; r2 = 0,19; F = 4,65 (p = 0,045); obteniendo la siguiente ecuación: y = 31,14 + (0,435 × CD4NADIR).
- Fluencia fonética: r = 0,43; r2 = 0,19; F = 4,65 (p = 0,044); obteniendo la siguiente ecuación: y = 28,96 + (0,017 × CD4NADIR).
Figura 4. Correlación lineal entre Digit Symbol y nadir de CD4 estudiado mediante el test de la p de Pearson.
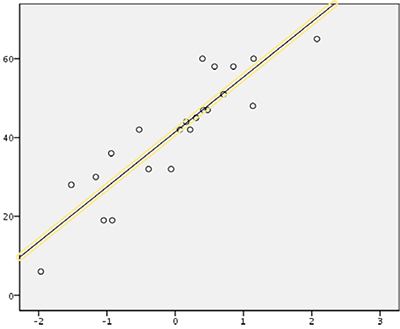
Figura 5. Correlación lineal entre los resultados del COWAT y los niveles nadir de CD4, estudiado mediante el test de la p de Pearson.

Se estudió el grado de concordancia entre los diferentes test de cribado:
- Neu Screening probable y BNCS probable (con dos o más test alterados): se obtiene un índice kappa de 0,663: concordancia moderada (p < 0,001).
- BNCS posible (con un test alterado) y MOCA: se obtiene un índice kappa de 0,795: concordancia alta (p < 0,001).
El resto de combinaciones aparece en la tabla III.
Tabla III. Grado de concordancia entre los diferentes test neuropsicológicos.
|
| |
Kappa
|
Concordancia
|
p
|
Neu Screning probable + BNCS probable
|
0,663
|
Moderada
|
< 0,001
|
Neu Screning posible + BNCS posible
|
0,471
|
Ligera-moderada
|
< 0,001
|
Neu Screning probable + MOCA
|
0,550
|
Ligera-moderada
|
< 0,006
|
BNCS probable + MOCA
|
0,310
|
Ligera-moderada
|
< 0,005
|
BNCS posible + MOCA
|
0,795
|
Alta
|
< 0,001
|
Se considera ‘posible’ cuando hay un test mal de los tres que configuran la batería de cribado y ‘probable’ cuando hay dos o más test mal. BNCS: Brief Neurocognitive Scale; MOCA: escala cognitiva de Montreal.
|
Discusión
Las guías y consensos de trabajo describen ampliamente los factores de riesgo y causas de deterioro cognitivo que pueden existir en el paciente con VIH. Los factores de riesgo se clasifican en función de si dependen del paciente (genética, edad, consumo de tóxicos, virus de la hepatitis C...), VIH (subtipo, resistencias…) y consecuencias de la infección (nadir de CD4, estadio sida, tratamiento antirretroviral, activación inmunitaria).
En lo referente a la evaluación neuropsicológica, se deben valorar siete dominios neurocognitivos: atención y memoria de trabajo, velocidad de procesamiento, memoria/aprendizaje, función ejecutiva, fluencia verbal y habilidades motoras. Cualquier alteración en dichos dominios se ha relacionado con una peor adhesión al tratamiento, una mayor queja cognitiva y una peor calidad de vida [7]. Se considera la presencia de trastorno neurocognitivo cuando existen al menos dos test alterados por área. Y se ha propuesto como un cribado positivo para trastorno neurocognitivo la presencia de alteración en al menos un dominio [21], motivo por el cual decidimos considerar cribado positivo si existía alteración en un test de los tres que componía cada instrumento de cribado. Estos instrumentos son una batería de pruebas que sirven para el cribado de la población. El MMSE y el MOCA no han sido validados para población con VIH ni se consideran sensibles para la detección de trastorno neurocognitivo leve. Por ello se desarrollaron otros test de cribado internacional (escala internacional de demencia por VIH, escala de la demencia por VIH) [8-11], o la BNCS o el Neu Screening [20], entre otros. La BNCS alcanza una sensibilidad del 66% y una especificidad del 85%, y el Neu Screening, una sensibilidad del 74% y una especificidad del 81%; este último se considera el de elección para el cribado de estos pacientes en población española con VIH. No obstante, estos métodos tienen importantes limitaciones (ausencia de validación en el VIH, falta parcial de sensibilidad, especificidad y validez externa, y aplicación universal).
Según los criterios de Antinori et al [21], los factores de confusión para el diagnóstico de trastorno neurocognitivo en el VIH se pueden dividir en procesos incidentales, contribuyentes o factores de confusión, y en función de ellos reunimos los criterios de exclusión para nuestro reclutamiento.
Comparando nuestro trabajo con el de otros autores [22-24], podemos observar muestras similares en cuanto a edad, predominio de varones en la muestra o años de evolución. Entre los pacientes con cribado positivo, el porcentaje de pacientes con queja cognitiva (sintomáticos) fue similar el encontrado en algunos trabajos [22], aunque superior a otros [23]. Los niveles medios de CD4 actuales fueron ligeramente superiores en nuestra muestra de pacientes con VIH comparado con otras investigaciones donde los criterios de exclusión fueron más laxos. A diferencia de otros estudios [22], no hemos encontrado diferencias significativas entre serología VIH positiva y cribado positivo. En éstos se incluyen pacientes con consumo de tóxicos o virus de la hepatitis C activo, así como carga vírica detectable y niveles actuales de CD4 inferiores, por lo que estas diferencias en los test neuropsicológicos podrían deberse a la presencia de dichas comorbilidades. Barber et al [23] también utilizan la BNCS, aunque con una muestra mayor (n = 144). Evidenciaron una prevalencia del 13,9% de trastorno neurocognitivo. No se encontró relación significativa con el consumo de tóxicos, al igual que en nuestra serie. Tampoco hubo diferencias significativas respecto a la toma de ansiolíticos.
Otros factores que pueden estar implicados en el desarrollo del trastorno cognitivo son los fármacos empleados para el tratamiento del VIH [7]. Uno de los fármacos más conocidos por su posible toxicidad sobre el sistema nervioso central es el efavirenz. En nuestra serie de pacientes, sólo un paciente estaba en tratamiento con este fármaco, motivo por el cual no se realizó un análisis estadístico más selectivo. Por otro lado, los inhibidores de la integrasa también se han relacionado con quejas subjetivas de memoria. En este trabajo, 11 pacientes estaban en tratamiento con esta familia terapéutica, y sólo dos de ellos tuvieron un cribado positivo, sin que hubiera diferencias significativas entre grupos.
Por otro lado, hemos podido observar una elevada prevalencia de síntomas de ansiedad y depresión entre los pacientes con VIH, así como en los pacientes con cribado positivo para trastorno neurocognitivo, y hemos hallado una relación significativa entre puntuación y cribado positivo. Por dicho motivo, como recomiendan las guías, es primordial una evaluación neuropsicológica, incluyendo cribado de comorbilidad ansiosodepresiva en los pacientes con VIH que presentan queja cognitiva o que simplemente acuden a la consulta de infecciosas de forma rutinaria. De forma paradójica, debemos considerar que los síntomas de ansiedad y depresión podrían corresponder con un perfil de síntomas de trastorno neurocognitivo subyacente.
Finalmente, en el estudio de riesgo, sólo fue significativa la condición de mujer, con una OR de 4,571, datos congruentes con el trabajo de Robertson et al [24], donde también se encontró una mayor prevalencia del trastorno neurocognitivo en las mujeres. Se trataba de una muestra muy superior (n = 2.863), y en este caso se incluían pacientes con carga vírica detectable.
Cabe destacar los estudios que actualmente se están llevando a cabo en esta área de trabajo: en primer lugar, la existencia de biomarcadores en la sangre o el líquido cefalorraquídeo, como la presencia de bajos niveles de β-amiloide o elevados de proteína tau total y fosforilada, sugestivos de daño neuronal, que de forma paralela se encuentran clásicamente en la enfermedad de Alzheimer. Por otro lado, existe correlación entre la demencia y la replicación vírica del VIH en el sistema nervioso central. Generalmente, cuando la carga vírica es indetectable en plasma, lo es en el líquido cefalorraquídeo. Sin embargo, hasta un 10% de los pacientes presenta carga vírica detectable en líquido cefalorraquídeo (lo cual puede relacionarse o no con el tipo de terapia antirretroviral y la capacidad de atravesar la barrera hematoencefálica). Por ello, en todos los pacientes, pero especialmente en los que presentan queja cognitiva o cribado positivo para el trastorno neurocognitivo, es recomendable optimizar el tratamiento empleando los que tienen buena penetración. En nuestro caso, no se analizaron datos sobre carga vírica en el líquido cefalorraquídeo, dado que no todos los pacientes tenían punción lumbar previa. El objetivo era realizar un estudio de cribado de cara a valorar la necesidad de realización de pruebas más invasivas, como la punción lumbar o un estudio mediante resonancia magnética cerebral a los pacientes cuyo resultado en el cribado fuera positivo o planteara dudas diagnósticas. Tampoco se analizaron los niveles de marcadores de inflamación, como interleucina-6, debido a que no todos ellos disponían de dicha determinación.
Otra limitación evidente es que se trata de un estudio descriptivo, comparando una muestra pequeña de pacientes con VIH positivos y controles sanos, por lo que podría no ser extrapolable a toda la población con VIH. Este hecho también limita la oportunidad de obtener valores estadísticamente significativos. Además, el porcentaje de varones es claramente superior al de mujeres. También existen una serie de variables analíticas y clínicas de interés (como pueden ser el nadir de la carga vírica, el estadio clínico concreto, la concentración en equilibrio de fármacos empleados o la duración del tratamiento antirretroviral), que no pudieron recogerse adecuadamente debido a la falta de rigurosidad de los datos presentes en las historias clínicas de algunos pacientes, especialmente los que tenían diagnóstico previo a 2008. La validez de la entrevista con estos pacientes podría ser cuestionable, debido a los síntomas de ansiedad, depresión o cribado positivo para el trastorno neurocognitivo.
Los tres pacientes con antecedente de ictus lacunar podrían presentar alteraciones cognitivas de origen vascular o mixto. Si bien en un sentido estricto no podrían clasificarse como trastorno neurocognitivo asociado al VIH, se debe tener en cuenta que los ictus eran de pequeño tamaño, localizados en una región que afectaba principalmente a la función motora (cápsula interna), y éstos no deberían presentar per se una afectación de las funciones superiores.
Como fortalezas, posiblemente nuestra muestra, que cuenta con un buen control clínico, buena adhesión y carga vírica indetectable, presenta un perfil neurocognitivo similar, sin diferencias estadísticas a la población no VIH. También identificamos una concordancia moderada entre BNCS y Neu Screening, lo cual implica que el uso de uno u otro supone una buena alternativa para el cribado, en función de las preferencias del clínico o de los recursos disponibles en la consulta.
Bibliografía
↵ 1. Skinner S, Adewale AJ, DeBlock L, Gill MJ, Power C. Neurocognitive screening tools in HIV/AIDS: comparative performance among patients exposed to antiretroviral therapy. HIV Medicine 2009; 10: 246-52.
↵ 2. Goodkin K, Hardy D, Singh D, Lopez E. Diagnostic utility of the International HIV Dementia Scale for HIV-associated neurocognitive impairment and disorder in South Africa. J Neuropsychiatry Clin Neurosci 2014; 26: 4.
↵ 3. Jung KW, Su KN, Lee YJ, Young AJ, Bean KS, Ahn HW, et al. Utility of the Montreal Cognitive Assessment (MOCA) and its subset in HIV-associated neurocognitive disorder (HAND) screening. J Psychosom Res 2016; 80: 53-7.
↵ 4. Simioni S, Cavassini M, Annoni JM, Metral M, Iglesias K, Rimbault A, et al. Rivastigmine for HIV-associated neuro-cognitive disroders. Neurology 2013; 80: 553-60.
↵ 5. Muñoz-Moreno JA. Measuring cognitive changes in HIV infection: size really matters. International HIV Symposium. Barcelona, España, mayo de 2017.
↵ 6. Zipursky AR, Gogolishvili D, Rueda S, Brunetta J, Carvalhal A, McCome JA, et al. Evaluation of brief screening tools for neurocognitive impairment in HIV/AIDS: a systematic review of the literature. AIDS 2013; 27: 2385-401.
↵ 7. Grupo de expertos del Grupo de Estudio de Sida (GeSIDA) y de la Secretaría del Plan Nacional sobre el Sida (SPNS). Consensus statement on the clinical management of human immunodeficiency virus-associated neurocognitive disorders. Enferm Infecc Microbiol Clin 2014; 32: 37-47.
↵ 8. Bottigi KA, Chang JJ, Schmitt FA, Avison MJ, Mootoor Y, Nath A, et al. The HIV Dementia Scale: predictive power in mild dementia and HAART. J Neurol Sci 2007; 260: 11-5.
↵ 9. Power C, Seines OA, Grim JA, McArthur JC. HIV dementia scale: a rapid screening test. J Acquir Immune Defic Syndr Hum Retrovirol 1995; 8: 273-8.
↵ 10. Dang C, Wei B, Long J, Zhou M, Han X, Zhao T, et al. Validity of the International HIV Dementia Scale as assessed in a socio-economically underdeveloped region of Southern China: assessing the influence of educational attainment. Int J Infect Dis 2015; 33: 56-61.
↵ 11. Brouillette MJ, Mayo N, Fellows LK, Lebedeva E, Higgins J, Overton ET, et al. A better screening tool for HIV-associated neurocognitive disorders: is it what clinicians need? AIDS 2015, 29: 895-902.
↵ 12. Janssen MAM, Bosch M, Koopmans P, Kessels RPC. Validity of the Montreal Cognitive Assessment and the HIV Dementia Scale in the assessment of cognitive impairment in HIV-1 infected patients J Neurovirol 2015; 21: 383-90.
↵ 13. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I, et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc 2005; 53: 695-9.
↵ 14. Chartier M, Crouch PC, Tullis V, Catella S, Frawley E, Filanosky C, et al. The Montreal Cognitive Assessment: a pilot study of a brief screening tool for mild and moderate cognitive impairment in HIV-positive veterans. J Int Assoc Provid AIDS Care 2015; 14: 197-201.
↵ 15. Ellis RJ, Scott RE, Clifford DB, Moo LR McArthur JC, Collier AC, et al. Brief Neurocognitive Screen. J Neurovirol 2005; 11: 503-11.
↵ 16. Muñoz-Moreno JA, Prats A, Pérez-Álvarez N, Fumaz CR, Garolera M, Doval E, et al. A brief and feasible paper-based method to screen for neurocognitive impairment in HIV-infected patients: the NEU Screen. J Acquir Immune Defic Syndr 2013; 63: 585-92.
↵ 17. Tiraboschi JM, Muñoz-Moreno JA, Puertas MC, Alonso-Villaverde C, Prats A, Ferrer E, et al. Viral and inflammatory markers in cerebrospinal fluid of patients with HIV-1-associated neurocognitive impairment during antiretroviral treatment switch. HIV Medicine 2015; 16: 388-92.
↵ 18. Fernández AL, Marino JC, Alderete AM. Estandarización y validez conceptual del test del trazo en una muestra de adultos argentinos. Rev Neurol Arg 2002; 27: 83-8.
↵ 19. Arango JC, Rivera D. Neuropsicología en Colombia. Datos normativos, estado actual y retos a futuro. Manizales, Colombia: Universidad Autónoma de Manizales; 2015.
↵ 20. Cancela M, Ayán C, Varela S. Valores normativos del Symbol Digit Modalities Test de aplicación en poblaciones españolas residentes en geriátricos: un estudio piloto. Actas Esp Psiquiatr 2012; 40: 299-303.
↵ 21. Antinori A, Arendt G, Becker JT, Brew BJ, Byrd DA, Cherner M, et al. Updated research nosology for HIV-associated neuro-cognitive disorders. Neurology 2007; 69: 1789-99.
↵ 22. García-Torres A, Vergara-Moragues E, Piñón-Blanco A, Pérez-García M. Alteraciones neuropsicológicas en pacientes con VIH e historia previa de consumo de sustancias. Un estudio preliminar. Rev Latinoam Psicol 2015; 47: 213-21.
↵ 23. Barber TJ, Bansi L, Pozniak A, Asboe D, Nelson M, Moyle G, et al. Low levels of neurocognitive impairment detected in screening HIV-infected men who have sex with men: the MSM Neurocog Study. Int J STD AIDS 2017; 28: 715-22.
↵ 24. Robertson K, Bayon C, Molina JM, McNamara P, Resch C, Muñoz-Moreno, et al. Screening for neurocognitive impairment in HIV-infected patients in Western Europe and Canada. AIDS Care 2014; 26:1555-61.
Neurocognitive screening in a population with acquired immunodeficiency virus
Introduction. Neurocognitive impairment associated to human immunodeficiency virus (HIV) is a current problem despite the effectiveness of antiretroviral treatment. The screening tests which best suit to Spanish population are Brief Neurocognitive Scale (BNCS) and Neu Screening. We are unaware of our HIV population’ neurocognitive impairment magnitude.
Aims. To verify if association between HIV and neurocognitive impairment does exist and to know its prevalence.
Subjects and methods. An observational, descriptive and transversal study comparing 24 HIV-outpatients and 21 non-HIV-healthy control matched by age, gender and educational level. Hospital Anxiety and Depression Scale, Neu Screening and BNCS were used as neurocognitive impairment screening. Positive screening was considered with one or more abnormal test.
Results. 33.3% of VIH+ and 33.3% of healthy controls had positive screening without significant difference between both populations. Positive screening was significantly associated with anxiety-punctuation and depression-punctuation. A lineal correlation between CD4-nadir-levels and Digit Symbol and between CD4-nadir-levels and verbal fluency results were found. There was no significant relationship between HIV serology and screening result.
Conclusions. HIV-patients clinically controlled had no significantly different neurocognitive profile compared to control population. CD4-nadir levels may be a predictor variable in terms of neurocognitive impairment development. BNCS and Neu Screening are reasonable alternatives for neurocognitive impairment screening. A concomitant psychiatric and neuropsychological assessment is necessary. Further studies with bigger samples are necessary in order to confirm the alternative hypothesis.
Key words. Antiretroviral treatment. Brief Neurocognitive Scale. HIV. Neu Screening. Neurocognitive impairment. Neuropsychological test.
|
© 2020 Revista de Neurología







