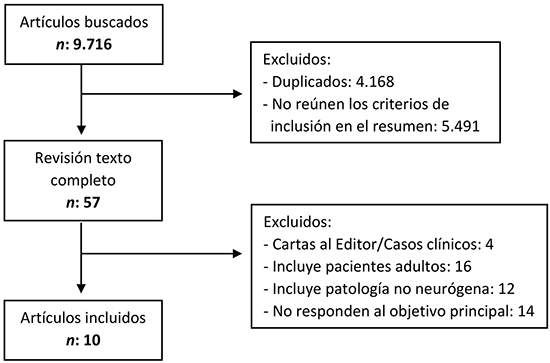
Tabla I. Características demográficas de la población, tipo de terapia y parámetros de administración.
|
Año
|
Referencia
|
Tipo de estudio
|
n
|
M/H
|
Edad en años
|
Lesión neurológica
|
An-Ach
|
Agudo-crónico
|
Modo
|
Parte del cuerpo
|
Veces por semana
|
Número de sesiones totales
|
Duración en minutos
|
Meses
|
Intensidad (mA)
|
Pulso
(μs)
|
Frecuencia
Hz
|
Nombre comercial
|
1992
|
Boone et al [11]
|
P
|
13
|
–
|
6-12
|
–
|
–
|
Agudo
|
E
|
Intravesical
(transuretral)
|
5/semana
|
15
|
90
|
0,75
|
1-7
|
4-6
|
40-80
|
–
|
1996
|
Cheng et al [12]
|
–
|
335
|
157/178
|
2-14
|
–
|
Sí
|
Agudo
|
E
|
Intravesical
(transuretral)
|
–
|
20
|
90
|
–
|
–
|
–
|
–
|
–
|
2004
|
Guys et al [13]
|
P, A
|
21
|
8/13
|
21
|
Espina bífida, 15
Trauma, 2
Tumor, 2
Síndrome de Ochoa, 1
Daño cerebral, 1
|
No
|
Crónico
|
I
|
Sacro (S3)
|
Crónico
|
–
|
Crónico
|
–
|
–
|
210
|
10-20
|
Inters-m
System
Medtronic©
|
2007
|
Hagerty et al [14]
|
R
|
372
|
177/195
|
–
|
MMC, 329
Lesión espinal, 9
Mielitis transversa, 9
Agenesia sacra, 4
Médula anclada, 6
Otros, 16
|
Sí
|
Agudo
|
E
|
Intravesical
(transuretral)
|
7/semana inicial
1/semana hasta mejoría
|
15, inicial
Resto, hasta mejoría
|
90
|
0,75
|
–
|
–
|
–
|
–
|
2008
|
Kajbafzadeh et al [15]
|
P, A
|
20
|
7/12
|
3-16
|
MMC sacro, 10
MMC lumbosacro, 8
MMC lumbar, 1
|
89%
|
Agudo
|
T
|
Sínfisis del pubis
|
3/semana
|
18
|
20
|
1,5
|
Máxima tolerada, 50
|
250
|
20
|
510 A, double channel NOVIN©
|
2010
|
Kajbafzadeh et al [16]
|
–
|
12
|
6/6
|
3-11
|
MMC sacro, 3
MMC lumbosacro, 6
MMC lumbar, 3
|
100%
|
Agudo
|
T
|
Sínfisis del pubis
|
3/semana
|
15
|
15
|
1,25
|
20-65
|
250
|
10-40,
máxima tolerada
|
755 X, one channel NOVIN©
|
2010
|
Haddad et al [17]
|
P, A
|
33
|
–
|
8-16
|
MMC, 10
MAR, 5
Otros, 9
|
–
|
Crónico
|
I
|
Sacro (S3)
|
Crónico
|
–
|
Crónica
|
–
|
1-9
|
–
|
10-20
|
Inter-Stim©
|
2014
|
Kajbafzadeh et al [18]
|
P, A
|
15
|
5/10
|
3-13
|
MMC sacro, 7
MMC lumbosacro, 3
MMC lumbar, 4
|
100%
|
Agudo
|
T
|
Sínfisis del pubis
|
3/semana
|
15
|
15
|
1,25
|
20-65
|
250
|
10-40,
máxima tolerada
|
ISOTERAP 486 DS+©
|
2019
|
Dombek et al [19]
|
P
|
26
|
13/13
|
–
|
MMC sacro, 1
MMC lumbosacro, 15
MMC lumbar, 1
MMC desconocido, 9
|
No
|
Agudo
|
T
|
Sacro
|
–
|
1
|
15–30
|
–
|
20
|
500
|
10
|
Dualpex 961 electroes-m ulator©
|
2019
|
Sharifiaghdas et al [20]
|
R
|
8
|
3/5
|
10-18
|
MMC, 4
Agenesia sacra, 2
Lesión espinal, 2
|
No
|
Crónico
|
I
|
Sacro (S3-S4)
|
Crónico
|
–
|
Crónico
|
–
|
–
|
–
|
–
|
IPG-3058 Medtronic©
|
2020
|
Somoza et al [21]
|
R
|
1
|
1/0
|
8
|
Mielitis transversa
|
Sí
|
Agudo
|
T
|
Sacro (S2-S3)
|
7/semana
|
90
|
20
|
3
|
Máxima tolerada
|
200
|
10
|
UROStim©
|
A: aleatorizado; An-Ach: anticolinérgico concomitante; E: electrodo intracavitario; H: hombre; I: insertado; M: mujer; MAR: malformación anorrectal; MMC: mielomeningocele; n: número de pacientes sometidos a estimulación; P: prospectivo; R: retrospectivo; T: transcutáneo.
|