Introducción
El trasplante de progenitores hematopoyéticos (TPH) es una técnica curativa para un gran número de patologías, la mayoría de las cuales no dispone de otro tipo de tratamiento [1,2]. Fue realizado por primera vez por Thomas en 1957 [3,4] y consiste en la sustitución de la función medular del paciente por otras células progenitoras hematopoyéticas [5]. Esta técnica presenta numerosos efectos secundarios y los más frecuentes son la pancitopenia por destrucción del sistema hematopoyético del paciente (anemia, leucopenia, con riesgo de infecciones, plaquetopenia, con el consiguiente riesgo de hemorragias) y la enfermedad del injerto contra el hospedador (EICH) por el efecto de los linfocitos del donante sobre el organismo receptor.
Por tanto, además de la quimioterapia para eliminar su función medular, el receptor de TPH deberá recibir tratamiento para prevenir dichas complicaciones y también para tratarlas en caso que aparezcan. Tanto estas complicaciones como sus tratamientos pueden producir diferentes efectos sobre el sistema nervioso, con características diferentes a las que suceden en pacientes inmunocompetentes [6-9].
La incidencia de las complicaciones neurológicas, según las series publicadas, es muy variable, entre un 10 y un 70% [10-14], y de hasta el 90% en una serie realizada a partir de necropsias [15]. Estas complicaciones varían en gravedad, desde leves hasta las que conllevan un elevado riesgo vital [16], y son la principal causa de muerte en el 10-15% de los pacientes [10,17]. La aparición de complicaciones neurológicas en un paciente sometido a TPH disminuye su supervivencia [18-20]. Además, algunos pacientes ya presentan alguna enfermedad neurológica previa (que puede ser apreciable clínicamente o no), que se descompensa en el proceso del TPH [21].
En general, dichas complicaciones se manifiestan con síntomas similares e inespecíficos (crisis epilépticas, cefalea, alteraciones variables del sensorio); además, los resultados de las exploraciones complementarias, en general, difieren de las de los pacientes inmunocompetentes. Sólo conociendo los factores de riesgo y las diferentes posibilidades diagnósticas podremos asegurar un diagnóstico precoz y un tratamiento dirigido que pueda disminuir la elevada morbimortalidad que presentan estos pacientes.
Objetivos
El objetivo del presente estudio es el de ofrecer una descripción de la clínica, los resultados de exploraciones complementarias y los posibles factores de riesgo asociados a la aparición de complicaciones neurológicas en el transcurso de un TPH.
Desarrollo
Se ha realizado una revisión bibliográfica empleando PubMed para consultar la base de datos MEDLINE. Se usaron los términos ‘neurological complications’, ‘CNS infection’, ‘posterior reversible encephalopathy syndrome’, ‘drug toxicity’, ‘stroke’, ‘stem cell transplantation’ y ‘bone marrow transplantation’ para la selección de artículos, y se limitó la búsqueda a los idiomas español e inglés, sin límite inferior en el año de publicación y con fecha de cierre del 20 de febrero de 2021.
A continuación, con la información obtenida, se procede a una descripción exhaustiva de las diferentes patologías que nos podemos encontrar en el contexto de un paciente sometido a TPH con clínica neurológica aguda.
En general, a nivel neurológico, se describen complicaciones secundarias a toxicidad farmacológica y metabólica [19], que son más frecuentes en los primeros 100 días tras el TPH, pero que pueden aparecer también después [22]. Las causas de dichas complicaciones son múltiples y, muy frecuentemente, coexisten en el mismo paciente: toxicidad del régimen de acondicionamiento, EICH y su tratamiento (sobre todo inhibidores de la calcineurina), infecciones y su tratamiento, plaquetopenia y trastornos de la coagulación, fallo hepático con coagulopatía asociada o hipertensión arterial con plaquetopenia [23]. También hay más complicaciones neurológicas si aparecen los grados III-IV de EICH en TPH que no sean de donante emparentado idéntico [10,24] y con el uso de irradiación corporal total como acondicionamiento [25]. En los niños, los factores de riesgo más frecuentemente detectados son la EICH crónica [26-28], el uso de ciclosporina y la asociación de quimio- y radioterapia [13,29].
Además, las complicaciones neurológicas son diferentes en función del momento en el que ocurran [16,20,28-32]. Así, se han descrito unas fases en el proceso del TPH en las que encontraremos complicaciones diferentes (Tabla I).
Tabla I. Fases del trasplante de progenitores hematopoyéticos y complicaciones más frecuentes.
|
| |
Definición
|
Complicaciones de esta fase
|
Preimplante
|
Desde inicio del acondicionamiento hasta que sucede el implante (presencia de recuperación granulocítica) (> 500/mL de neutrófilos, tres días consecutivos, sin administración de factor estimulante de colonias de granulocitos) y recuperación plaquetaria (> 20.000/mL durante siete días consecutivos sin transfusiones) [1]
|
Neurotoxicidad (busulfano, inhibidores de la calcineurina, criopreservante)
Hemorragias por plaquetopenia
Infecciones por leucopenia
Miopatía corticoidea
Neuropatía por inhibidores de la calcineurina
|
Postimplante precoz
|
Desde el implante hasta el día +100 Persiste la inmunosupresión celular
|
Infecciones por virus y gérmenes encapsulados, hongos y parásitos
Enfermedad del injerto contra el hospedador
Neurotoxicidad (inhibidores de la calcineurina)
Neuropatía por inhibidores de la calcineurina
|
Postimplante tardío
|
A partir del día +100
|
Enfermedad del injerto contra el hospedador
Neurotoxicidad (inhibidores de la calcineurina)
Neuropatía por inhibidores de la calcineurina
Recaída de la enfermedad neoplásica de base
Segundas neoplasias
|
Tipos de complicaciones neurológicas
Complicaciones infecciosas en el sistema nervioso central (SNC)
La incidencia de infecciones sobre el SNC varía entre el 0,8 y el 15%, según las series, e incluye bacterias, virus, protozoos y hongos. La sintomatología es inespecífica y la ausencia de fiebre en un paciente inmunodeprimido y, por tanto, sin capacidad de producir inflamación, no descarta la infección [33]. Esto, unido al hecho de que los síntomas pueden ser similares a los producidos por otras complicaciones del TPH, como la neurotoxicidad o los trastornos metabólicos, hace que el diagnóstico de la infección del SNC en el paciente trasplantado sea muy complejo [34].
Las infecciones del SNC parecen ser más frecuentes en el TPH de sangre de cordón umbilical, ya que el TPH de sangre de cordón umbilical provoca recuperación hematológica e inmunitaria tardía [35]. La etiología de las infecciones sobre el SNC depende de la fase del TPH en la que nos encontremos (Tabla II).
Tabla II. Gérmenes más frecuentemente responsables de infección en el receptor de trasplante de progenitores hematopoyéticos.
|
| |
Agentes infecciosos
|
Fase preimplante (desde el acondicionamiento hasta el implante): fase neutropénica
|
Bacterias
Hongos: Candida spp., Aspergillus spp., Fusarium spp.
Virus: VHS, VRS
Protozoo: Toxoplasma gondii
|
Fase postimplante precoz (desde el implante hasta el día +100): se ha resuelto la neutropenia, persiste la linfopenia
|
Bacterias
Virus: CMV, VVZ, VHH-6, VRS, adenovirus, virus BK
Hongos: Aspergillus spp., Pneumocystis jiroveci
Protozoo: Toxoplasma gondii
|
Fase postimplante tardío (> 100 días): persiste la linfopenia en pacientes bajo tratamiento inmunosupresor por EICH
|
Bacterias encapsuladas: Streptococcus pneumoniae, Haemophilus influenzae
Virus: CMV, VVZ, VHH-6, VRS, adenovirus, virus BK
Hongos: Aspergillus spp., Pneumocystis jiroveci
Protozoo: Toxoplasma gondii
|
CMV: citomegalovirus; EICH: enfermedad del injerto contra el hospedador; VHH-6: virus del herpes humano 6; VHS: virus del herpes simple; VRS: virus respiratorio sincitial; VVZ: virus de la varicela zóster.
|
A nivel de diagnóstico, será esencial la realización de neuroimagen, así como el análisis citoquímico y microbiológico del líquido cefalorraquídeo. En el caso de pacientes pancitopénicos, sin embargo, hay que tener en cuenta que, al presentar leucopenia, también presentarán escasa celularidad en el líquido cefalorraquídeo. Además, el predominio celular también variará conforme varíe en la sangre: en fases iniciales habrá neutropenia y linfopenia, que también se observará en el líquido cefalorraquídeo, y linfopenia aislada en fases más tardías (hasta un año pos-TPH); en esta fase, la relación entre neutrófilos y linfocitos en el líquido cefalorraquídeo no será la esperada (más neutrófilos que linfocitos incluso en las infecciones víricas o tuberculosis) [36]. En cambio, veremos con frecuencia hiperproteinorraquia (es decir, inflamación/destrucción parenquimatosa). Los cultivos bacteriológicos, así como la tinción de Gram, serán a menudo negativos, dado que la mayoría de estos pacientes estará recibiendo, probablemente, antibióticos de amplio espectro en el momento del estudio. La confirmación etiológica vendrá, por tanto, sobre todo a partir de determinación de reacción en cadena de la polimerasa (PCR) frente a los gérmenes más frecuentes, tanto virus como bacterias. Respecto a la neuroimagen, es frecuente que no encontremos edema perilesional ni lesiones inflamatorias por el mismo motivo.
Las infecciones bacterianas suelen aparecer en las fases de acondicionamiento y postrasplante precoz, en el contexto de una lesión de mucosa gastrointestinal y oral por la neutropenia, y especialmente relacionadas con la cateterización y otras técnicas durante la neutropenia. Su riesgo disminuye conforme aumenta la cifra de neutrófilos [29]. Las bacterias en el SNC pueden provocar meningitis y también abscesos cerebrales. En la meningitis se suele observar alteración del sensorio con escasos signos meníngeos por la escasa respuesta inflamatoria debido a la neutropenia; en el absceso cerebral, la alteración de consciencia suele ir asociada a un déficit focal que evoluciona rápidamente, con fiebre sólo en el 50% de los pacientes [37] (Fig. 1).
Figura 1. Resonancia magnética cerebral, axial, secuencia FLAIR. Abscesos cerebrales por Bacillus cereus. Lesiones nodulares hiperintensas en las regiones corticosubcorticales parietooccipitales bilaterales.

Respecto a las infecciones virales, los virus más frecuentemente detectados son el citomegalovirus, el virus del herpes simple 1, el virus de la varicela zóster y el virus del herpes humano 6. La profilaxis con aciclovir y la monitorización mediante PCR de citomegalovirus en la sangre han hecho que disminuya mucho la incidencia de encefalitis por el virus del herpes simple y por citomegalovirus, pero, en cambio, han emergido otros virus que no responden al aciclovir [30].
A nivel clínico, solamente el virus del herpes humano 6 presenta una sintomatología específica: al producir una encefalitis límbica, podemos encontrar amnesia anterógrada, sobre todo en evocación a corto plazo, crisis focales o focales secundariamente generalizadas, diversos grados de encefalopatía con inversión del ciclo vigilia-sueño, crisis de agitación alternas con letargo e insomnio de conciliación, cambios de personalidad y, además, hiponatremia e hipotermia por probable afectación hipotalámica (síndrome de secreción inadecuada de hormona antidiurética) [38,39]. Se ha descrito que, en los niños, la aparición de alucinaciones visuales suele ser más frecuente que en los adultos [40]. La neuroimagen es también muy específica en el caso de la encefalitis por el virus del herpes humano 6: hiperseñal de los lóbulos temporales mediales, en especial en el hipocampo y la amígdala, en secuencias en T2 y FLAIR (Fig. 2). Además, la PCR, tanto en la sangre como en el líquido cefalorraquídeo, es muy sensible para la detección de este virus. Por tanto, en un paciente sometido a TPH que presenta esta sintomatología tan sugestiva, se precisa un diagnóstico rápido y el inicio de tratamiento empírico al menos hasta que las exploraciones complementarias lo descarten, mediante biterapia con ganciclovir y foscarnet [41].
Figura 2. Resonancia magnética cerebral, axial, secuencia FLAIR. Encefalitis por virus del herpes humano 6. Atrofia temporal medial bilateral, especialmente de ambos hipocampos.
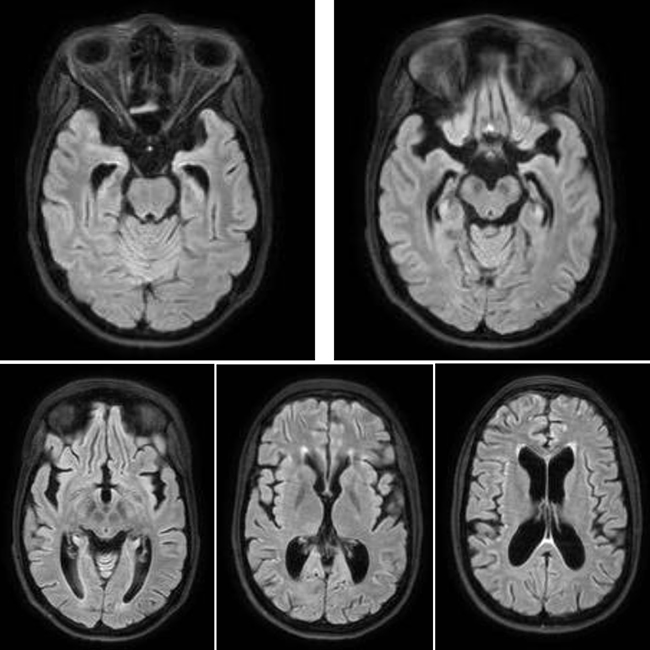
Aspergillus es un hongo que habitualmente provoca infecciones pulmonares o de los senos paranasales, pero puede diseminar por vía hematógena. Las hifas de Aspergillus son altamente angiotróficas: pueden provocar hemorragias e infartos agudos, y más adelante provocan cerebritis infecciosa y progresan a abscesos. A veces, pueden provocar también meningitis o granulomas. La sintomatología es muy inespecífica (crisis, encefalopatía), pero la resonancia magnética puede mostrar lesiones típicas, con captación de contraste en anillo con hipointensidad en T2 central, asociado a hemorragias focales y líneas intracavitarias que corresponden a las hifas. Hay que tener en cuenta que la captación de contraste puede ser mínima o ausente en casos de inmunosupresión grave [29]. La detección del antígeno galactomanano es muy específica de la infección por Aspergillus, pero es poco sensible. El tratamiento de elección es el voriconazol, por su mayor penetración en el SNC, pero hay formas resistentes.
Finalmente, Toxoplasma es también una causa frecuente de infección del SNC en pacientes sometidos a TPH, aunque su incidencia ha disminuido mucho gracias al uso de cotrimoxazol como profilaxis para Pneumocystis jiroveci, ya que Toxoplasma es también sensible a él. A nivel neurológico, Toxoplasma produce síntomas focales y varios grados de encefalopatía [30]. En la resonancia magnética se observan múltiples lesiones hiperintensas en secuencia en T2, con contraste en anillo, pero un mínimo efecto masa debido a la escasa capacidad del paciente de producir inflamación. El diagnóstico se confirma mediante PCR en el líquido cefalorraquídeo y para el tratamiento se basa en pirimetamina-sulfadiacina, cotrimoxazol en dosis altas o asociación de pirimetamina y clindamicina [29].
Complicaciones vasculares
Las complicaciones vasculares presentan una incidencia del 3,8-8% de los receptores de TPH [42] (y hasta el 50% en necropsias) y son más frecuentes en la fase postrasplante precoz (fase pancitopénica). En las fases más tardías, además, puede aparecer angeítis cerebral por EICH, con sangrado o infarto secundarios [43,44].
Dentro de las complicaciones neurológicas, las hemorrágicas son especialmente graves (Fig. 3). Entre los factores de riesgo encontramos la asociación de plaquetopenia durante la fase de pancitopenia e hipertensión arterial, que suele ser de causa farmacológica (especialmente secundaria a ciclosporina). Otros factores de riesgo descritos son la presencia de una infección sistémica concomitante y la presencia de EICH y su tratamiento [21,32]. Además, en el caso de hemorragias subaracnoideas, se debe descartar siempre la presencia de aneurismas micóticos [5].
Figura 3. Tomografía computarizada cerebral. Hemorragia cerebelosa que afecta al vermis y a ambos hemisferios cerebelosos, con componente de hemorragia subaracnoidea, hemorragia en el cuarto ventrículo y dilatación de los ventrículos laterales.
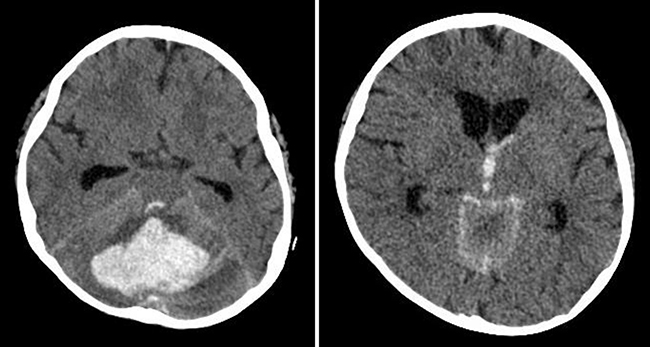
Las manifestaciones clínicas más frecuentes son las crisis, los déficits focales o la alteración del sensorio, a menudo precedidos de cefalea brusca [37].
A diferencia de lo que sucede en inmunocompetentes, el manejo de estos pacientes es casi exclusivamente sintomático, ya que suelen presentar una o más contraindicaciones para la cirugía (plaquetopenia, coagulopatía, inmunodeficiencia…). El tratamiento conservador será básicamente mantener la cifra de plaquetas por encima de 50.000/mm3, transfusiones de plasma si se asocia coagulopatía o factor VII activado en caso de sangrado activo.
El pronóstico global de las hemorragias intracraneales es muy desfavorable, porque la mayoría no son candidatos a neurocirugía [45]. La mortalidad es, sobre todo, en los primeros dos días tras el sangrado y, en los pocos supervivientes, las secuelas son muy graves [46].
Respecto a los ictus isquémicos, destacan los pacientes con drepanocitosis como enfermedad de base. Los pacientes con esta enfermedad tienen un riesgo de desarrollar ictus isquémicos hasta del 10% y, si han sufrido un ictus previo al TPH, el riesgo de presentar otro durante el TPH se eleva hasta casi el 50% [12]. Existen estrategias de transfusiones sanguíneas guiadas según eco-Doppler transcraneal para disminuir este riesgo [47]. También se pueden ver ictus isquémicos en contexto de estados protrombóticos o bien secundarios a un émbolo procedente de una endocarditis o tras una fibrilación auricular.
Toxicidad farmacológica
Los fármacos más frecuentemente asociados a neurotoxicidad son los inhibidores de la calcineurina (ciclosporina A y tacrolimús), los agentes citotóxicos usados en el acondicionamiento y fármacos antimetabolitos, pero también los antibióticos usados tanto en la profilaxis como en el tratamiento de las infecciones, como, por ejemplo, el imipenem y el meropenem o el aciclovir. El busulfano puede provocar crisis epilépticas, por lo que es habitual usar profilaxis antiepiléptica durante el acondicionamiento basado en este fármaco.
Además, otro problema asociado a los fármacos es que las interacciones entre ellos pueden condicionar otra toxicidad que quizás no sucedería si se usasen por separado [16]. Por ejemplo, se sabe que los corticoides empleados como tratamiento de la EICH pueden influir en los niveles de ciclosporina y, por tanto, empeorar sus efectos neurotóxicos. Finalmente, se debe tener también en cuenta que, en situación de fallo multiorgánico, en especial insuficiencia hepática y renal, los niveles plasmáticos de algunos fármacos pueden aumentar hasta alcanzar niveles tóxicos.
De entre todas las complicaciones que pueden aparecer como consecuencia de la neurotoxicidad de algunos fármacos, la leucoencefalopatía posterior reversible es la más característica. Se trata de una entidad clinicorradiológica bien definida, con características clínicas típicas, asociada a hallazgos en la resonancia magnética también típicos [31,48]. Se considera reversible, en general, y su fisiopatología se relaciona con el edema vasógeno cerebral. En el contexto del TPH, se debe muy frecuentemente al tratamiento con inhibidores de la calcineurina y se ha descrito su inicio coincidiendo con una crisis hipertensiva [21]. Se han descrito algunos factores predisponentes para su aparición, como la hipocolesterolemia, la hipomagnesemia y la hipertensión arterial [49]. Cuando se debe al uso de ciclosporina, parece ser independiente de sus niveles plasmáticos: unos niveles plasmáticos en rango terapéutico no descartan la aparición del cuadro, por lo que éste puede estar infraestimado. Además, aunque raro, se han descrito casos letales y casos con secuelas irreversibles [12].
A nivel clínico, se suele observar en su inicio cefalea, para progresar en 24-48 horas a alteración del sensorio, déficits visuales en grado variable (alucinaciones visuales, agnosia visual y hasta ceguera cortical), hipertensión arterial grave y crisis generalizadas, que suelen ser de inicio focal en los cuadrantes posteriores y pueden progresar a estados no convulsivos [50-52]. En la resonancia magnética se observan lesiones corticosubcorticales, hiperintensas en secuencias en T2 y FLAIR, de predominio posterior, que pueden restringir en difusión, pero, en general, sin realce de contraste [53-56]. En la mayoría de los casos, las lesiones son bilaterales, aunque pueden ser asimétricas (Fig. 4). Además, aproximadamente en un tercio de los pacientes se pueden afectar el cerebelo, los ganglios basales y el tronco [57].
Figura 4. Resonancia magnética cerebral, axial, secuencia FLAIR. Leucoencefalopatía posterior reversible. Se observan lesiones hiperintensas corticosubcorticales, bilaterales, más frecuentes en las regiones posteriores y también en ambos lóbulos frontales.
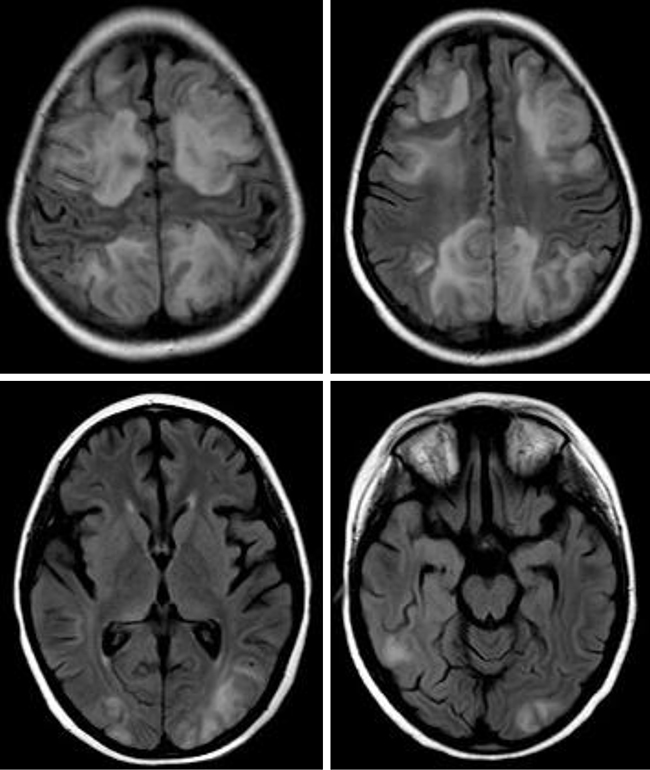
En general, es un proceso reversible, al tratar la hipertensión arterial y disminuir o suprimir el fármaco causante; a pesar de ello, el pronóstico puede ser desfavorable, ya que hasta el 80% de los pacientes desarrolla una EICH grave al suspender el inhibidor de la calcineurina responsable de la leucoencefalopatía posterior reversible, que difícilmente se controlará con otros tratamientos [6].
Complicaciones metabólicas
Los pacientes sometidos a TPH están en riesgo de desarrollar numerosas complicaciones a nivel metabólico. Algunos fármacos que se usan tanto para el acondicionamiento como para la profilaxis o el tratamiento de la EICH pueden provocar alteraciones iónicas, pero también la EICH intestinal puede provocar malnutrición, con la consiguiente alteración iónica secundaria. Además, un fallo renal o hepático, secundario a toxicidad farmacológica, a la propia EICH o a infecciones, por ejemplo, puede provocar alteraciones metabólicas.
Los trastornos metabólicos pueden producir varios síntomas a nivel neurológico, por ejemplo, encefalopatía (como en el fallo hepático) o neuropatía periférica (como en la hipomagnesemia), entre otros.
La encefalopatía metabólica se presenta, sobre todo, en las fases del preimplante y el postimplante precoz del TPH, y puede deberse a varias causas, a menudo incluso pueden aparecer varias causas a la vez en un mismo paciente. Los diferentes tipos de encefalopatía metabólica se encuentran en la tabla III.
Tabla III. Tipos de encefalopatía metabólica.
|
Encefalopatía hepática
|
En infecciones, en la EICH hepática y en la enfermedad venooclusiva hepática
|
Encefalopatía urémica
|
En la nefropatía inducida por inhibidores de la calcineurina y en la microangiopatía trombótica
|
Encefalopatía de Wernicke
|
Déficit de tiamina por elevado consumo de tiamina en la fase de recuperación hematológica, uso de soluciones de nutrición parenteral con bajo aporte, pérdidas secundarias a los vómitos por quimioterapia
|
Mielinólisis central pontina
|
Corrección rápida de hiponatremia secundaria a malnutrición (EICH intestinal), nefropatía por inhibidores de la calcineurina
|
EICH: enfermedad del injerto contra el hospedador.
|
Carcinogenia postrasplante de progenitores hematopoyéticos
El riesgo global de tumor cerebral es mayor tras un TPH que en la población general [58,59], lo que se atribuye, en gran parte, al uso de irradiación corporal total como parte del acondicionamiento [58,60]. Sobre todo en niños que han recibido dosis altas, en el SNC, pueden aparecer glioblastomas, astrocitomas, linfomas y meningiomas [29].
Respecto a las recurrencias de enfermedades de base, las neoplasias sanguíneas con afectación primaria del SNC y la afectación craneofacial o vertebral en el diagnóstico aumentan el riesgo, tanto de recaída a nivel del SNC tras el TPH como de más complicaciones neurológicas durante el TPH. Por ello, la terapia intratecal profiláctica es obligatoria en todos los pacientes con alto riesgo de recaída en el SNC [16].
El trastorno linfoproliferativo post-TPH es un trastorno consecuencia de la infección por el virus de Ebstein-Barr, que provoca una proliferación de linfocitos B infectados que el sistema inmunitario del paciente inmunodeprimido no puede controlar. El espectro clínico de los trastornos linfoproliferativos es muy amplio, desde síntomas generales, como fiebre, fatiga e inapetencia, hasta clínica neurológica específica, como crisis, depresión del sensorio o síntomas focales. La resonancia magnética cerebral puede mostrar lesiones múltiples hipo- o isointensas en T1 e hiperintensas en T2, con captación de contraste en ambos hemisferios, con afectación de la sustancia blanca subcortical, periventricular y de los ganglios basales; suelen, además, tener un anillo de realce de contraste, lo que lo asemeja al linfoma cerebral [61]. Para su diagnóstico, además, se debe demostrar la reactivación del virus de Ebstein-Barr en el plasma. El tratamiento recomendado es, en primer lugar, disminuir la inmunosupresión del paciente y, si no fuera suficiente, rituximab [62].
Trastornos inmunomediados
Tras un TPH son relativamente frecuentes los fenómenos autoinmunitarios: citopenias autoinmunitarias, disfunción tiroidea, etc. El mecanismo para desarrollar esta autoinmunidad no se conoce claramente, pero se postula que es una desregulación del sistema inmunitario en el período pos-TPH [16].
A nivel del SNC, la enfermedad desmielinizante inmunomediada se asemeja a una encefalitis. Es muy poco frecuente y, por tanto, para su diagnóstico, primero se deberían descartar procesos infecciosos. Además, debe diferenciarse de la que sucede en el contexto de una EICH. El tratamiento es similar a otras encefalitis autoinmunitarias: corticoides, inmunoglobulinas, recambio plasmático terapéutico o una combinación de éstos. El tratamiento precoz intensivo se ha visto que puede asociar mejor pronóstico [63].
Enfermedad del injerto contra el hospedador
La EICH puede afectar a muchos órganos, como el aparato digestivo, el hígado, la piel, los pulmones y el sistema nervioso periférico, en diferente gravedad y, muy infrecuentemente, también puede afectar al SNC [64,65]. Su gravedad se clasifica de acuerdo con el número de órganos afectados y la gravedad de la afectación [64].
A nivel del sistema nervioso periférico, puede producir cuadros de polimiositis, polirradiculoneuropatía aguda (similar al síndrome de Guillain-Barré) o miastenia grave.
La afectación cerebral de la EICH se discute ampliamente, pero, si se presenta, suele verse en la fase crónica (EICH crónica) y puede aparecer desde meses hasta años tras el TPH [66]. Típicamente, los síntomas aparecerán durante o tras el descenso de la inmunosupresión [67].
Las formas clínicas descritas para el SNC son [6]:
- Enfermedad cerebrovascular. La afectación de vaso mediano se manifiesta como un ictus, con déficits focales. En cambio, la enfermedad de vaso pequeño se asemeja a una vasculitis, con síntomas inespecíficos (cefalea, déficit cognitivo y crisis, entre otros) de curso típicamente progresivo [68]. En los niños, además, fiebre, malestar general o cuadro seudogripal.
- Procesos desmielinizantes, con curso similar al de la esclerosis múltiple [69]. En los niños, el diagnóstico de EICH cerebral ante la presencia de desmielinización debería ser aún más cauto, porque ésta puede aparecer por otros motivos: el SNC del niño es más vulnerable a la terapia mieloablativa y las infecciones o reactivaciones virales parecen ser más frecuentes en los niños que en los adultos [65].
Debido a la dificultad en su diagnóstico, por la inespecificidad de los síntomas, y a la necesidad de biopsia cerebral para confirmar la mayoría de los casos, se han establecido unos criterios para el diagnóstico de EICH cerebral [65]:
- Criterios mayores:
- Los síntomas neurológicos ocurren a la vez que otros signos de EICH crónica en otras localizaciones.
- Afectación neurológica de la que no se encuentra otra causa más frecuente.
- Criterios menores:
- Alteración compatible en la resonancia magnética cerebral.
- Alteraciones en el líquido cefalorraquídeo sugestivas de inflamación (pleocitosis, hiperproteinorraquia, elevación de la inmunoglobulina G y bandas oligoclonales).
- Hallazgos compatibles en la biopsia cerebral.
- Respuesta al tratamiento inmunosupresor.
Para el diagnóstico definitivo se requieren los seis criterios, pero, para un diagnóstico probable, sólo los dos criterios mayores y otros dos de los menores [11,65].
Microangiopatía trombótica
La microangiopatía trombótica es consecuencia del daño endotelial producido no sólo por el propio TPH, sino también por fármacos quimioterapéuticos o inmunosupresores. Este daño endotelial provoca una activación plaquetaria, responsable de la formación de trombos que ocluyen la microvasculatura [70]. Esto provoca una isquemia tisular, que es la responsable del fallo de los diferentes órganos afectados, y, además, provoca ruptura de los hematíes que pasan a su través, con la consiguiente anemia hemolítica (prueba de Coombs negativa) [71]. De entre todos los órganos, el riñón es el más frecuentemente afectado y, clásicamente, se ha entendido que cualquier afectación de cualquier otro órgano, para considerarse como secundaria a una microangiopatía trombótica, debe ir asociada a fallo renal. La microangiopatía trombótica se asocia también muy frecuentemente a afectación neurológica con diferentes grados de alteración del sensorio [16] y empeora el pronóstico de la microangiopatía trombótica. Los déficits neurológicos pueden estar presentes al menos en el 30% de los pacientes [72] y los más frecuentes son los visuales. La neuroimagen puede mostrar alteraciones similares a las observadas en la leucoencefalopatía posterior reversible. El tratamiento consiste en suspender los fármacos que lo pueden causar (como los inhibidores de la calcineurina o el sirolimús) [16], además de asociar fármacos como el rituximab, la defibrotida o el eculizumab.
Conclusiones
El paciente sometido a TPH es de especial riesgo para el desarrollo de complicaciones neurológicas. Se pueden encontrar múltiples patologías, desde infecciosas a vasculares, metabólicas o tóxicas, pero, sin embargo, se observa una sintomatología en general inespecífica, como cefalea, crisis epilépticas y diferentes grados de encefalopatía. Se precisa un elevado índice de sospecha, la realización de exploraciones complementarias de forma precoz y el inicio de un tratamiento empírico para intentar disminuir la elevada morbimortalidad que conllevan.
Bibliografía
↵ 1. Hamidieh AA, Monzavi SM, Kaboutari M, Behfar M, Esfandbod M. Outcome analysis of pediatric patients with acute lymphoblastic leukemia treated with total body irradiation-free allogeneic hematopoietic stem cell transplantation: comparison of patients with and without central nervous system involvement. Biol Blood Marrow Transplant 2017; 23: 2110-7.
↵ 2. Madero L, Sevilla J. Transplant of hematopoietic stem cells in X-linked adrenoleukodystrophy. Rev Neurol 2001; 33: 225-7.
↵ 3. Thomas ED, Lochte HL, Lu WC, Ferrebee JW. Intravenous infusion of bone marrow in patients receiving radiation and chemotherapy. N Engl J Med 1957; 257: 491-6.
↵ 4. Thomas ED, Buckner CD, Clift RA, Fefer A, Johnson FL, Neiman PE, et al. Marrow transplantation for acute nonlymphoblastic leukemia in first remission. N Engl J Med 1979; 301: 597-9.
↵ 5. Maziarz RT. Overview of haematopoietic stem cell transplantation. In Maziarz RT, Slater S, eds. Blood and marrow transplant handbook. Comprehensive guide for patient care. 2 ed. New York: Springer; 2015. p. 3-9.
↵ 6. Rodriguez TE. Neurologic complications of bone marrow transplantation. Handb Clin Neurol 2014; 121: 1295-304.
↵ 7. Sostak P, Padovan CS, Yousry TA, Ledderose G, Kolb H-J, Straube A. Prospective evaluation of neurological complications after allogeneic bone marrow transplantation. Neurology 2003; 60: 842-8.
↵ 8. Denier C, Bourhis J-H, Lacroix C, Koscielny S, Bosq J, Sigal R, et al. Spectrum and prognosis of neurologic complications after hematopoietic transplantation. Neurology 2006; 67: 1990-7.
↵ 9. Koh KN, Park M, Kim BE, Im HJ, Seo JJ. Early central nervous system complications after allogeneic hematopoietic stem cell transplantation in children. Korean J Hematol 2010; 45: 164-70.
↵ 10. Chen BT, Ortiz AO, Dagis A, Torricelli C, Parker P, Openshaw H. Brain imaging findings in symptomatic patients after allogeneic haematopoietic stem cell transplantation: correlation with clinical outcome. Eur Radiol 2012; 22: 2273-81.
↵ 11. Stefanou MI, Bischof F. Central and peripheral nervous system immune-mediated demyelinating disease after allogeneic hematopoietic stem cell transplantation. J Neuroimmunol 2017; 307: 74-81.
↵ 12. Uckan D, Cetin M, Yigitkanli I, Tezcan I, Tuncer M, Karasimav D, et al. Life-threatening neurological complications after bone marrow transplantation in children. Bone Marrow Transplant 2005; 35: 71-6.
↵ 13. Rubin J, Wide K, Remberger M, Gustafsson B. Acute neurological complications after hematopoietic stem cell transplantation in children. Pediatr Transplant 2005; 9: 62-7.
↵ 14. Siegal D, Keller A, Xu W, Bhuta S, Kim DH, Kuruvilla J, et al. Central nervous system complications after allogeneic hematopoietic stem cell transplantation: incidence, manifestations, and clinical significance. Biol Blood Marrow Transplant 2007; 13: 1369-79.
↵ 15. Bleggi-Torres LF, de Medeiros BC, Werner B, Neto JZ, Loddo G, Pasquini R, et al. Neuropathological findings after bone marrow transplantation: an autopsy study of 180 cases. Bone Marrow Transplant 2000; 25: 301-7.
↵ 16. Maffini E, Festuccia M, Brunello L, Boccadoro M, Giaccone L, Bruno B. Neurologic complications after allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2017; 23: 388-97.
↵ 17. Weber C, Schaper J, Tibussek D, Adams O, Mackenzie CR, Dilloo D, et al. Diagnostic and therapeutic implications of neurological complications following paediatric haematopoietic stem cell transplantation. Bone Marrow Transplant 2008; 41: 253-9.
↵ 18. Balaguer-Rosello A, Bataller L, Piñana JL, Montoro J, Lorenzo I, Villalba A, et al. Noninfectious neurologic complications after allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2019; 25: 1818-24.
↵ 19. Bhatt VR, Balasetti V, Jasem JA, Giri S, Armitage JO, Loberiza FR, et al. Central nervous system complications and outcomes after allogeneic hematopoietic stem cell transplantation. Clin Lymphoma Myeloma Leuk 2015; 15: 606-11.
↵ 20. Colombo AA, Marchioni E, Diamanti L, Di Matteo AM, Baldanti F, Furione M, et al. Neurological complications involving the central nervous system after allogeneic hematopoietic stem cell transplantation during a period of evolution in transplant modalities: a cohort analysis. Transplantation 2017; 101: 616-23.
↵ 21. Pustavoitau A, Bhardwaj A, Stevens R. Neurological complications of transplantation. J Intensive Care Med 2011; 26: 209-22.
↵ 22. Barba P, Piñana JL, Valcárcel D, Querol L, Martino R, Sureda A, et al. Early and late neurological complications after reduced-intensity conditioning allogeneic stem cell transplantation. Biol Blood Marrow Transplant 2009; 15: 1439-46.
↵ 23. Sakellari I, Gavriilaki E, Papagiannopoulos S, Gavriilaki M, Batsis I, Mallouri D, et al. Neurological adverse events post allogeneic hematopoietic cell transplantation: major determinants of morbidity and mortality. J Neurol 2019; 266: 1960-72.
↵ 24. de Brabander C, Cornelissen J, Smitt PA, Vecht CJ, van den Bent MJ. Increased incidence of neurological complications in patients receiving an allogenic bone marrow transplantation from alternative donors. J Neurol Neurosurg Psychiatry 2000; 68: 36-40.
↵ 25. Cao XY, Wu T, Lu Y, Wang JB, Yin YM, Lu DP. A study of the central nervous system complications after hematopoietic stem cell transplantation. Zhonghua Nei Ke Za Zhi 2010; 49: 42-4.
↵ 26. Kang JM, Kim YJ, Kim JY, Cho EJ, Lee JH, Lee MH, et al. Neurologic complications after allogeneic hematopoietic stem cell transplantation in children: analysis of prognostic factors. Biol Blood Marrow Transplant 2015; 21: 1091-8.
↵ 27. Dulamea AO, Lupescu IG. Neurological complications of hematopoietic cell transplantation in children and adults. Neural Regeneration Research 2018; 13: 945.
↵ 28. Iguchi A, Kobayashi R, Yoshida M, Kaneda M, Watanabe N, Cho Y, et al. Neurological complications after stem cell transplantation in childhood. Bone Marrow Transplant 1999; 24: 647-52.
↵ 29. Chaudhary RK, Dhakal P, Aryal A, Bhatt VR. Central nervous system complications after allogeneic hematopoietic stem cell transplantation. Future Oncol 2017; 13: 2297-312.
↵ 30. Saiz A, Graus F. Neurological complications of hematopoietic cell transplantation. Semin Neurol 2004; 24: 427-34.
↵ 31. Azik F, Yazal Erdem A, Tavil B, Bayram C, Tunç B, Uçkan D. Neurological complications after allogeneic hematopoietic stem cell transplantation in children, a single center experience. Pediatr Transplant 2014; 18: 405-11.
↵ 32. Zhang XH, Wang QM, Chen H, Chen YH, Han W, Wang FR, et al. Clinical characteristics and risk factors of intracranial hemorrhage in patients following allogeneic hematopoietic stem cell transplantation. Ann Hematol 2016; 95: 1637-43.
↵ 33. Hanajiri R, Kobayashi T, Yoshioka K, Watanabe D, Watakabe K, Murata Y, et al. Central nervous system infection following allogeneic hematopoietic stem cell transplantation. Hematol Oncol Stem Cell Ther 2017; 10: 22-8.
↵ 34. Schmidt-Hieber M, Silling G, Schalk E, Heinz W, Panse J, Penack O, et al. CNS infections in patients with hematological disorders (including allogeneic stem-cell transplantation)-Guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Medical Oncology (DGHO). Ann Oncol 2016; 27: 1207-25.
↵ 35. Balaguer Rosello A, Bataller L, Lorenzo I, Jarque I, Salavert M, González E, et al. Infections of the central nervous system after unrelated donor umbilical cord blood transplantation or human leukocyte antigen–matched sibling transplantation. Biol Blood Marrow Transplant 2017; 23: 134-9.
↵ 36. Schmidt-Hieber M, Engelhard D, Ullmann A, Ljungman P, Maertens J, Martino R, et al. Central nervous system disorders after hematopoietic stem cell transplantation: a prospective study of the Infectious Diseases Working Party of EBMT. J Neurol 2020; 267: 430-9.
↵ 37. Cordelli DM, Masetti R, Zama D, Toni F, Castelli I, Ricci E, et al. Central nervous system complications in children receiving chemotherapy or hematopoietic stem cell transplantation. Front Pediatr 2017; 5: 105.
↵ 38. Murakami K, Kohashi S, Sakurai M, Kato J, Toyama T, Koda Y, et al. Hyponatremia associated with human herpesvirus-6 (HHV-6) encephalitis after allogeneic hematopoietic stem cell transplantation: A presentation different from HHV-6 myelitis. Int J Hematol 2017; 106: 436-40.
↵ 39. Seeley WW, Marty FM, Holmes TM, Upchurch K, Soiffer RJ, Antin JH, et al. Post-transplant acute limbic encephalitis: clinical features and relationship to HHV6. Neurology 2007; 69: 156-65.
↵ 40. Sadighi Z, Sabin ND, Hayden R, Stewart E, Pillai A. Diagnostic clues to human herpesvirus 6 encephalitis and wernicke encephalopathy after pediatric hematopoietic cell transplantation. J Child Neurol 2015; 30: 1307-14.
↵ 41. Ogata M, Oshima K, Ikebe T, Takano K, Kanamori H, Kondo T, et al. Clinical characteristics and outcome of human herpesvirus-6 encephalitis after allogeneic hematopoietic stem cell transplantation. Bone Marrow Transplant 2017; 52: 1563-70.
↵ 42. Teive HAG, Funke V, Bitencourt MA, de Oliveira MM, Bonfim C, Zanis-Neto J, et al. Neurological complications of hematopoietic stem cell transplantation (HSCT): a retrospective study in a HSCT center in Brazil. Arq Neuropsiquiatr 2008; 66: 685-90.
↵ 43. Yoshida S, Hayakawa K, Yamamoto A, Kuroda H, Imashuku S. The central nervous system complications of bone marrow transplantation in children. Eur Radiol 2008; 18: 2048-59.
↵ 44. Coplin WM, Cochran MS, Levine SR, Crawford SW. Stroke after bone marrow transplantation: frequency, aetiology and outcome. Brain 2001; 124: 1043-51.
↵ 45. Najima Y, Ohashi K, Miyazawa M, Nakano M, Kobayashi T, Yamashita T, et al. Intracranial hemorrhage following allogeneic hematopoietic stem cell transplantation. Am J Hematol 2009; 84: 298-301.
↵ 46. Mannina D, Berneking L, Both A, Timm W, Urbanowicz T, Wolschke C, et al. Major central nervous system complications after allogeneic stem cell transplantation: a large retrospective study on 888 consecutive adult patients. Eur J Haematol 2020; 105: 722-30.
↵ 47. Kanter J, Phillips S, Schlenz AM, Mueller M, Dooley M, Sirline L, et al. Transcranial Doppler screening in a current cohort of children with sickle cell anemia: results from the DISPLACE study. J Pediatr Hematol Oncol 2021; Mar 31. doi: 10.1097/MPH.0000000000002103. [Epub ahead of print].
↵ 48. Masetti R, Cordelli DM, Zama D, Vendemini F, Biagi C, Franzoni E, et al. PRES in children undergoing hematopoietic stem cell or solid organ transplantation. Pediatrics 2015; 135: 890-901.
↵ 49. Hun M, Tian J, Xie M, She Z, Abdirahman AS, Han P, et al. Analysis of risk factors associated with poor outcome in posterior reversible encephalopathy syndrome after treatment in children: systematic review and meta-analysis. Front Neurol 2020; 11: 938.
↵ 50. Zama D, Masetti R, Cordelli DM, Vendemini F, Giordano L, Milito G, et al. Risk factor analysis of posterior reversible encephalopathy syndrome after allogeneic hematopoietic SCT in children. Bone Marrow Transplant 2014; 49: 1538-40.
↵ 51. Lee VH, Wijdicks EFM, Manno EM, Rabinstein AA. Clinical spectrum of reversible posterior leukoencephalopathy syndrome. Arch Neurol 2008; 65: 205-10.
↵ 52. Cordelli DM, Masetti R, Zama D, Toni F, Castelli I, Ricci E, et al. Central nervous system complications in children receiving chemotherapy or hematopoietic stem cell transplantation. Front Pediatr 2017; 5: 105.
↵ 53. Bartynski WS. Posterior reversible encephalopathy syndrome, part 1: fundamental imaging and clinical features. AJNR Am J Neuroradiol 2008; 29: 1036-42.
↵ 54. Servillo G, Bifulco F, De Robertis E, Piazza O, Striano P, Tortora F, et al. Posterior reversible encephalopathy syndrome in intensive care medicine. Intensive Care Med 2007; 33: 230-6.
↵ 55. Fugate JE, Rabinstein AA. Posterior reversible encephalopathy syndrome: clinical and radiological manifestations, pathophysiology, and outstanding questions. Lancet Neurol 2015; 14: 914-25.
↵ 56. Syed FI, Couriel DR, Frame D, Srinivasan A. Central nervous system complications of hematopoietic stem cell transplant. Hematol Oncol Clin North Am 2016; 30: 887-98.
↵ 57. Bartynski W, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. AJNR Am J Neuroradiol 2007; 28: 1320-7.
↵ 58. Sisinni L, Gich I, Torrent M, Badell I. [Subsequent malignancies after long-term follow-up of pediatric hematopoietic stem cell transplantation]. An Pediatr (Barc) 2019; 90: 157-64.
↵ 59. Deeg HJ, Socie G. Malignancies after hematopoietic stem cell transplantation: many questions, some answers. Blood 1998; 91: 1833-44.
↵ 60. Adhikari J, Sharma P, Bhatt VR. Risk of secondary solid malignancies after allogeneic hematopoietic stem cell transplantation and preventive strategies. Future Oncol 2015; 11: 3175-85.
↵ 61. Castellano-Sanchez AA, Li S, Qian J, Lagoo A, Weir E, Brat DJ. Primary central nervous system posttransplant lymphoproliferative disorders. Am J Clin Pathol 2004; 121: 246-53.
↵ 62. Mashima K, Yano S, Yokoyama H, Saito T, Machishima T, Shimada T, et al. Epstein-Barr Virus-associated lymphoproliferative disorder with encephalitis following anti-thymocyte globulin for aplastic anemia resolved with rituximab therapy: a case report and literature review. Internal Medicine 2017; 56: 701-6.
↵ 63. Rathore GS, Leung KS, Muscal E. Autoimmune encephalitis following bone marrow transplantation. Pediatr Neurol 2015; 53: 253-6.
↵ 64. Filipovich AH, Weisdorf D, Pavletic S, Socie G, Wingard JR, Lee SJ, et al. National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: I. Diagnosis and staging working group report. Biol Blood Marrow Transplant 2005; 11: 945-56.
↵ 65. Grauer O, Wolff D, Bertz H, Greinix H, Kühl J-S, Lawitschka A, et al. Neurological manifestations of chronic graft-versus-host disease after allogeneic haematopoietic stem cell transplantation: report from the Consensus Conference on Clinical Practice in chronic graft-versus-host disease. Brain 2010; 133: 2852-65.
↵ 66. Kamble RT, Chang C-C, Sanchez S, Carrum G. Central nervous system graft-versus-host disease: report of two cases and literature review. Bone Marrow Transplant 2007; 39: 49-52.
↵ 67. Solaro C, Murialdo A, Giunti D, Mancardi G, Uccelli A. Central and peripheral nervous system complications following allogeneic bone marrow transplantation. Eur J Neurol 2001; 8: 77-80.
↵ 68. Campbell JN, Morris PP. Cerebral vasculitis in graft-versus-host disease: a case report. AJNR Am J Neuroradiol 2005; 26: 654-6.
↵ 69. Shortt J, Hutton E, Faragher M, Spencer A. Central nervous system graft-versus-host disease post allogeneic stem cell transplant. Br J Haematol 2006; 132: 245-7.
↵ 70. Jodele S, Laskin BL, Dandoy CE, Myers KC, El-Bietar J, Davies SM, et al. A new paradigm: diagnosis and management of HSCT-associated thrombotic microangiopathy as multi-system endothelial injury. Blood Rev 2015; 29: 191-204.
↵ 71. Renaudon-Smith E, De La Fuente J, Bain BJ. Transplant-associated thrombotic microangiopathy. Am J Hematol 2016; 91: 1160.
↵ 72. Kraft S, Bollinger N, Bodenmann B, Heim D, Bucher C, Lengerke C, et al. High mortality in hematopoietic stem cell transplant-associated thrombotic microangiopathy with and without concomitant acute graft-versus-host disease. Bone Marrow Transplant 2019; 54: 540-8.
Neurological complications in haematopoietic stem cell transplant patients
Introduction. Neurological complications are some of the most important complications that can occur in a patient undergoing haematopoietic stem cell transplantation (HSCT), not only because of the high mortality rate, but also because of the sequelae that appear in survivors. The causes of such complications are manifold and very often coexist in the same patient: toxicity of the conditioning regimen, graft-versus-host disease and its treatment, infections and their treatment, platelets and coagulation disorders, liver failure or arterial hypertension with low platelet count.
Aims. The aim of the present study is to provide a clinical description and to describe the risk factors for complications involving the central nervous system that may occur during the course of HSCT, in order to assist in the early detection of these disorders that may have a negative influence on the morbidity and mortality of these patients.
Development. The following types of neurological complications are described: central nervous system infections, vascular complications, pharmacological toxicity, metabolic complications, immune-mediated disorders and post-HSCT carcinogenesis, and effects of graft-versus-host disease and thrombotic microangiopathy on the nervous system.
Conclusions. The patient undergoing HSCT is at particular risk for the development of neurological complications. Early diagnosis and treatment are needed to try to reduce the high morbidity and mortality in these patients.
Key words. Central nervous system infection. Drug toxicity. Graft versus host disease. Neurological disorders. Posterior leukoencephalopathy syndrome. Stem cell transplantation.
|
© 2021 Revista de Neurología






