Apomorphine and frontal dysfunction in Parkinson’s disease
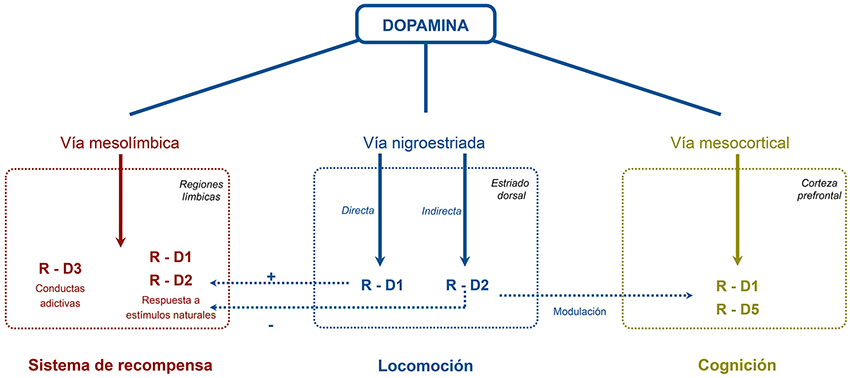
Introduction. Dysexecutive disorder and apathy are characteristic symptoms of frontal dysfunction linked to Parkinson’s disease. The effect of continuous subcutaneous apomorphine infusion is not known in detail.
Development. A search for the most relevant studies published to date in this field was carried out, along with their analysis. Apomorphine achieves improvements in tests that measure tasks such as planning, attention, verbal fluency and apathy.
Conclusions. Due to its distinctive pharmacological profile, with enhanced activity on D1-type dopaminergic receptors, apomorphine may have beneficial effects on the frontal dysfunction produced by the disease.
Key words. Advanced therapies. Apathy. Apomorphine. Cognitive deterioration. Frontal dysfunction. Parkinson’s disease.
|