Introducción
Los fosfolípidos son constituyentes esenciales de las células, específicamente de las membranas celulares, y presentan una tasa de recambio muy elevada, lo que supone una síntesis continua de estos compuestos para garantizar el buen funcionamiento de las membranas celulares y, por ende, de las células [1-3].
La estructura química de un fosfolípido muestra la esterificación de un polialcohol (glicerol o esfingosina) con dos ácidos grasos de cadena larga y una molécula de ácido fosfórico, que, a su vez, está esterificada con bases nitrogenadas (colina, etanolamina), aminoácidos (serina) o inositol [3,4]. Los principales fosfolípidos en el hombre son la fosfatidilcolina, la fosfatidiletanolamina, el fosfatidilinositol y la esfingomielina [4]. El principal fosfolípido presente en la mayoría de las membranas eucarióticas es la fosfatidilcolina, que comprende ~50% del contenido de fosfolípidos [5]. Su principal función consiste en formar parte de las estructuras de las membranas celulares, y son imprescindibles para el cumplimiento de las funciones de membrana, entre las que destaca el mantenimiento de la homeostasis y de la compartimentalización celular, así como de las actividades enzimáticas asociadas a los sistemas membranosos, y el acoplamiento entre receptor y señal intracelular [1]. Por lo tanto, los fosfolípidos desempeñan un papel fundamental en la regulación de las funciones fisiológicas y el mantenimiento de las estructuras de la membrana celular [6], sirven como fuente de varios mediadores lipídicos [7] y orquestan la inmunidad humoral, destacando el control metabólico de la señalización inmune dependiente del contexto y los programas efectores [8]. En el caso de la membrana neuronal, se añaden las funciones específicas de la conducción y de la transmisión del impulso nervioso [1,9].
Existen diversas situaciones en las que existe una pérdida de fosfolípidos o una disminución de su síntesis, lo que conlleva un deterioro de las funciones celulares, que puede tener trascendencia fisiopatológica [1,10]. En el sistema nervioso central, los fosfolípidos estructurales de la membrana neuronal son imprescindibles para una correcta maduración cerebral [11-14], incluyendo la astroglía [15]. La fosfatidilcolina se ha promulgado como un importante mediador del crecimiento neurítico y de la regeneración neuronal [16]. Asimismo, se ha implicado la alteración de la membrana celular y del metabolismo fosfolipídico en la fisiopatología del edema cerebral y de la lesión cerebral traumática [17-26], así como de la hipoxia [27,28] y la isquemia cerebral [29-42]. Por otro lado, se ha demostrado que existen determinadas alteraciones de la membrana neuronal y del metabolismo de los fosfolípidos estructurales asociadas al envejecimiento cerebral [43-45] y a ciertas enfermedades neurodegenerativas, como la demencia senil de tipo Alzheimer [39, 46-58], promoviendo mecanismos de neuroplasticidad [59], y en otros procesos en los que además se implican alteraciones en la neurotransmisión [60-63] y la agresión excitotóxica [64,65]. Recientemente se han involucrado alteraciones del metabolismo fosfolipídico, especialmente de la fosfatidilcolina, como mecanismos inductores de apoptosis [62-71]. Dadas estas condiciones fisiopatológicas, es conveniente disponer de fármacos que, en tales situaciones, puedan acelerar y/o incrementar la síntesis de los fosfolípidos estructurales de membrana, es decir, que posean una actividad restauradora o reparadora [72-77].
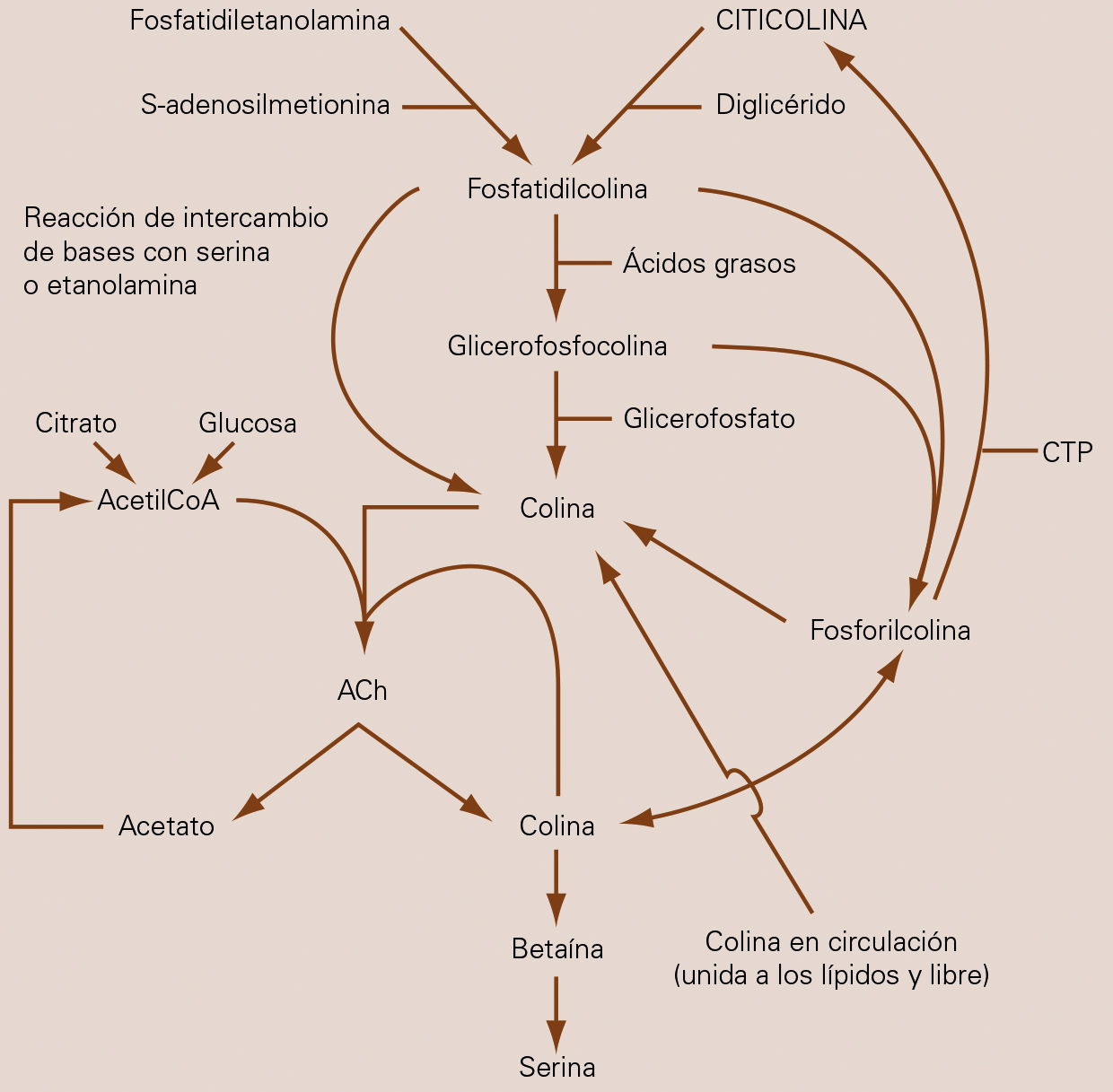
Citicolina es el nombre genérico de la sustancia farmacéutica que químicamente corresponde a la citidina-5’-difosfocolina (CDP-colina), que es idéntica al precursor intracelular natural del fosfolípido fosfatidilcolina [78]. El citidindifosfato de colina (CDP-colina o citicolina) es un mononucleótido constituido por ribosa, citosina, pirofosfato y colina, cuya estructura química (Fig. 1) corresponde a la 2-oxi-4-aminopirimidina [79]. La CDP-colina participa como intermediario imprescindible de la síntesis de los fosfolípidos estructurales de las membranas celulares [4,78-92], y la formación de este compuesto, a partir de fosforilcolina, es el paso limitante de esta vía biosintética [82,93-104]. El ciclo de la CDP-colina está integrado en diversas vías metabólicas y su interrupción puede afectar a la distribución de diversos metabolitos lipídicos [105]. Como se muestra en la figura 2, la CDP-colina, además, se relaciona con el metabolismo de la acetilcolina. De esta forma, la administración de CDP-colina supone una fuente de aporte exógeno de colina y citidina. La colina participa en numerosos y relevantes procesos neuroquímicos. Es precursora y metabolito de la acetilcolina, desempeña un importante papel en el metabolismo del carbono y es un componente esencial de diferentes fosfolípidos de membrana [106]. La fracción citidina, una vez se transforma en uridina, se usa para la síntesis de ADN y ARN, así como para la síntesis de diversos componentes membranarios y la glucosilación, sin obviar la acción que ejerce sobre receptores purinérgicos [107].
Figura 1. Estructura química de la CDP-colina o citicolina.

Figura 2. Relación de la citicolina con el metabolismo de la colina, los fosfolípidos cerebrales y la acetilcolina.
Acciones farmacológicas
Lesiones traumáticas y edema cerebral experimental
Javaid et al [108] describieron los cambios fisiopatológicos en los fosfolípidos cerebrales inducidos por lesión cerebral traumática, especialmente de fosfolípidos que contienen colina, como la fosfatidilcolina, y destacan el papel de las estrategias terapéuticas específicas de colina, como la administración de citicolina, para la mejora de la lesión cerebral traumática.
Horrocks y Dorman [109] han comprobado como la CDP-colina y la CDP‑etanolamina previenen la degradación de los fosfolípidos de colina y de etanolamina durante la isquemia por decapitación en ratas, y que producen una reversión parcial de la liberación de ácidos grasos libres durante la reperfusión, tras la isquemia global experimental en jerbos. La CDP-colina y la CDP‑etanolamina, administradas conjuntamente, tienen un efecto sinérgico y estimulan la resíntesis de los fosfolípidos de colina, etanolamina e inositol, disminuyendo sensiblemente los niveles de ácido araquidónico libre.
LePoncin-Lafitte et al [110], en un modelo experimental de isquemia aguda inducida en ratas, valoraron el edema cerebral, la integridad de la barrera hematoencefálica, con yodoalbúmina marcada, y el metabolismo cerebral, mediante estudios histoenzimológicos. En este modelo experimental, con la administración de citicolina, se consiguió reducir el edema cerebral vasógeno y restablecer la integridad de la barrera hematoencefálica. También comprobaron que, con citicolina, el tamaño de los infartos inducidos era menor y que disminuía la actividad de la lactato deshidrogenasa, la succinil deshidrogenasa, la monoaminooxidasa y la fosfatasa ácida, destacando su papel protector por acción directa a nivel de la membrana celular.
Mykita et al [111], en cultivos neuronales, objetivaron que la adición de citicolina tras una lesión hipocápnica produce una protección de los cultivos. La hipocapnia aumenta la incorporación de colina marcada en los fosfolípidos, mientras que este proceso queda frenado en presencia de citicolina. Estos autores concluyeron que la citicolina es capaz de proteger las neuronas en condiciones de alcalosis y que puede promover la proliferación celular.
Yasuhara et al [112,113], mediante un estudio electrofisiológico en conejos, demostraron que la citicolina disminuía paralelamente el umbral para la reacción de despertar y el umbral para la descarga muscular, concluyendo que es un fármaco útil para el tratamiento de las lesiones cerebrales, por sus efectos sobre la conciencia y sobre la actividad motora del sistema piramidal y sus vía aferentes.
Martí Viaño et al [114] compararon los efectos de la piriglutina, la piracetam, la centrofenoxina y la citicolina en un estudio sobre el antagonismo del coma barbitúrico en ratones. No observaron diferencias respecto al grupo control en los animales tratados con piriglutina, piracetam o centrofenoxina, mientras que, con citicolina, tanto la duración como la profundidad del coma eran menores, así como la depresión respiratoria, en comparación con los demás grupos, comprobando que los efectos alertizantes de la citicolina se deben al aumento del flujo sanguíneo cerebral, a la mejoría de la captación cerebral de O2 y del aprovechamiento del metabolismo energético, y a la facilitación de la respiración mitocondrial.
Ogashiwa et al [115], en un modelo experimental de traumatismo craneal en monos, establecieron una relación dosis-efecto significativa entre la dosis de citicolina y la duración del coma, y esta relación empieza a ser significativa con dosis de 60 mg/kg (p < 0,05).
Watanabe et al [116], estudiando los efectos de varios activadores del metabolismo cerebral, encontraron que la citicolina aumentaba la incorporación y el metabolismo de la glucosa y disminuía el acúmulo de lactato en el cerebro, además de incrementar levemente el flujo sanguíneo cerebral.
Alberghina y Giuffrida [17], en un estudio sobre la respuesta del tejido nervioso ante una lesión contusiva, demostraron que había un aumento moderado de la colina fosfotransferasa, que se acompañaba de un incremento mayor de la fosfolipasa A2 y de varias hidrolasas lisosómicas. Por otra parte, comprobaron que, durante la regeneración neuronal, hay un incremento del número y el tamaño de los lisosomas. Arrigoni et al [117] han demostrado cómo la citicolina es capaz de inhibir completamente la activación de la fosfolipasa A2, sin alterar la actividad de la colina fosfotransferasa. Por otro lado, Freysz et al [118] han comprobado cómo, además de disminuir la actividad de la fosfolipasa A1 y A2, la citicolina disminuye la liberación de ácidos grasos libres en condiciones de hipoxia, sumándose así un efecto protector a su capacidad activadora de la reconstrucción fosfolipídica. Massarelli et al [119] también han demostrado la acción de la citicolina sobre la fosfolipasa A1, coincidiendo con los demás autores en sus conclusiones. Kitazaki et al [120] también han demostrado el efecto inhibidor de la citicolina sobre la fosfolipasa A2 asociada a la membrana en corteza cerebral de rata. Por estas características, se ha considerado a la citicolina como un inhibidor inespecífico de la fosfolipasa A2 a nivel intracelular [121].
Algate et al [122] estudiaron los efectos de la citicolina en un modelo experimental de compresión epidural en gatos anestesiados. Observaron que los animales tratados con citicolina presentaban una resistencia mayor a los efectos de la compresión mecánica del cerebro que los animales del grupo control, apareciendo las alteraciones electroencefalográficas a niveles mayores de compresión. También observaron que, en los animales tratados, las alteraciones respiratorias y cardiovasculares eran de menor intensidad, concluyendo que la citicolina proporciona una protección significativa frente a la letalidad de la compresión epidural. Estos resultados concordaban con los obtenidos por Hayaishi [123] y Kondo [124], quienes demostraron la mejoría del trazado del electroencefalograma tras la administración de citicolina a gatos sometidos a compresión cerebral experimental, así como de la calidad de supervivencia.
Tsuchida et al [125] administraron 3H-citicolina intraperitonealmente a ratas a sometidas una lesión criógena cerebral, mediante aplicación de hielo seco en el cuero cabelludo, y confirmaron la presencia del fármaco marcado en el parénquima cerebral, especialmente en la sustancia blanca y, sobre todo, en las zonas lesionadas.
Boismare [18,126] realizó un modelo experimental de traumatismo craneocervical sin golpe directo (‘latigazo’), a fin de valorar los efectos que se producían sobre las tasas de catecolaminas centrales, y encontró que, tras el traumatismo, se producía un aumento de la tasa cerebral de dopamina y un descenso de la tasa de noradrenalina. Este tipo de lesión provoca una desregulación postural de la irrigación cerebral y trastornos del comportamiento y del aprendizaje, que están en relación con una aceleración en la degradación de la noradrenalina cerebral. En los animales tratados con citicolina, el traumatismo no modificaba las tasas de estas aminas. El autor destacó el papel protector de citicolina, gracias a este efecto estabilizador de las tasas de catecolaminas cerebrales.
Clendenon et al [127] han demostrado que el descenso de la actividad ATPasa dependiente del Mg++ de la membrana mitocondrial y sinaptosómica, que se produce en la lesión traumática, se previene con la administración de citicolina.
Cohadon et al [20,21,128], en una serie de estudios sobre un modelo de edema cerebral criógeno en conejos, comprobaron que, con un tratamiento de 20 mg/kg/día de citicolina, se conseguía:
- Ralentizar la caída de la actividad enzimática de la ATPasa mitocondrial.
- Restaurar la actividad de la Na+/K+ ATPasa.
- Restaurar la actividad de la ATPasa sensible a la oligomicina.
- Acelerar la reabsorción del edema cerebral, consiguiendo alcanzar valores normales al cuarto día, mientras que, en caso de reabsorción espontánea, estos niveles no se alcanzaban hasta el décimo día.
Estos autores radicaron la actividad beneficiosa de la citicolina en el edema cerebral en dos niveles: restaurando la inserción de las enzimas de membrana y facilitando su actividad; y actuando sobre el edema, al reducir la imbibición acuosa del parénquima cerebral.
Lafuente y Cervós-Navarro [129,130] han realizado un estudio por microgravimetría en el edema cerebral experimental inducido por radiaciones ultravioletas en gatos, a fin de valorar el efecto de la citicolina en esta situación. Los resultados indicaron una acción de la citicolina en la disminución de la cantidad del edema, facilitando la reabsorción del líquido y acelerando su drenaje hacia los ventrículos, es decir, aumentando la distensibilidad cerebral. Los autores concluyeron en que las CDP-aminas son útiles para controlar las lesiones hísticas relacionadas con el aumento de ácidos grasos libres y para restaurar el metabolismo energético celular, al poner de nuevo en marcha la bomba Na+/K+.
Majem et al [131] valoraron los cambios electroencefalográficos que aparecen en la rata al inducir un edema criógeno y cómo estas alteraciones del electroencefalograma eran modificadas con la administración de citicolina. En los animales tratados observaron un aumento significativo de la banda de frecuencias theta durante el estado de vigilia, con disminución de las bandas delta y alfa lenta, y una menor dispersión interindividual del conjunto de las bandas de frecuencia, que se traducía en una mayor estabilidad electrógena cerebral, concluyendo que la citicolina protege de los efectos del edema cerebral criógeno.
Roda [132], en un modelo experimental de edema cerebral criógeno, midió la extravasación de azul de Evans a través de la barrera hematoencefálica y la captación de fluoresceína por los astrocitos y las neuronas, y encontró que con la administración de citicolina se reducían significativamente ambos procesos, en comparación con los animales testigo, lo que permitía afirmar que la citicolina tiene un efecto directo sobre el transporte transmembrana de sodio, potasio, agua y proteínas, tanto a nivel de las células endoteliales de la barrera hematoencefálica como a nivel de los astrocitos y las neuronas. Aunque el mecanismo preciso de esta acción no sea del todo conocido, parece ser que su efecto ocurre a dos niveles: sobre la interfase que separa los capilares de la neuroglía; y sobre las membranas celulares. La citicolina reduce la permeabilidad microvascular durante la endotoxemia experimental [133] y en el edema por quemaduras en rata [134]. Farshad et al [135] proponen la citicolina como un potencial agente protector en un modelo de encefalopatía hepática, una causa conocida de edema cerebral. Descubrieron que la suplementación con citicolina mejoraba la actividad locomotora del animal y los marcadores de estrés oxidativo en el tejido cerebral, y concluyeron que los efectos de la citicolina en los marcadores de estrés oxidativo podrían desempeñar un papel fundamental en sus propiedades neuroprotectoras.
Dixon et al [136] analizaron los efectos de la administración exógena de citicolina sobre los déficits motores, la capacidad de memoria espacial y los niveles de acetilcolina en el hipocampo dorsal y el neocórtex en un modelo de lesión cerebral traumática en rata, que se indujo mediante un impacto lateral controlado. La citicolina se administró por vía intraperitoneal, en dosis de 100 mg/kg, durante 18 días a partir del primer día tras la inducción de la lesión traumática. Otro grupo de animales recibió tratamiento con solución salina. La evaluación motora se realizó mediante un test de equilibrio, para el que se había entrenado previamente a los animales, y la evaluación cognitiva se realizó con una variante del test del laberinto de Morris, que es sensible a la función colinérgica. También se utilizaron métodos de microdiálisis para analizar los efectos sobre la liberación de acetilcolina. En el estudio de la función motora, en el día 1 tras la lesión, los animales tratados con citicolina presentaban un período de equilibrio significativamente superior al de los animales que recibieron solución salina (39,66 ± 3,2 segundos frente a 30,26 ± 2,9 segundos; p < 0,01). Asimismo, los animales tratados con citicolina presentaron significativamente menores déficits cognitivos que los animales tratados con solución salina. En los estudios de microdiálisis, tras una administración única de citicolina por vía intraperitoneal, se observó un incremento rápido de la producción de acetilcolina respecto al valor basal, que se mantuvo hasta tres horas, tanto en el hipocampo dorsal (p < 0,014) como en el neocórtex (p < 0,036), mientras que no se objetivaron cambios en los animales que recibieron solución salina. Los autores concluyen que los déficits postraumáticos en la función de la memoria espacial se deben, al menos parcialmente, a alteraciones deficitarias de la transmisión colinérgica, que se ven atenuadas con la administración de citicolina.
Plataras et al [137] analizaron los efectos de diferentes concentraciones de citicolina (0,1-1 mM) sobre la actividad de la acetilcolinesterasa, la Na+/K+-ATPasa y la Mg++-ATPasa en homogeneizados de cerebro total de rata y en extractos de enzimas puras no ligados a membrana. Tras 1-3 horas de preincubación con citicolina, se observa una estimulación máxima del 20-25% (p < 0,001) para la acetilcolinesterasa y del 50-55% (p < 0,001) para la Na+/K+-ATPasa, sin efectos significativos sobre la Mg++-ATPasa. Los autores concluyen que la citicolina puede estimular la acetilcolinesterasa y la Na+/K+-ATPasa cerebrales independientemente de la acetilcolina y la noradrenalina, lo que podría explicar parcialmente los efectos clínicos del fármaco.
Baskaya et al [138] examinaron los efectos de la citicolina sobre el edema cerebral y la rotura de la barrera hematoencefálica en un modelo de lesión cerebral traumática en ratas. Los animales recibieron citicolina (50, 100, 400 mg/kg) o solución salina por vía intraperitoneal dos veces tras la inducción de la lesión cerebral traumática. La producción de la lesión traumática produjo un incremento del porcentaje del contenido acuoso y de la extravasación de azul de Evans (marcador de rotura de la barrera hematoencefálica) a nivel de la corteza lesionada y en el hipocampo ipsilateral. La dosis de 50 mg/kg de citicolina no fue eficaz, mientras que con 100 mg/kg se observó una reducción de la extravasación de azul de Evans en ambas regiones, aunque sólo redujo el edema cerebral en la corteza lesionada. Con la dosis de 400 mg/kg de citicolina se consiguió reducir de forma significativa el edema cerebral y la rotura de la barrera hematoencefálica en ambas regiones. Los autores concluyen que estos resultados sugieren que la citicolina es un agente neuroprotector eficaz sobre las lesiones secundarias que aparecen asociadas a la lesión cerebral traumática.
En un estudio más reciente, Dempsey y Rao [139], utilizando un modelo experimental de impacto cortical controlado en ratas, han demostrado que la administración intraperitoneal de 200-400 mg/kg de citicolina tras la inducción de la lesión cerebral traumática previene la pérdida neuronal en hipocampo, que se asocia a la lesión cerebral traumática, disminuye el volumen de la contusión cortical y mejora la recuperación neurológica.
Se ha demostrado que existe un efecto sinérgico en la asociación de propofol con citicolina en un modelo experimental en ratas de lesión cerebral traumática [140], reduciendo la peroxidación lipídica asociada a estas lesiones.
Jacotte-Simancas et al [141] examinaron los efectos de la citicolina y del ejercicio físico voluntario en una rueda giratoria (tres semanas), solos o en combinación, sobre los déficits de memoria de reconocimiento de objetos a corto (tres horas) y largo plazo (24 horas), y sobre la neurogenia y la neuroprotección, usando un modelo de lesión cerebral traumática en roedores (lesión cortical controlada por impacto). La citicolina mejoró los déficits de memoria tanto a corto como a largo plazo, mientras que el ejercicio físico sólo mejoró estos déficits a largo plazo. Se sugirió un efecto neuroprotector de la citicolina al observar una reducción de las diferencias interhemisféricas del volumen del hipocampo. Pero, contrariamente a lo que se esperaba, no se observó un efecto sinérgico de ambos tratamientos.
Qian et al [142] han demostrado el efecto protector de la citicolina en la lesión de la sustancia blanca y gris tras traumatismo craneal cerrado, mediante la supresión del estrés oxidativo y la superactivación de la calpaína, lo que proporcionaría un soporte adicional al uso de la citicolina para el tratamiento de la lesión cerebral traumática. Gan et al [143], en un modelo de lesión cerebral traumática en pez cebra, evaluaron las acciones antiinflamatorias de la citicolina. En este modelo, los autores demuestran que la citicolina podría activar la microglía, reducir la apoptosis neuronal y promover la proliferación neuronal alrededor del sitio lesionado.
Abdolmaleki et al [144] evaluaron el efecto anticonvulsivante de la citicolina en un modelo experimental de convulsiones inducidas por pentilentetrazol. En este estudio se objetivó que la administración aguda de citicolina tiene un efecto anticonvulsivante y sedante, lo que sugiere un efecto positivo de este tratamiento en la epileptogenia postraumática. Rasoli et al [145] indicaron que la citicolina tiene efectos anticonvulsivos probablemente a través de la inhibición del óxido nítrico.
También se ha estudiado el efecto de la citicolina sobre la lesión medular traumática, y se ha demostrado que la administración intraperitoneal de 300 mg/kg de citicolina cinco minutos después de la inducción de la lesión reducía significativamente la peroxidación lipídica y mejoraba la función motora de los animales tratados [146], siendo tan eficaz como la metilprednisolona en la recuperación neuroanatómica y funcional [147]. Por otro lado, se ha demostrado que la administración de dosis repetidas de citicolina previene la lesión tisular asociada al shock medular en fase aguda [148], y que la combinación de un poscondicionamiento isquémico con citicolina proporciona protección en un modelo de lesión medular isquémica [149], mediante la inhibición de la activación de la vía de las caspasas e incrementando la producción de proteínas antiapoptósicas. En un modelo de lesión de médula espinal, Paulose et al [150] sugieren que la combinación de neurotransmisores junto con la médula ósea o la citicolina con la médula ósea pueden revertir las alteraciones del receptor muscarínico en la médula espinal de ratas con lesión de la médula espinal, lo cual es un paso prometedor hacia una mejor intervención terapéutica para la lesión de la médula espinal debido al papel positivo del sistema colinérgico en la regulación de la actividad locomotora y la plasticidad sináptica.
También se han observado efectos beneficiosos de la citicolina en modelos experimentales de lesión traumática del nervio óptico [151]. Kitamura et al [152] investigaron la eficacia de un factor neurotrófico tópico o una combinación de ellos, incluida la citicolina, para proteger las células ganglionares de la retina en el modelo de aplastamiento del nervio óptico de rata, y concluyeron que la combinación de los tres neurofilamentos, incluida la citicolina, fueron la forma más eficaz de proteger las células ganglionares de la retina después del aplastamiento del nervio óptico. Además, hay algunos datos que sugieren que la citicolina promueve la regeneración de los nervios y reduce las cicatrices postoperatorias después de la cirugía de los nervios periféricos [153]. Aslan et al [154] demostraron que la CDP-colina mejoraba la recuperación funcional y promovía la regeneración del nervio ciático lesionado tratado con cirugía tanto inmediata como tardía en ratas. El mismo equipo [155] demostró que la administración intraperitoneal de CDP-colina mejoraba la regeneración nerviosa y la recuperación funcional en un modelo de lesión de nervio ciático en rata, y también la adherencia nerviosa y su separabilidad. Kaplan et al [156] concluyen que la CDP-colina ejerce un efecto de la dependiente dosis en la regeneración axonal y en la recuperación, sin formación de cicatriz, en un modelo de incisión de nervio periférico y anastomosis primaria en rata. En este contexto, se ha promulgado que la CDP-colina modula la actividad de las metaloproteasas de matriz, promueve la expresión de inhibidores tisulares de metaloproteinasas y estimula la regeneración axonal [157]. Estos datos ayudan a explicar un mecanismo por el que la CDP-colina proporciona neuroprotección en caso de lesión del nervio periférico. Samadian et al [158] describen el papel de la citicolina en la regeneración de los nervios periféricos. Emril et al [159] demostraron que la administración in situ de 0,4 mL de 100 µmol/L CDP-colina prevenía la ocurrencia de dolor neuropático e inducía la recuperación motora cuatro semanas después de la lesión del nervio ciático. Ahlawat y Sharma [160] concluyeron que la administración simultánea de sulfato de S-metilisotiourea (un inhibidor selectivo de iNOS) y citicolina puede proporcionar terapias potenciales para el dolor neuropático diabético. Savran et al [161] demostraron que la CDP-colina podría ser efectiva en la prevención de la fibrosis epidural postoperatoria en un modelo experimental. Tras una revisión sistemática de la bibliografía sobre modelos experimentales en roedores, Wang et al [162] consideran que la CDP-colina es uno de los tratamientos adyuvantes más eficaces tras la cirugía en caso de laceración del nervio periférico.
La citicolina, debido a sus características bioquímicas, farmacológicas y farmacocinéticas, es un fármaco potencialmente útil para el tratamiento de la lesión cerebral traumática [163].
Hipoxia e isquemia cerebral
En estudios in vitro, utilizando tejidos nerviosos, se ha demostrado que la anoxia induce una disminución de la síntesis de los fosfolípidos estructurales, que es dependiente del tiempo, es decir, cuanto más dura la anoxia, más intensa es la repercusión sobre el metabolismo fosfolipídico neuronal [164]. Por otra parte, también se ha comprobado que existe una disminución de la incorporación de precursores marcados en los fosfolípidos de las fracciones subcelulares neuronales obtenidas de animales sometidos a hipoxia experimental [26]. También se sabe que, al provocar experimentalmente una isquemia cerebral, los glicerofosfolípidos de las membranas celulares son descompuestos por acción de diferentes fosfolipasas, produciéndose ácidos grasos libres y productos derivados del ácido araquidónico. Con la prolongación de la isquemia, la agresión inducida sobre las membranas se hace más intensa y éstas pierden sus funciones, acumulándose Na+ y Ca2+ en el interior de la célula, lo que conduce, indefectiblemente, a la muerte celular [7,33,37,41,121,165].
En condiciones de isquemia, con el consiguiente sufrimiento neuronal, se deteriora la síntesis endógena de CDP-colina, puesto que la célula, en estas condiciones, carece de los compuestos de fosfato de alta energía necesarios para esta vía biosintética [37,166].
Dada la importancia que tiene restaurar la actividad neuronal tras la isquemia cerebral [4], y sobre la base de los datos experimentales expuestos, diversos autores han investigado los efectos que tiene la administración de citicolina en diversos modelos experimentales de isquemia y/o hipoxia cerebral.
Boismare et al [167] demostraron que el tratamiento con 20 mg/kg por vía intraperitoneal de citicolina en ratas induce, durante la hipoxia aguda, una reducción de las respuestas vegetativas, una protección de las respuestas condicionadas de evitación y una estabilización de los niveles cerebrales de dopamina y noradrenalina. Este mismo equipo [168] encontró que, en perros sometidos a una hipoxia normobárica, se producía un incremento de la presión arterial, de la frecuencia cardíaca, del débito cardíaco y de los flujos sanguíneos regionales, sin que se produjeran cambios en la resistencia periférica total. La administración de citicolina abolía estos efectos hemodinámicos inducidos por la hipoxia aguda, sugiriéndose que esta acción se correlaciona con un efecto agonista dopaminérgico del fármaco. En gatos sometidos a breves períodos de isquemia cerebral, estos autores [169] observaron que se producía una depresión de los potenciales evocados corticales, depresión que se veía atenuada por la administración previa de citicolina por vía intracarotídea. Estos autores opinan que los efectos protectores de la citicolina son de origen metabólico más que hemodinámico, y no descartan una acción directa del fármaco sobre las estructuras dopaminérgicas centrales.
Alberghina et al [170] investigaron el efecto de la citicolina sobre la incorporación de precursores marcados en los fosfolípidos cerebrales en cobayos sometidos a hipoxia. Un grupo de animales recibió 100 mg/kg de citicolina por vía intraperitoneal y, 10 minutos después, se administraron, por vía intraventricular, los precursores marcados [2-3H]glicerol y [1-14C]palmitato. Otro grupo de animales sólo recibió los precursores, sirviendo de grupo control. Los investigadores observaron que, en comparación con el grupo control, los animales tratados con citicolina presentaban un aumento de la radioactividad específica de los lípidos totales y de los fosfolípidos en las mitocondrias purificadas obtenidas a partir de los hemisferios cerebrales, el cerebelo y el tronco cerebral. En un estudio ulterior, este mismo equipo de investigadores [171] demostró que la citicolina era capaz de revertir los efectos de la hipoxia sobre la incorporación de precursores marcados en el ARN y las proteínas, especialmente a nivel nuclear y mitocondrial.
En diversos estudios experimentales se ha demostrado que la citicolina previene la liberación de ácidos grasos durante la isquemia y la hipoxia cerebral, e incrementa la síntesis de los fosfolípidos estructurales [172-191]. Horrocks et al [172,175,177], utilizando un modelo experimental de isquemia cerebral global por decapitación, demostraron que la administración de una mezcla de citicolina y CDP‑etanolamina reduce la liberación de ácidos grasos libres e incrementa la síntesis de los glicerofosfolípidos correspondientes, lo que sugiere una participación de la colina y la etanolamina fosfotransferasas.
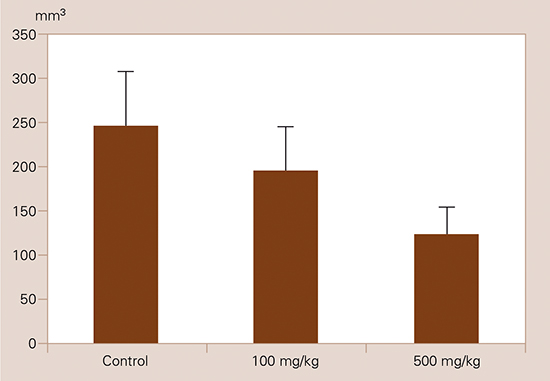
Trovarelli et al [173,174], utilizando un modelo experimental de isquemia global consistente en la ligadura carotídea bilateral en jerbos, encuentraron que la administración intraperitoneal de citicolina previene parcialmente los cambios del metabolismo lipídico inducidos por la isquemia cerebral, corrigiendo el incremento de ácidos grasos libres, las alteraciones de los lípidos neutros, como el diacilglicerol, y la disminución de la fosfatidilcolina. Suno y Nagaoka [176] estudiaron experimentalmente en la rata los efectos de la administración de citicolina sobre la liberación de ácidos grasos libres producida por una isquemia cerebral completa de cinco minutos de duración. Se comprobó que el fármaco experimentado reducía el aumento de ácidos grasos libres y que la intensidad de este efecto dependía de la dosis utilizada. El contenido de ácido araquidónico en los cerebros de los animales del grupo control sometidos a isquemia fue de 174 ± 22 mmol/g, mientras que fue de 119 ± 8 mmol/g y de 61 ± 8 mmol/g en los animales que recibieron, respectivamente, 200 y 1.000 mg/kg intraperitoneales de citicolina (Fig. 3). Los autores concluyeron que estos resultados sugieren que la administración de citicolina puede prevenir el daño cerebral isquémico [179-181]. Agut y Ortiz [178] trataron ratas macho de 190-200 g con 4 mg/kg de 14C-metil-citicolina (50 µmCi) por vía oral. A las 24 horas, se determinó el nivel de radioactividad cerebral y la presencia de fosfolípidos marcados en condiciones de normoxia, hipoxia e hipoxia tras la administración adicional de 100 mg/kg de citicolina no marcada. Los investigadores encontraron una marcada incorporación de la radioactividad en los cerebros de los animales normóxicos e hipóxicos, en su mayor parte asociada a la fosfatidilcolina. Además, la administración de citicolina no marcada redujo la elevación de lisofosfatidilcolina cerebral causada por la hipoxia. Rao et al [182] demostraron que la citicolina reducía significativamente la disfunción de la barrera hematoencefálica tras la isquemia con una reperfusión de seis horas en jerbos, y que, en el mismo modelo de isquemia cerebral transitoria, reducía de forma considerable el incremento de ácido araquidónico y la síntesis de leucotrieno C4 a las 24 horas de la inducción de la isquemia. También comprobaron cómo, en los animales tratados con citicolina, el volumen del edema cerebral era sustancialmente menor a los tres días. Tras seis días de reperfusión, se observó que la isquemia provocó un 80 ± 8% de muerte neuronal a nivel de la capa CA1 del hipocampo y que la citicolina proporcionó una neuroprotección del 65 ± 6%. En un estudio ulterior, estos autores [183] demostraron que la citicolina era capaz de restaurar significativamente los niveles de fosfatidilcolina, esfingomielina y cardiolipina tras inducir una isquemia cerebral transitoria en jerbos. Para estos autores, el mecanismo principal de acción de la citicolina sería la inhibición de la estimulación de la actividad de la fosfolipasa A2 en situaciones de isquemia, aunque también destacan sus efectos sobre la síntesis de glutatión y la actividad de la glutatión reductasa. De esta forma, el fármaco evitaría la destrucción de las membranas, disminuiría la generación de radicales libres y preservaría las defensas naturales del sistema nervioso ante la lesión oxidativa [184-188]. Más recientemente, este equipo de investigadores ha demostrado también que la citicolina potencia la síntesis de fosfatidilcolina, que está deteriorada en situaciones de isquemia, atenuando la pérdida de actividad de la CTP-fosfocolina citidiltransferasa [189,190], con lo que el fármaco presenta efectos previniendo la degradación de los fosfolípidos y sus consecuencias, y promoviendo la regeneración de la fosfatidilcolina cerebral, viéndose que estos efectos se traducen en una reducción del volumen de la lesión isquémica cerebral [191].
Figura 3. Efecto de la citicolina sobre el ácido araquidónico liberado en el cerebro isquémico de la rata. Se administró citicolina (200 y 1.000 mg por vía intraperitoneal) 10 minutos antes de la decapitación; 5 minutos después de ésta, se extrajeron los ácidos grasos libres. El ácido araquidónico se determinó mediante cromatografía gaseosa. a p < 0,05; b p < 0,001 frente a isquemia sin tratamiento.

Tornos et al [192] realizaron un estudio farmacológico sobre el efecto protector de la citicolina sobre la toxicidad en un modelo de hipoxia experimental inducida por cianuro potásico, y encontraron que el tratamiento con citicolina por vía oral durante los cuatro días previos a la inducción de la hipoxia tiene un efecto protector, que se manifiesta por un mayor tiempo de supervivencia de los animales tratados. Estos efectos beneficiosos de citicolina se pueden adscribir, además, a la activación del metabolismo energético cerebral [193] y al incremento de la actividad de la citocromo oxidasa mitocondrial [194] inducidos por este fármaco.
Narumi y Nagaoka [195] investigaron los efectos de la administración de citicolina sobre el metabolismo de las monoaminas cerebrales en dos modelos de isquemia cerebral global en ratas. En el primer modelo realizaron una isquemia cerebral, mediante la oclusión carotídea bilateral, de 30 minutos de duración en ratas espontáneamente hipertensas y observaron que se producía un importante descenso de los niveles de noradrenalina en la corteza cerebral. En este modelo, la administración de 1.000 mg/kg de citicolina disminuyó el contenido de dopamina en el estriado y el diencéfalo, normalizando la disminución de la razón metabolitos de dopamina/dopamina inducida por la isquemia. En el segundo modelo, se produjo también una oclusión carotídea bilateral, 24 horas después de haber electrocauterizado ambas arterias vertebrales, a ratas Wistar. En este modelo se observó cómo los niveles de noradrenalina, dopamina y serotonina descendían un 70-80% en la corteza cerebral. También se observaron descensos similares de noradrenalina y serotonina en el hipocampo, de dopamina en el núcleo accumbens, de dopamina y serotonina en el estriado, y de noradrenalina en el diencéfalo y el tronco cerebral. La administración de citicolina, en dosis de 500 mg/kg, incrementó de forma significativa el descenso de los niveles de dopamina en el estriado inducido por la isquemia, con lo que estos autores sugieren que la citicolina parece recuperar el recambio de dopamina en el estriado de ratas sometidas a isquemia cerebral experimental.
Nagai y Nagaoka [196] publicaron los resultados de un interesante estudio en el que se investigó el efecto de la citicolina sobre la captación de glucosa en distintas áreas cerebrales de ratas a las que se había provocado una isquemia cerebral global tras la oclusión de ambas arterias carótidas durante 30 minutos, después de haber electrocauterizado las dos arterias vertebrales. A los cuatro días de la recirculación se procedió a determinar la captación de glucosa por parte del cerebro. Se encontró que, sin la administración de citicolina, la captación cerebral global estaba reducida a un 81% del valor normal. Con la administración de citicolina, en dosis de 250 mg/kg por vía intraperitoneal dos veces al día durante tres días tras el inicio de la recirculación, la reducción postisquémica de la captación de glucosa fue significativamente menor en la corteza cerebral. Esto sugiere que la citicolina mejora el metabolismo energético cerebral en situaciones de isquemia.
Kim et al [197] investigaron el efecto de la citicolina en el contexto de la muerte neuronal inducida por hipoglucemia en un modelo de rata con hipoglucemia inducida por insulina. La hipoglucemia aguda fue inducida por inyección intraperitoneal de insulina [10 U/kg) después del ayuno nocturno, tras lo cual se mantuvo la isoelectricidad durante 30 minutos. Las inyecciones de citicolina (500 mg/kg, intraperitoneal) se iniciaron inmediatamente después de la reperfusión de glucosa. El tratamiento con citicolina causó una reducción significativa de la muerte neuronal, daño oxidativo y activación microglial en el hipocampo en comparación con los grupos de control tratados con vehículo siete días después de la hipoglucemia inducida. La administración de citicolina después de la hipoglucemia disminuyó la fuga de inmunoglobulina a través de la alteración de la barrera hematoencefálica en el hipocampo en comparación con el grupo del vehículo. La citicolina aumentó la expresión de colina acetiltransferasa para la síntesis de fosfatidilcolina después de la hipoglucemia. Estos hallazgos sugieren que la estabilización de la membrana neuronal mediante la administración de citicolina puede salvar a las neuronas del proceso de degeneración posterior a la hipoglucemia, como se ha visto en varios estudios de isquemia. Por lo tanto, estos resultados sugieren que la citicolina puede tener potencial terapéutico para reducir la muerte neuronal inducida por hipoglucemia.
Hurtado et al [198] han demostrado que la administración de citicolina incrementa de forma significativa los niveles cerebrales de trifosfato de adenosina (ATP) en animales tanto sanos como isquémicos, y que este incremento de ATP se correlaciona con un efecto positivo sobre los transportadores de glutamato, reinstaurando su actividad normal y reduciendo, consecuentemente, los niveles de glutamato, tanto en el parénquima cerebral como circulantes, lo que se correlaciona con una disminución del volumen del infarto cerebral. Posteriormente, estos mismos autores [199] han demostrado el efecto de la citicolina sobre el transportador de glutamato EAAT2, incluso cuando se administra a las cuatro horas de la oclusión de la arteria cerebral media del animal de experimentación. En otro estudio [200], han demostrado que el tratamiento crónico con citicolina, iniciado 24 horas después de la isquemia, es capaz de mejorar la plasticidad neuronal y promover la recuperación funcional (Fig. 4). Zhao et al [201] también han demostrado un efecto beneficioso de la citicolina en el aprendizaje espacial y memoria en un modelo de isquemia cerebral focal en ratas.
Figura 4. Efecto del tratamiento crónico con citicolina en la recuperación funcional determinada como integración sensoriomotora (a) y como comportamiento motor asimétrico (b). La citicolina (MCAO + CDP) y la solución salina (MCAO + SAL) se administraron 24 horas después de la oclusión permanente de la arteria cerebral media (pMCAO). Los datos se expresan como media ± error estándar de la media, n = 16: a p < 0,05, frente a MCAO + SAL.

Kakihana et al [202] investigaron la distribución de citicolina marcada y sus efectos sobre la síntesis de acetilcolina a partir de la glucosa en la corteza cerebral de ratas sometidas a 30 minutos de isquemia seguida de reperfusión. El tratamiento con citicolina mejoró el metabolismo de la glucosa y restauró significativamente la síntesis de acetilcolina a partir de glucosa. Para estos autores, los resultados obtenidos indican que citicolina mejora el metabolismo energético cerebral en situaciones de isquemia. Posteriormente, estos mismos autores [203] evaluaron los efectos de la citicolina sobre las secuelas neurológicas y el metabolismo cerebral de la glucosa en un modelo experimental de isquemia cerebral transitoria en rata, demostrando que la citicolina en altas dosis mejoraba el estado neurológico de los animales sometidos a isquemia, lo que se correlacionaba con una mejoría del metabolismo energético cerebral y con la incorporación del fármaco en la fracción de los fosfolípidos de membrana. Estos resultados coinciden con los obtenidos por Fukuda et al [204] en un estudio preliminar.
Nagaoka [205] estudió los efectos de la citicolina sobre el inicio del ictus y la mortalidad en ratas espontáneamente hipertensas sometidas a isquemia cerebral. La isquemia se indujo mediante la oclusión de ambas arterias carótidas comunes. La citicolina (200-1.000 mg/kg por vía intraperitoneal), administrada previamente a la inducción de la isquemia, indujo un retraso en el inicio del ictus y de la parada respiratoria, que era dependiente de la dosis. Estos efectos también se observaron en los animales tratados después de la inducción de la isquemia. Además, la citicolina, en dosis de 500 mg/kg por vía intraperitoneal, mejoró el estado neurológico en ratas sometidas a isquemia cerebral, durante 40 minutos, y reperfusión. Estos resultados sugieren que la citicolina ejerce un papel neuroprotector frente a la isquemia cerebral y la reperfusión.
Saligaut y Boismare [206] estudiaron los efectos de citicolina, administrada en dosis de 1000 mg/kg por vía oral, en ratas Wistar sometidas a hipoxia hipobárica aguda (15 minutos a una altitud simulada de 7.180 metros), valorando una prueba de conducta-condicionamiento, la captación de dopamina en el estriado, así como los niveles de este neurotransmisor y sus metabolitos en el estriado. En la prueba de conducta-condicionamiento se observó que la citicolina protege frente a la hipoxia hipobárica, de una forma diferente y superior a la apomorfina. En los estudios bioquímicos se mostró un efecto presináptico, probablemente debido a la activación de la tirosinhidroxilasa, induciendo cambios en la captación de dopamina, así como una mejoría en su liberación. Resultados similares sobre el efecto de citicolina sobre la actividad de la tirosinhidroxilasa han sido obtenidos por otros equipos [207].
LePoncin-Lafitte et al [110] estudiaron los efectos de la citicolina sobre diversas alteraciones histológicas cerebrales en un modelo experimental de isquemia cerebral multifocal en gatos, en el que la lesión isquémica se provoca mediante la introducción en la arteria carótida interna de microesferas calibradas, que producirán microinfartos cerebrales, caracterizados por poseer una zona central de necrosis rodeada de una zona de penumbra, junto con edema por ruptura de la barrera hematoencefálica. Con la administración de citicolina disminuía considerablemente el número de lesiones, así como la cantidad de albúmina extravasada, lo que confirma, para estos autores, que la citicolina ejerce su papel neuroprotector frente la isquemia actuando sobre las membranas celulares. Araki et al [208] también encuentran un cierto efecto neuroprotector de citicolina en la isquemia cerebral completa inducida por decapitación e intoxicación con cianuro potásico en ratón.
Aronowski et al [209] evaluaron los efectos de la administración crónica de citicolina (500 mg/kg) sobre la recuperación en ratas espontáneamente hipertensas sometidas a oclusión de la arteria cerebral media durante 30-120 minutos. La administración del fármaco o de la solución salina se realizó por vía intraperitoneal a partir de los 15 minutos tras la inducción de la isquemia y se continuó durante 14 días. Se analizaron la lesión morfológica y los trastornos neurológicos (capacidades motoras y sensoriomotoras), midiendo el volumen de lesión morfológica máxima, la alteración neurológica máxima y la duración de la isquemia que producía la mitad de la lesión morfológica máxima o de la alteración neurológica máxima. El volumen máximo de la lesión morfológica no se vio afectado por la citicolina (101,6 ± 11,4 mm3 para citicolina, 103,3 ± 13,6 mm3 para solución salina); sin embargo, la citicolina sí que aumentó significativamente la duración de la isquemia necesaria para producir la mitad de la lesión morfológica, que pasó de 38,3 ± 5,9 a 60,5 ± 4,3 minutos (p < 0,05). Del mismo modo, la citicolina no modificó el valor de la alteración neurológica máxima (8,5 ± 0,7 para la citicolina, 10,1 ± 4 para control), pero sí que aumentó significativamente la duración de la isquemia necesaria para producir la mitad de la alteración neurológica máxima, que pasó de 41,9 ± 4,6 a 72,9 ± 24,5 minutos (p < 0,05). Según estos autores, la citicolina muestra una mayor eficacia en los animales que sufren una lesión submáxima, que en este modelo se produce con 30-75 minutos de isquemia.
Schäbitz et al [210] evaluaron los efectos de un tratamiento prolongado con citicolina en un modelo de isquemia focal transitoria (dos horas) en ratas. Se asignaron aleatoriamente 10 animales a cada uno de los grupos: placebo (solución salina de 0,3 mL/día/7 días), baja dosis (citicolina 100 mg/kg/día/7 días por vía intraperitoneal) y dosis alta (500 mg/kg/día/7 días por vía intraperitoneal). El tratamiento se inició en el momento de la reperfusión, una vez finalizado el período de isquemia de dos horas. Se realizaron valoraciones neurológicas diarias (escala de Zea Longa modificada) y los animales supervivientes se sacrificaron el día 7, procediendo al cálculo del volumen del edema cerebral y del volumen del infarto. No se observaron diferencias en cuanto a la valoración neurológica de los animales al final del estudio, si bien se notó una tendencia más favorable en el grupo de dosis alta de citicolina. El volumen medio del infarto (Fig. 5) fue de 243,5 ± 88,6 mm3 en el grupo placebo, de 200,2 ± 19.,9 mm3 en el grupo de dosis baja y de 125,5 ± 45,2 mm3 en el grupo de dosis alta, diferencias estadísticamente significativas (p < 0,01). En cuanto al volumen del edema cerebral, también se observó una disminución dependiente de la dosis de éste, si bien no se alcanzó la significación estadística.
le="text-align:center">Figura 5. Efecto de la citicolina en dosis baja (100 mg/kg) y alta (500 mg/kg) sobre el volumen del infarto. Los valores representan la media ± desviación estándar. El volumen del infarto fue significativamente menor (p < 0,01) en el grupo de dosis alta de citicolina en comparación con el grupo control.
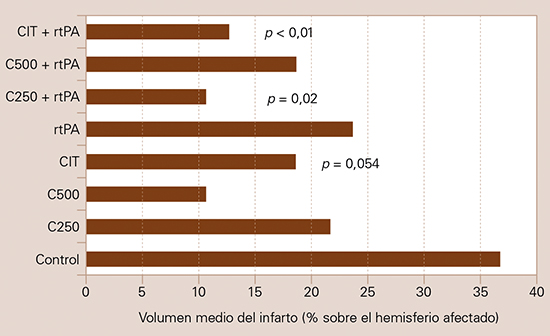
En una serie de trabajos realizados, se ha demostrado que la citicolina presenta un efecto sinérgico con otros fármacos en el tratamiento de la isquemia cerebral, como trombolíticos [211-215] y neuroprotectores [216-224]. Andersen et al [211] realizaron un estudio experimental, en un modelo de embolia carotídea en ratas, para evaluar el efecto de diferentes dosis de citicolina, administrada sola o combinada con el activador tisular del plasminógeno recombinante (rTPA), sobre el tamaño del infarto. Se distribuyeron aleatoriamente 90 ratas Sprague-Dawley sometidas a embolia en territorio carotídeo en seis grupos: a) animales tratados con solución salina; b) citicolina 250 mg/kg; c) citicolina 500 mg/kg; d) rTPA 5 mg/kg; e) rTPA 5 mg/kg + citicolina 250 mg/kg; y f) rTPA 5 mg/kg + citicolina 500 mg/kg. El tratamiento con rTPA se realizó con una posología inferior a la óptima (5 mg/kg perfundidos en 45 minutos, iniciando el tratamiento a los 45 minutos de la embolización). La citicolina se administró diariamente por vía intraperitoneal durante cuatro días. A los cuatro días se fijaron los cerebros de los animales supervivientes y se determinó microscópicamente el volumen de los infartos, calculándose como el porcentaje del volumen total del hemisferio afectado. Los valores medios del volumen del infarto señalaron que la citicolina en dosis altas y la combinación de citicolina con rTPA reducían el tamaño de la lesión isquémica (Fig. 6). En el grupo control, el volumen medio del infarto fue del 41,2% (5,9-87%). En los grupos tratados con citicolina sola, los valores fueron del 30,4% (1-70%, n.s.) en el grupo 2, y del 22,2% (0,7-76,6%; p < 0,05) en el grupo 3. Con rTPA solo (grupo 4), el volumen medio fue del 24,5% (1,4-71,1%, n.s.), mientras que, con el tratamiento combinado, el volumen medio fue del 13,5% (0,2-47,8%; p = 0,002) en el grupo 5 y del 29,2% (0,11-72,1%, n.s.) en el grupo 6. En este estudio se demuestra que la citicolina en dosis altas y una combinación de citicolina en dosis más bajas con rTPA reducen significativamente el tamaño de los infartos cerebrales. Díez-Tejedor et al [212,213] han comunicado resultados similares, destacando que se mejoran los resultados de esta asociación cuando la citicolina se administra inmediatamente después de la administración del rTPA. Este mismo equipo [214], en un modelo experimental similar, ha encontrado que la CDP-colina en altas dosis reduce significativamente el volumen del infarto, la muerte celular y los niveles de interleucina 6, en comparación con el rTPA solo, y concluye que la CDP-colina en altas dosis puede suponer un tratamiento efectivo para el ictus isquémico, incluso en ausencia de trombólisis. Shuaib et al [215] investigaron los efectos neuroprotectores de la citicolina sola o en combinación con urocinasa en un modelo de isquemia cerebral focal en rata, mediante embolización en el origen de la arteria cerebral media. Ambas medicaciones se administraron a las dos horas de la inducción de la isquemia. Los animales se sacrificaron a las 72 horas. En los animales tratados con solución salina, el volumen del infarto fue del 33,1 ± 9,7%. Los animales tratados con citicolina se dividieron en dos grupos, uno de los cuales recibió una única dosis de citicolina de 300 mg/kg, y el otro, una dosis diaria de 300 mg/kg durante tres días, por vía intraperitoneal en ambos casos. Se observó una reducción significativa del volumen del infarto en ambos grupos (20,9 ± 9,7% con dosis única; p = 0,01; 18,9 ± 11,4% con dosis múltiple; p = 0,008). Los animales tratados con urocinasa sola, en dosis de 5.000 u/kg, también presentaron un menor volumen del infarto (19,5 ± 12,5%; p = 0,01). No obstante, la mayor reducción del volumen se consiguió en el grupo de animales tratados con la combinación de citicolina y urocinasa (13,6 ± 9,1%; p = 0,0002). Estos autores concluyen que la citicolina ofrece un significativo efecto neuroprotector que puede ser potenciado con la asociación con un trombolítico. También se han demostrado efectos sinérgicos de la citicolina con la MK-801 o dizocilpina [216], el factor de crecimiento de fibroblastos básico [217], la lamotrigina [218], el nimodipino [219,220], el éster metílico de la N-nitro-L-arginina [221], la homotaurina [222], el ácido docosahexaenoico [223] y el acelnidipino [224], pero no con piracetam [225] en modelos experimentales de isquemia cerebral. Se ha demostrado que la asociación de citicolina con hipotermia es más eficaz que su aplicación individual en la mejoría de la lesión cerebral tras una isquemia focal transitoria [226]. También se ha demostrado que el precondicionamiento con CDP-colina atenúa el estrés oxidativo inductor de la muerte de miocitos cardíacos en un modelo de hipoxia/reperfusión [227]. Zazueta et al [228] demuestran que la citicolina protege al hígado del daño por isquemia/reperfusión, preservando la función mitocondrial y reduciendo el estrés oxidativo. También se conoce que la administración de citicolina y de células madre mesenquimales tiene la misma eficacia en cuanto a la recuperación neurológica, la disminución de la muerte neuronal y el incremento de mecanismos reparadores en un modelo de infarto cerebral en ratas, pero su combinación no incrementa el beneficio [229], si bien la administración de citicolina induce la expresión de marcadores de plasticidad neuronal [230]. Diederich et al [231] diseñaron un estudio para valorar si citicolina incrementa la neurorregeneración tras un infarto experimental. Los animales se sometieron a un infarto fotoembólico y fueron tratados con inyecciones diarias de CDP-colina (100 mg/kg) o vehículo durante 10 días consecutivos, empezando el tratamiento a las 24 horas de la inducción de la isquemia. Se realizaron evaluaciones sensoriomotoras, tras un entrenamiento adecuado, los días 1, 10, 21 y 28 tras la isquemia. Entonces se estudiaron los cerebros para valorar el volumen del infarto, la formación de escaras gliales, la neurogenia y la densidad de receptores para neurotransmisores, tanto excitatorios como inhibitorios. Los animales tratados con CDP-colina tuvieron una recuperación neurológica significativamente mejor los días 10, 21 y 28 tras la isquemia, lo que no se puede atribuir a diferencias en el volumen del infarto o en la formación de escaras gliales. No obstante, la CDP-colina incrementó significativamente la neurogenia a nivel del giro dentado, la zona subventricular y la zona periinfarto. Además, se encontró que la mejoría funcional se asociaba con una mayor expresión de receptores excitatorios en la corteza perilesional. Estos resultados demostrarían que la CDP-colina tiene un sustancial potencial neurorregenerativo. Además, la citicolina potencia mecanismos de angiogenia [232] y la diferenciación glial [233], ambos mecanismos involucrados en procesos de neuroplasticidad.
Figura 6. Efecto de la asociación de citicolina (CIT) y el activador tisular del plasminógeno recombinante (rTPA) sobre el volumen del infarto en un modelo de ictus embólico en ratas. C250: citicolina, 250 mg/kg; C500: citicolina, 500 mg/kg; rtPA: rtPA, 5 mg/kg.
Fresta et al han realizado una serie de experimentos en modelos de isquemia cerebral transitoria en ratas utilizando citicolina liposomada, en los que han demostrado un significativo incremento de la supervivencia de los animales tratados con esta formulación de citicolina [234-236] y, más recientemente, que esta misma formulación del fármaco reduce de forma significativa el fenómeno de maduración, es decir, la lesión neurodegenerativa cerebral retardada, que ocurre tras un evento isquémico, lo que conlleva una mejoría significativa del funcionalismo cerebral [237]. Estos resultados concuerdan con los expuestos anteriormente [192], demostrando que la administración de citicolina liposomada es más efectiva que la citicolina no liposomada [238-240]. Otras formas de incrementar la eficacia de la citicolina serían la administración estereotáxica [241], los nanoportadores [242] o la simple difusión del preparado por vía intersticial [243].
En los últimos años también se ha demostrado que la citicolina posee un efecto neuroprotector frente a la lesión neurotóxica inducida por ácido caínico en células retinianas [244-247] y en modelos in vitro de neurodegeneración retiniana [248]. Komnatska et al [249] demuestran que la citicolina restablece la microcirculación en los vasos del cuerpo ciliar en conejos, medida con flujometría láser Doppler. Bogdánov et al [250] sugieren que la administración tópica de citicolina en formulación liposómica podría considerarse como una nueva estrategia para el tratamiento de las primeras etapas de la retinopatía diabética.
Hamdorf y Cervós-Navarro [251] mantuvieron 48 ratas durante 103 días expuestas a una decreciente cantidad de oxígeno, es decir, se expusieron a una hipoxia crónica. La citicolina mostró un efecto protector al incrementar la vigilancia en situaciones de hipoxia moderada (15% de O2). En un posterior estudio, estos mismos autores [252] analizaron los efectos de la citicolina en ratas Wistar sometidas a hipoxia durante cinco meses. Las alteraciones del comportamiento inducidas por la hipoxia se vieron mitigadas en el grupo de animales tratados con citicolina. Interesante fue el hallazgo de que la administración terapéutica de citicolina fue más efectiva que la administración profiláctica. Además, en condiciones de hipoxia extrema, la citicolina demostró un efecto protector, al alargar la supervivencia. Lee et al [253] han demostrado que la citicolina previene el deterioro cognitivo en un modelo de hipoperfusión cerebral crónica en ratas.
Otros mecanismos propuestos para explicar los efectos neuroprotectores de la citicolina son la restauración de la función de la barrera endotelial [254], la inhibición de la transición de permeabilidad mitocondrial [255,256] y el mantenimiento de la integridad y la estabilidad de la membrana neuronal durante los fenómenos de despolarización cortical propagada [257]. Otro mecanismo que se ha investigado ha sido la participación de la sirtuina 1 en las acciones neuroprotectoras de CDP-colina [258]. El tratamiento con CDP-colina incrementa los niveles de sirtuina 1 en el cerebro, concomitantemente con la neuroprotección. El tratamiento con sirtinol bloquea la reducción del volumen del infarto causada por la CDP-colina, mientras que el resveratrol muestral un potente efecto sinérgico con la CDP-colina. Estos resultados demuestran un robusto efecto de la CDP-colina como activador de la sirtuina 1, sobrerregulando su expresión.
Por otro lado, Masi et al [259] han demostrado que la citicolina posee un cierto efecto antiagregante plaquetario, que puede suponer un beneficio adicional en el tratamiento de la patología vascular cerebral. Pinardi et al [260] investigaron, en ratas Sprague-Dawley, los efectos de la infusión de la citicolina sobre la relajación inducida por la acetilcolina exógena en los lechos vasculares aislados carotídeo externo, que carece de inervación colinérgica, e interno, que, por el contrario, posee abundante inervación colinérgica. Los cambios en la presión de perfusión se midieron durante una curva de dosis-respuesta a la acetilcolina y tras la perfusión con 1 mg/minuto/30 minutos de citicolina. Observaron que la acetilcolina producía relajación en ambos lechos vasculares, lo que indicaría la presencia de receptores muscarínicos. En el lecho vascular carotídeo interno, la infusión de citicolina durante 30 minutos desplazó significativamente hacia la izquierda la curva dosis-respuesta a la acetilcolina, potenciando la relajación, sin que, en cambio, se observara este fenómeno en el lecho carotídeo externo. El efecto de la citicolina se vio enmascarado cuando se infundió junto con hemicolinio. Según estos autores, los resultados sugieren que la citicolina actuaría incrementando los niveles de colina en las terminales colinérgicas, aumentando la síntesis y/o la liberación de acetilcolina.
Clark et al [261] estudiaron si la citicolina era capaz de reducir la lesión isquémica y mejorar el resultado neurológico funcional en un modelo de hemorragia intracerebral en ratón. Cogieron 68 ratones albinos suizos y les produjeron una hemorragia por inyección de colagenasa en el núcleo caudado. Los animales recibieron aleatoriamente solución salina o 500 mg/kg de citicolina por vía intraperitoneal antes de la administración de colagenasa y a las 24 y 48 horas. Los ratones se valoraron mediante una escala neurológica de 28 puntos y fueron sacrificados a las 54 horas, para determinar el volumen del hematoma, la lesión total y la lesión isquémica circundante. En cuanto a la evolución neurológica, los animales tratados con citicolina obtuvieron una mejor puntuación que los animales tratados con placebo (10,4 ± 2 frente a 12,1 ± 2,4; p < 0,01). No se observaron diferencias en los volúmenes de los hematomas, pero, en los animales tratados con citicolina, se observó una significativa reducción del volumen de la lesión isquémica circundante, que para la citicolina fue de 13,8 ± 5,8 mm3 (10,8 ± 4,3% del hemisferio) y para el placebo de 17 ± 7,1 mm3 (13,3 ± 5,1%), con una p < 0,05. Según los autores, estos resultados apoyan un papel potencial de la citicolina para el tratamiento de la hemorragia intracerebral.
Se ha comprobado que los mecanismos de apoptosis desempeñan un papel primordial en la fisiopatología de la lesión isquémica cerebral, tanto a nivel experimental [262-266], como en el ser humano [267,268]. En este sentido, hemos investigado [269] si la citicolina podría influir en los mecanismos apoptósicos tras la isquemia cerebral focal. Se realizó un modelo de oclusión distal permanente de la arteria cerebral media en ratas Sprague-Dawley. Los animales se aleatorizaron en cuatro grupos: B + A, citicolina 500 mg/kg por vía intraperitoneal 24 horas y una hora antes de la oclusión y 23 horas después de la misma; A, citicolina 500 mg/kg por vía intraperitoneal en los 30 minutos siguientes a la oclusión y a las 23 horas de la misma; C, solución salina intraperitoneal; D, Sham-operated. Los animales se sacrificaron a las 12 (siete animales por grupo) y a las 24 horas (siete animales por grupo) tras la oclusión. Se realizó inmunohistoquímica para las procaspasas 1, 2, 3, 6 y 8, utilizando anticuerpos policlonales de cabra, y, mediante electroforesis en gel e inmunotransferencia de Western con anticuerpos para la poli-ADP-ribosa polimerasa (PARP), se determinaron sustratos específicos de acción de las caspasas. La isquemia indujo la expresión de todas las procaspasas y de PARP, tanto en la zona de infarto como en la zona de penumbra, a las 12 y a las 24 horas tras la isquemia. La citicolina redujo la expresión de todas las procaspasas a las 12 y a las 24 horas tras la isquemia, con excepción de la procaspasa 3 a las 24 horas en el grupo A y la expresión de PARP (Fig. 7), y los resultados fueron más evidentes en el grupo B + A, lo que presupone un cierto papel profiláctico de la citicolina, resultados que se han confirmado recientemente [270]. Hace poco se ha comprobado que la citicolina es capaz de inhibir ciertas señales intracelulares implicadas en procesos apoptósicos [271] y que mantiene estos efectos inhibitorios en diferentes modelos experimentales para estudiar la apoptosis [142,226,272-276].
Figura 7. Densitometría de las bandas para la poli-ADP-ribosa polimerasa (PARP) de la inmunotransferencia en los diferentes grupos de ratas en la zona de infarto y en la zona de penumbra a las 12 y 24 horas de la isquemia. a p < 0,05; b p < 0,025; c p < 0,0001.

También se ha comprobado que la citicolina atenúa el daño cerebral asociado a la asfixia perinatal [277]. Se ha demostrado que el uso de metaanálisis es una técnica eficaz para la agregación de datos de estudios experimentales de isquemia cerebral. Con el uso de esta técnica, se ha confirmado que la citicolina reduce el volumen del infarto y mejora el resultado funcional [278], apuntando a dosis de 300-500 mg/kg como óptimas para convertirlas en su uso clínico [279].
De acuerdo con Drago et al [280], la citicolina es un fármaco de elección para el tratamiento de la patología vascular cerebral, especialmente en su forma crónica, ya que su uso clínico viene justificado por las acciones farmacológicas que tiene sobre el sistema nervioso central. En resumen, la citicolina (Fig. 8):
- Interfiere positivamente con el metabolismo energético cerebral.
- Estimula la neurotransmisión central.
- Activa los mecanismos de reparación celular.
- Reduce el volumen de la lesión isquémica.
- Inhibe la apoptosis asociada a la isquemia
- Posee efectos sinérgicos con fármacos trombolíticos y neuroprotectores.
Figura 8. Cascada isquémica. Los cuadros más oscuros indican los lugares en los que se ha comprobado que la citicolina tiene algún efecto farmacológico.

Estas características le confieren un perfil farmacológico apto para el tratamiento de la isquemia cerebral [39,40,281-283], y se ha postulado incluso su uso en el tratamiento de las complicaciones isquémicas de ciertas enfermedades infecciosas, como la malaria cerebral [284,285]. Abdel-Aziz et al [286] concluyen que la citicolina evita los daños a corto y largo plazo de las alteraciones neuroendocrinas, el estrés oxidativo, la inflamación y la apoptosis inducida por la irradiación en la cabeza en un modelo de rata.
Transmisión sináptica, sistemas de señalización intracelular y niveles de neurotransmisores
Ya se ha comentado anteriormente que la citicolina ejerce alguno de sus efectos a través de su actuación sobre los niveles de determinados neurotransmisores y diversos sistemas de señalización intracelular. En este apartado se van a analizar cuáles son concretamente estos efectos sobre la neurotransmisión y los sistemas de señalización intracelular. Como se podrá comprobar más adelante, la mayor parte de los estudios se ha centrado en analizar el efecto de la citicolina sobre la transmisión dopaminérgica central y sobre la transmisión colinérgica nicotínica.
Martinet et al [287] realizaron un estudio en el que determinaron los efectos de la administración de citicolina sobre los niveles de noradrenalina, dopamina y serotonina en distintas regiones del cerebro de rata. Para ello, se determinó la conversión de la 3H-tirosina y del 3H-triptófano, administrados por vía endovenosa, en 3H-noradrenalina, 3H-dopamina y 3H-serotonina, comparando los resultados obtenidos con la administración de suero salino con los obtenidos tras la administración de citicolina en distintas dosis. El metabolismo de cada neurotransmisor se estudió en las regiones del cerebro en que presenta actividad funcional. Así, para las catecolaminas, la acción de la citicolina se estudió en el cuerpo estriado, la corteza cerebral y el mesencéfalo, mientras que, para la serotonina, se estudió además el hipotálamo. La velocidad de síntesis de la dopamina, la noradrenalina y la serotonina se expresó como un índice de conversión igual al cociente entre la cantidad de neurotransmisor marcado por gramo de cerebro (cpm/g) y la radioactividad específica de la tirosina o el triptófano (cpm/mmol) en el cerebro. Tal y como se muestra en la figura 9, la citicolina incrementó significativamente el nivel y la velocidad de síntesis de dopamina en el cuerpo estriado, y el efecto ejercido sobre los niveles de tirosina es muy similar. Los niveles de noradrenalina se incrementaron en la corteza, pero no experimentaron modificaciones respecto al control en el tronco cerebral. En cuanto a los efectos sobre la serotonina, se observó que el fármaco provocaba una disminución de los niveles y la velocidad de síntesis de este neurotransmisor en el tronco cerebral y el hipotálamo, y no se observaron alteraciones en la corteza o el estriado. Según estos autores, el incremento de la síntesis de dopamina podría atribuirse a un efecto potenciador de la citicolina sobre la actividad tirosinhidroxilasa, la cual constituye el paso limitante de la síntesis de dopamina. Esta activación de la tirosinhidroxilasa comportaría una inhibición de la recaptación de dopamina en la sinapsis, acción que se ha comprobado en estudios ex vivo [288,289]. No parece, en cambio, que el aumento observado en la síntesis de dopamina esté relacionado con el incremento del nivel de tirosina, pues ésta satura completamente a la tirosinhidroxilasa en condiciones fisiológicas. Los efectos de la citicolina sobre la síntesis de dopamina en el estriado son de especial interés si tenemos en cuenta que las alteraciones en la síntesis de este neurotransmisor por parte de las neuronas dopaminérgicas extrapiramidales se encuentran en el origen de la enfermedad de Parkinson.
Figura 9. Influencia de la citicolina (30 mg/kg por vía intravenosa) sobre la síntesis de catecolaminas en distintos tiempos después de su administración. Los gráficos representan las variaciones en los niveles de catecolaminas y en su velocidad de síntesis, en tanto por ciento respecto al control, y en diferentes localizaciones. • Cuerpo estriado; Corteza; ► Tronco cerebral-mesencéfalo; a p < 0,1; b p < 0,05; c p < 0,01.

Saligaut et al [290] obtuvieron resultados concordantes con los anteriores al estudiar la recaptación de la dopamina en sinaptosomas obtenidos a partir del cuerpo estriado de ratas tratadas previamente con citicolina. Después de un tratamiento crónico con este fármaco, se observó una disminución de la recaptación de la dopamina por parte de los sinaptosomas, y los autores relacionan este hecho con el aumento de la actividad de la tirosinhidroxilasa, que conllevaría un incremento en la síntesis de dopamina. Consideran que una modificación estructural de las membranas neuronales, fundamentalmente del nivel de fosfolípidos, podría ser uno de los factores responsables de la modificación de la recaptación sinaptosomómica del neurotransmisor inducida por citicolina. También se observó que la hipoxia hipobárica antagonizaba el efecto inhibitorio de citicolina sobre la recaptación de dopamina por los sinaptosomas. Este antagonismo puede explicarse por el hecho de que la hipoxia disminuye la actividad de la tirosinhidroxilasa, que es una enzima que requiere oxígeno, contrarrestando de este modo la activación de ésta ejercida por la citicolina, con disminución de la síntesis de dopamina y aumento consiguiente de la recaptación. Estos mismos autores estudiaron la acción de la citicolina en el síndrome colinérgico experimental, en ratón, inducido por la oxotremorina [291], demostrando que el pretratamiento con citicolina no potencia este síndrome, pero inhibe la salivación inducida por la oxotremorina. La levodopa antagoniza los síntomas cerebrales, del tipo temblor-acinesia, inducidos por la oxotremorina; sin embargo, este antagonismo desaparecía en los animales tratados crónicamente con citicolina por vía oral, lo que confirma la acción de la citicolina sobre las vías dopaminérgicas. Los efectos de la citicolina parecen estar mediados por una hipersensibilidad de algunos receptores dopaminérgicos y no por un efecto estimulador directo sobre los receptores dopaminérgicos estriados. En otra serie de experimentos, estos autores estudiaron los efectos de la citicolina sobre el metabolismo de las catecolaminas, en el estriado y el hipotálamo, en ratas sometidas a una hipoxia hipobárica aguda [292]. Los resultados demuestran que la citicolina contrarresta parcialmente los efectos de la hipoxia sobre la liberación y metabolismo de ciertos neurotransmisores. En otro estudio, Saligaut et al analizaron los efectos de la citicolina en ratas con lesión unilateral del nigroestriado inducida por la 6-hidroxidopamina [293]. En los animales lesionados, la administración de anfetamina induce un comportamiento circular ipsiversivo, mientras que, con la administración de levodopa y apomorfina, este comportamiento circular es contraversivo, el cual parece estar mediado por el desarrollo, en el lado lesionado, de una supersensibilidad de los receptores dopaminérgicos postsinápticos. El tratamiento subcrónico con citicolina no indujo efectos en el comportamiento. La citicolina no modificó el efecto estimulante de la apomorfina, pero potenció los efectos de la levodopa y la anfetamina. Estos datos muestran que los efectos de la citicolina están mediados por un mecanismo presináptico. Aunque la potenciación de la levodopa no pueda explicarse por una activación de la tirosinhidroxilasa, este efecto parece estar relacionado con una mejoría en la liberación de dopamina sintetizada a partir de la levodopa exógena. Kashkin et al [294] evalúan el efecto de la combinación de citicolina con levodopa/carbidopa en el modelo de rotenona de enfermedad de Parkinson en ratas, confirmando que la terapia combinada tuvo un efecto terapéutico más pronunciado sobre los trastornos extrapiramidales que la monoterapia.
Cansev et al [295] han demostrado que la administración periférica de citicolina incrementa las concentraciones plásmicas de adrenalina y noradrenalina. La CDP-colina modula los transportadores monoaminérgicos [296] y colinérgicos [297] en el cerebro de la rata.
Agut et al [298] estudiaron indirectamente el efecto de la citicolina sobre la síntesis de dopamina en el cuerpo estriado, a través de la determinación de los niveles locales de los metabolitos de la dopamina en animales a los que se provocaba un bloqueo de los receptores dopaminérgicos mediante la administración de haloperidol. El pretratamiento con citicolina, 100 mg/kg/día/5 días, aumentó significativamente los niveles de ácido homovanílico y de ácido 3,4-dihidroxifenilacético en el estriado de los animales tratados, en comparación con el grupo control. El incremento de los niveles de estos metabolitos fue todavía más intenso en un grupo de animales que recibió, además, apomorfina. Los resultados obtenidos en este estudio indican que la citicolina incrementa la síntesis de dopamina en el estriado de ratas en las que se ha inducido experimentalmente una activación de dicha síntesis mediante la administración de haloperidol. Este mismo equipo de investigadores, posteriormente, realizó un estudio para investigar si la citicolina por sí sola, sin la provocación de una mayor demanda de dopamina por parte de los receptores dopaminérgicos, determinaba una mayor síntesis de este neurotransmisor, reflejada en un aumento de los niveles de sus metabolitos principales, ácido homovanílico y ácido 3,4-dihidroxifenilacético, en el cuerpo estriado [299].
La acción de la citicolina sobre el sistema dopaminérgico también se ha estudiado mediante la investigación de sus acciones farmacológicas en modelos experimentales que se utilizan a tal efecto, como la hipotermia inducida por apomorfina, la discinesia tardía inducida por haloperidol o la lesión inducida por acrilamida. Agut et al [300] estudiaron el efecto de la administración de citicolina sobre la hipotermia inducida por apomorfina, que se considera como consecuencia de la acción agonista de la apomorfina sobre los receptores D2. Los animales de experimentación recibieron, además de apomorfina, haloperidol en una dosis suficiente para bloquear parcialmente la hipotermia inducida por la apomorfina, con el fin de obtener un sistema farmacológico sensible a la acción de la citicolina sobre el sistema dopaminérgico. Un lote de animales recibió una dosis de 100 mg/kg por vía oral de citicolina, administrándose a los 30 minutos 0,15 mg/kg de haloperidol por vía intraperitoneal. Treinta minutos más tarde se midió la temperatura rectal y se administró 1 mg/kg de apomorfina por vía subcutánea. La temperatura rectal se determinó nuevamente a los 30, 60 y 90 minutos. Otro grupo de animales recibió agua en lugar de citicolina, siguiendo el mismo esquema. También se analizaron los efectos de la citicolina en la administración crónica, en dosis de 100 mg/kg/día por vía oral durante cinco días, siguiendo el último día el mismo protocolo que en la administración aguda. En la tabla I se expone el descenso medio de temperatura observado en cada lote de animales y en los distintos tiempos de evaluación. La administración aguda de citicolina provoca una hipotermia, que es significativa para todos los tiempos de control. Con la administración crónica sólo se consigue un resultado significativo a los 90 minutos. Los autores concluyen que una dosis de 100 mg/kg de citicolina administrada de forma aguda por vía oral posee un efecto hipotermizante similar al descrito para diversos agonistas dopaminérgicos. Por otra parte, consideran que el hecho de que la administración crónica de citicolina sólo dé lugar a una hipotermia significativa en el último de los tiempos analizados refleja, probablemente, que, con esta forma de administración, el producto ensayado actúa de forma predominante sobre la síntesis de fosfolípidos, más que sobre la síntesis de acetilcolina. Esta segunda vía de actuación de la citicolina sería la que predominaría con la administración aguda, pues ésta comportaría un aprovechamiento relativamente rápido de la colina aportada, que se utilizaría para la síntesis de acetilcolina, con lo que se incrementaría la actividad de la tirosinhidroxilasa a través de las interneuronas colinérgicas. En cambio, la administración crónica del producto comportaría una disponibilidad progresivamente mayor de citidina y, consiguientemente, decantaría a la colina cerebral hacia la vía de síntesis de CDP-colina y fosfolípidos, lo que conllevaría indirectamente un efecto agonista dopaminérgico. Estos autores, a través de un estudio que incluye la administración crónica de haloperidol o agua a un total de 120 animales, han desarrollado un modelo experimental de discinesia tardía por haloperidol (2 mg/kg/día/7 días) en ratas [301], y encontraron que la administración de citicolina más apomorfina en ratas tratadas con haloperidol produjo una actividad motora semejante a la observada en el grupo que recibió solamente citicolina. Los datos aportados en este estudio muestran que, en un modelo de hipersensibilidad dopaminérgica inducida por haloperidol, la administración de citicolina oral induce hipermotilidad; este hecho puede inducir un fenómeno de competencia frente a otros agonistas, dando origen a la reducción parcial del efecto de la apomorfina en animales pretratados con citicolina. En el modelo de lesión inducida por acrilamida, estos mismos autores [302] demuestran que la administración de dosis bajas de citicolina, 50 mg/kg, por vía oral se muestra efectiva en la corrección del síndrome neurológico inducido por la acrilamida. Asimismo, la administración simultánea de ambas sustancias, que induce una evidente pérdida de peso en el ratón, se ha demostrado que provoca una activación del sistema dopaminérgico, como se observó en los resultados obtenidos con el test de estereotipia apomorfínica.
Tabla I. Descenso de temperatura para cada lote estudiado referido a tiempo cero, expresado como media para n = 20.
|
Lote
|
Fármacos
|
Tiempo
|
+ 30 min
|
+ 60 min
|
+ 90 min
|
A
|
Agua (10 mL/kg, VO)
Apomorfina (1 mg/kg, SC)
Haloperidol (0,5 mg/kg, IP)
|
1,19 ± 0,23
|
0,61 ± 0,17
|
0,19 ± 0,15
|
B
|
Citicolina (0,1 g/kg, VO)
Apomorfina (1 mg/kg, SC)
Haloperidol (0,5 mg/kg, IP)
|
1,39 ± 0,18 b
|
0,74 ± 0,17 a
|
0,38 ± 0,14 b
|
C
|
Agua (10 mL/kg/5 días, VO)
Apomorfina (1 mg/kg, SC)
Haloperidol (0,5 mg/kg, IP)
|
1,13 ± 0,22
|
0,63 ± 0,25
|
0,26 ± 0,12
|
D
|
Citicolina (0,1 g/kg/5 días, VO)
Apomorfina (1 mg/kg, SC)
Haloperidol (0,15 mg/kg, IP)
|
1,11 ± 0,25
|
0,70 ± 0,19
|
0,41 ± 0,12 b
|
a p < 0,05; b p < 0,01, respecto a su control. IP: intraperitoneal; SC: subcutáneo; VO: vía oral.
|
Shibuya et al [303] midieron, mediante fluorometría, los niveles estriados de dopamina tras la administración de citicolina, en una única dosis de 500 mg/kg intraperitoneal, y encontraron que se producía un significativo (
p < 0,05) incremento de dopamina en el estriado al cabo de una hora de la inyección. Por otro lado, Stanzani [304] ha demostrado que la citicolina posee un efecto neuroprotector en la sustancia negra, al observar cómo protege esta zona frente a la lesión inducida por las peroxidasas
(horse radish), consiguiendo un número superior de células supervivientes. Porceddu y Concas [305] también describen un efecto trófico y/o estimulante de la citicolina sobre las neuronas dopaminérgicas nigroestriadas en un modelo de lesión inducida por ácido caínico. Existen estudios que demuestran el efecto protector de la citicolina sobre neuronas dopaminérgicas ante lesiones inducidas por la 6-hidroxidopamina [306], 1-metil-4-fenilpiridinio [307,308] y glutamato [307]. Miwa et al [309] sugieren que la citicolina puede actuar como un inhibidor de la recaptación de la dopamina tras la administración de una dosis única y que este fármaco puede cambiar la actividad de las neuronas dopaminérgicas a través de cambios en la composición de la membrana neuronal, tras repetidas administraciones. Además, estos autores encuentran que la citicolina posee ciertos efectos muscarínicos. En este sentido, Giménez et al [310] demuestran que la administración crónica de citicolina a ratones envejecidos promueve una recuperación parcial de la función de los receptores dopaminérgicos y muscarínicos, que normalmente disminuye con el envejecimiento, y opinan que esta acción se puede explicar basándose en mecanismos que implican la fluidez de la membrana neuronal, coincidiendo con los resultados obtenidos por Petkov et al [311]. Este último equipo investigador, al comparar los efectos de citicolina con los de los noótropos adafenoxato y meclofenoxato sobre los niveles de las monoaminas biógenas cerebrales noradrenalina, dopamina y serotonina en la corteza frontal, el estriado, el hipocampo y el hipotálamo de ratas [312], encontraron que el adafenoxato incrementaba los niveles de dopamina en el estriado y los disminuía en el hipotálamo, incrementaba los niveles de dopamina en la corteza y el hipotálamo y los disminuía en el estriado, e incrementaba los niveles de serotonina en la corteza y los disminuía en el hipocampo. El meclofenoxato inducía un descenso de los niveles de noradrenalina en la corteza y el hipotálamo, aumentaba los niveles de dopamina en el hipocampo y el hipotálamo y los de serotonina en la corteza, el estriado, el hipocampo y el hipotálamo. Recientemente, se ha demostrado que la administración de citicolina también incrementa los niveles de dopamina en la retina [313]. Mao et al [314] han encontrado que una inyección intraperitoneal de citicolina puede retrasar el cambio miópico inducido por la privación en cobayas mediante un incremento de los niveles retinianos de dopamina. Por su parte, la citicolina incrementa los niveles de noradrenalina en la corteza y el hipotálamo, los de dopamina en el estriado y los de serotonina en la corteza, el estriado y el hipocampo, y presenta un perfil ligeramente diferente al de los noótropos. Referente a la acción de la citicolina sobre la noradrenalina, tenemos el estudio de López-Coviella et al [315], quienes demuestran que la administración de citicolina incrementa la excreción urinaria total de 3-metoxi-4-hidroxifenilglicol, que refleja la actividad noradrenérgica, en ratas y en humanos, lo que sugiere que la citicolina incrementa la liberación de noradrenalina. Recientemente, también se ha demostrado a nivel experimental que la citicolina es capaz de influir en la relación entre aminoácidos excitadores (glutamato) e inhibidores (ácido gamma-aminobutírico) a nivel de la corteza cerebral de la rata [316]. En una serie de experimentos se ha valorado el potencial de la citicolina para producir una activación colinérgica central, y se ha demostrado que la administración intracerebroventricular de citicolina produce un incremento de los niveles de vasopresina [317] y de otras hormonas hipofisarias [318], principalmente debido a la activación colinérgica central. El mismo efecto se ha visto tras la administración intravenosa [319]. Además, se ha demostrado que la citicolina tiene un efecto presor en casos de animales hipotensos [320] o, incluso, en casos de hipotensión por shock hemorrágico [321, 322]. Amín et al [323] estudian los efectos de la citicolina sobre la función cardiovascular en ratas albinas tratadas con 1-metil-4-fenil-1,2,3,6-tetrahidropiridina, que es una sustancia química que se transforma en la neurotoxina 1-metil-4-fenilpiridinio, que provoca el agotamiento de las catecolaminas. En este modelo, la citicolina aumentó la norepinefrina cardíaca y la tirosinhidroxilasa y mejoró los marcadores relacionados con el eliminador de especies reactivas de oxígeno, la permeabilidad mitocondrial y la homeostasis del calcio a nivel celular, homeostasis metabólica y biogenia mitocondrial. Los autores concluyen que la citicolina mejoró la disautonomía cardiovascular y eso se reflejó en la contractilidad cardíaca, la actividad eléctrica, la presión arterial y la reactividad vascular. También se ha involucrado un cierto efecto histaminérgico central [324]. Se ha enfatizado, otra vez, en el efecto activador colinérgico central que ejerce la citicolina, y este efecto se involucra en la explicación de los efectos cardiovasculares [325-328] y metabólicos [329-332]. La citicolina también modula el metabolismo cerebral a través de actividades enzimáticas ligadas con el glutamato [333]. Sbardela et al [334] demostraron que la citicolina afecta en gran medida la actividad proteolítica de la proteasoma 20S, funcionando como un modulador alostérico bimodal, probablemente uniéndose en múltiples sitios, lo que sugiere su función potencial como regulador de la proteostasis en las células nerviosas. Ilcol et al [335] han observado que el tratamiento con citicolina altera las reacciones lipídicas en el suero a la endotoxina y previene la lesión hepatorrenal durante la endotoxemia mediante un mecanismo que involucra receptores nicotínicos. Con la participación de mecanismos nicotínicos centrales, la CDP-colina atenúa la disrupción de la inhibición prepulso inducida por la escopolamina en ratas [336]. Yilmaz et al [337] muestran que la administración de citicolina restaura las hemostasis primaria, secundaria y terciaria, y que previene el desarrollo de la coagulación intravascular diseminada durante una endotoxemia experimental en el perro, apuntando hacia un posible incremento de la actividad colinérgica, tanto neuronal como no neuronal, para explicar este efecto. Kocaturk et al [338] muestran que el tratamiento con citicolina mejora las funciones de los sistemas cardiovascular y respiratorio en la endotoxemia experimental en perros y sugieren que pueden ser útiles en el tratamiento del shock por endotoxinas en el entorno clínico. Doolittle et al [339] demostraron que la citicolina corrige la disfunción mitocondrial de las células alveolares de tipo II en ratones infectados con influenza al prevenir la disminución de la fosforilación oxidativa, el potencial de la membrana mitocondrial y la síntesis de cardiolipina.
Roohi-Azizi et al [340] concluyeron que la administración de citicolina, como fármaco adyuvante, en combinación con citalopram, mejoró la eficacia de los fármacos inhibidores selectivos de la recaptación de la serotonina para el tratamiento de la depresión en un modelo de depresión en ratones. Khakpai et al [341] concluyeron que la administración de citicolina, como fármaco adyuvante, en combinación con imipramina aumentó la eficacia de los fármacos antidepresivos tricíclicos para modular las conductas de dolor y depresión en ratones.
Se han descrito efectos antinociceptivos de citicolina, que involucrarían al sistema colinérgico [342-344], los receptores opioides y el ácido gamma-aminobutírico [345,346], el sistema arginina-vasopresina [347] y la actividad de la Na
+/K
+ ATPasa [348].
Cuando se administra citicolina previamente a la inducción de la anestesia con tiopental sódico, se observa que se mejora la función cerebral, reflejada por la reducción de la duración de la falta de reflejo corneal, y que se incrementa la duración de la analgesia [349]; por otro lado, también se ha demostrado que se incrementan significativamente la frecuencia cardíaca, la frecuencia respiratoria, mejorando la saturación de oxígeno, y se reduce significativamente la temperatura rectal en los animales estudiados [350]. La citicolina tiene un efecto protector en modelos experimentales de epilepsia inducida por xilocaína [351] y pentilentetrazol [352,353], pero no cuando la epilepsia es inducida por pilocarpina [354]. Bekhet et al [355] tuvieron como objetivo formular niosomas cargados de citicolina para una administración cerebral eficiente a través de la vía intranasal para mejorar el tratamiento de la epilepsia. La protección contra las convulsiones generalizadas inducidas por el pentilentetrazol y la mortalidad se determinaron en ratas y se compararon con la solución de fármaco oral en la dosis exacta. Los resultados revelaron que una dosis baja de niosomas en gel
in situ tuvo un poderoso efecto protector al retrasar la latencia para el inicio de las convulsiones, y esto puede considerarse como un método para aumentar la eficacia de la citicolina en el tratamiento de la epilepsia.
Nashine y Kenney [356] caracterizaron los efectos citoprotectores de la citicolina purificada en células híbridas del epitelio pigmentario de la retina transmitocondrial (degeneración macular relacionada con la edad) que transportan mitocondrias enfermas de pacientes con degeneración macular relacionada con la edad clínicamente caracterizados y demostraron que la citicolina regula a la baja los genes asociados con la apoptosis y reduce la apoptosis mediada por caspasa-3/7 en este modelo, junto con una reducción del estrés oxidativo.
En referencia a los sistemas de señalización intracelular, se ha comprobado que la citicolina tiene efecto sobre los siguientes sistemas:
- Factor activador de las plaquetas [357,358].
- MAP cinasa [271].
- ERK1/2 [232,246].
- Rho/Rho-cinasa [359].
- Calpaína [142].
- Fosfolipasa-tromboxano [360].
- Fosfolipasa-prostaglandinas [361].
- Citocinas proinflamatorias [143,362-366].
En resumen, se han estudiado los efectos de la citicolina en los modelos experimentales que se utilizan para revelar las acciones farmacológicas sobre el sistema dopaminérgico. Se ha demostrado que la citicolina actúa como un agonista dopaminérgico, y es especialmente significativo su efecto sobre los niveles de dopamina y sus metabolitos en el cuerpo estriado. Los resultados obtenidos indican que, con la administración de citicolina, se incrementa la síntesis de dopamina estriada, probablemente a través de una activación de la tirosinhidroxilasa. El aumento de los niveles de dopamina estaría determinado, en parte, por una inhibición de su recaptación, posiblemente relacionada con la acción de la citicolina sobre la síntesis de fosfolípidos. Además, la citicolina también tiene ciertos efectos sobre las otras monoaminas, serotonina y noradrenalina, sobre los receptores muscarínicos y nicotínicos, y sobre el glutamato, los opioides y el ácido gamma-aminobutírico, junto con importantes efectos moduladores en diversos procesos de señalización intracelular.
Rendimientos de aprendizaje, memoria y envejecimiento cerebral
Se ha demostrado que una hipoxia hipobárica disminuye los rendimientos de aprendizaje en ratas sometidas a un condicionamiento de evitación por sonido y que es posible antagonizar este efecto mediante un pretratamiento con apomorfina o con otros agonistas dopaminérgicos. Estos efectos de la hipoxia aparecen ligados a una inhibición del metabolismo de las catecolaminas cerebrales, que sería, en último término, responsable de una hipoestimulación de los receptores dopaminérgicos postsinápticos centrales. Partiendo de estas premisas, Saligaut y Boismare [206] realizaron un estudio sobre los efectos de la administración de citicolina en los rendimientos de aprendizaje en ratas sometidas a una hipoxia hipobárica. En condiciones de hipoxia, se administró citicolina, en dosis de 300 mg/kg/día durante 12 días, a un grupo de ratas que, en los últimos cinco días de tratamiento, eran sometidas a pruebas de aprendizaje de un condicionamiento de evitación por sonido. Los efectos observados en este grupo se compararon con los observados en otro grupo que recibió 0,5 mg/kg de apomorfina 30 minutos antes de cada sesión diaria de condicionamiento y con los constatados en animales que recibieron ambos tratamientos. Un grupo de animales sirvió como testigo, recibiendo, en las mismas condiciones experimentales, una solución de ácido ascórbico. Se observó que la citicolina restaura parcialmente los rendimientos de aprendizaje. El mismo efecto, aunque en menor grado, se observa con la administración de apomorfina y con la administración conjunta de ambos fármacos. Estos resultados indican que con la administración de citicolina se contrarrestan, al igual que con los agonistas dopaminérgicos, los efectos de la hipoxia. Ya se ha comentado previamente el efecto protector de la citicolina frente al deterioro cognitivo inducido por la hipoperfusión cerebral crónica [253].
Drago et al [367] administraron intraperitonealmente 10-20 mg/kg/día de citicolina durante 20 días a ratas macho Sprague-Dawley de 24 meses de edad y pertenecientes a una cepa que presenta déficits cognitivos y motores. El fármaco también se administró a ratas con alteraciones del comportamiento inducidas farmacológicamente, mediante una única inyección de escopolamina, un antagonista colinérgico o la exposición prenatal a metilazoximetanol, o mediante inyecciones bilaterales de ácido caínico en los núcleos basales magnocelulares. En todos los casos, la citicolina mejoró los rendimientos de aprendizaje y memoria, evaluados mediante pruebas de evitación activa y pasiva. En el grupo de ratas viejas se observó, además, una mejoría en la capacidad motora y de la coordinación. Para estos autores, estos resultados indican que la citicolina afecta a los mecanismos centrales involucrados en los comportamientos cognitivos, probablemente a través de una acción colinérgica.
En un modelo de deterioro de la memoria inducido por escopolamina, Petkov et al [368] demostraron que la citicolina era capaz de prevenir la amnesia inducida por la escopolamina. Posteriormente, Mosharrof y Petkov [369] demostraron que la citicolina en dosis de 100 mg/kg prevenía completamente la amnesia inducida por la escopolamina, así como la asociación de 50 mg/kg de citicolina con 500 mg/kg de piracetam, produciendo, además, un incremento significativo de la retención, y los autores sugieren que este efecto viene mediado por las acciones del fármaco sobre la neurotransmisión. Takasaki et al [370] sugieren que la citicolina tiene un efecto mejorando el deterioro de la memoria especial inducido por la escopolamina, reduciendo la muerte neuronal y mejorando la señal colinérgica deteriorada. La citicolina actúa como un fármaco potenciador de la memoria y este efecto es particularmente pronunciado en animales con déficits de memoria [371]. Por otro lado, Álvarez et al [372] han demostrado que la citicolina antagoniza la amnesia inducida por el bromacepam en ratas. Bruhwyler et al [373], por su parte, han comprobado que la administración crónica de citicolina posee efectos facilitadores sobre los procesos de aprendizaje y memoria del perro, sin afectar a las capacidades establecidas y sin mostrar, en este modelo, efecto alguno sobre los sistemas motor, neurovegetativo y motivacional, lo que, según los autores, constituye un argumento a favor de la selectividad de la acción del fármaco en los procesos de memoria. Incluso se ha demostrado que la citicolina posee un efecto protector de los trastornos mnésicos en animales envejecidos [374] y en animales en situación de aislamiento [375] cuando se administra como un suplemento en la dieta, así como en ratas espontáneamente hipertensas [376]. Ahmed et al [377] comparan la eficacia relativa de los noótropos como el piracetam, el modafinilo y la citicolina en el aprendizaje y la memoria en ratas mediante la prueba del laberinto acuático de Morris. Para el estudio se utilizaron un total de 30 ratas Wistar. Los animales se dividieron en cinco grupos (
n = 6). Los grupos I a V recibieron goma arábiga por vía oral, escopolamina 2 mg/kg por vía intraperitoneal, piracetam (52,5 mg/kg), modafinilo (2,5 mg/kg) y citicolina (25 mg/kg), respectivamente, por vía oral durante 20 días. El aprendizaje y la memoria se evaluaron mediante la prueba del laberinto acuático de Morris. Los animales fueron entrenados en el laberinto acuático de Morris en los últimos cinco días de dosificación. Se administró escopolamina 2 mg/kg por vía intraperitoneal a los grupos de animales anteriores (excepto los grupos I y II) para la inducción de amnesia, 45 minutos antes de la prueba de comportamiento. La escopolamina indujo un marcado deterioro de la memoria evidenciado por una reducción significativa (
p < 0,01) en el número de entradas y el tiempo pasado en el cuadrante objetivo en comparación con el grupo de control. Hubo un aumento significativo (
p < 0,05) en el número de entradas y el tiempo pasado en el cuadrante objetivo del laberinto acuático de Morris en los animales que fueron tratados previamente con piracetam, modafinilo y citicolina, en comparación con el grupo tratado con escopolamina. Entre los tres noótropos, el modafinilo y la citicolina mostraron una mejora significativa de la memoria (
p < 0,05) en comparación con el piracetam. Abdel-Zaher et al [378] investigaron el posible efecto protector de la citicolina sobre los déficits cognitivos inducidos por el cloruro de aluminio en ratas y demostraron, por primera vez, que la citicolina puede proteger contra el desarrollo de estos déficits cognitivos mediante la inhibición de la elevación del nivel de glutamato inducida por el aluminio, el estrés oxidativo y la sobreproducción de óxido nítrico en el hipocampo. Hosseini-Sharifabad et al [379] demostraron que el magnesio aumenta el efecto protector de la citicolina sobre el deterioro cognitivo inducido por el cloruro de aluminio en ratones.
Cakir et al [380] investigaron los efectos de la citicolina sobre los conocidos efectos negativos de la privación del sueño con movimientos oculares rápidos sobre el aprendizaje y la memoria en ratas albinas Wistar macho adultas, y los resultados obtenidos sugieren que la citicolina reduce el deterioro inducido por la privación del sueño con movimientos oculares rápidos en la memoria, al menos en parte, contrarrestando las alteraciones en los parámetros bioquímicos y biológicos moleculares.
Safavi et al [381] compararon los efectos individuales de la benfotiamina y la citicolina y su administración conjunta sobre las alteraciones de la memoria en ratones diabéticos. La diabetes se indujo mediante una dosis única de estreptozotocina (140 mg/kg por vía intraperitoneal) y se administró benfotiamina y/o citicolina durante tres semanas. La memoria se evaluó mediante la tarea de reconocimiento de objetos (ORT) y la prueba de evitación pasiva (PAT). En esta última, la administración conjunta de benfotiamina y citicolina fue más eficaz que cualquiera de las dos solas para mejorar la memoria. En cuanto a la tarea de reconocimiento de objetos, aunque la benfotiamina añadida a la citicolina mejoró notablemente la memoria, la diferencia entre el tratamiento combinado y el monofármaco no fue considerable.
Muchos son los cambios morfológicos, neuroquímicos y fisiológicos que caracterizan el envejecimiento cerebral en los mamíferos. Existe un acuerdo general entre los investigadores sobre la existencia de alteraciones ligadas a la edad de determinados parámetros neuroquímicos, como la actividad enzimática, la unión a receptores y la neurotransmisión. Existen evidencias bioquímicas de que existe un componente de disfunción colinérgica y de alteración del metabolismo fosfolipídico cerebral en la fisiopatología del envejecimiento cerebral [1,4,5]. De Medio et al [382] investigaron los efectos de la citicolina sobre los cambios del metabolismo lipídico cerebral durante el envejecimiento. Así, midieron la síntesis lipídica
in vivo en diferentes áreas cerebrales de ratas macho de 12 meses de edad. Administraron, mediante inyección en el ventrículo cerebral lateral, una mezcla de (2-
3H)glicerol y (Me-
14C)colina, como precursores lipídicos, y midieron, al cabo de una hora de la administración del isótopo, la incorporación de estos precursores en las fracciones lipídica total, de intermediarios hidrosolubles y de fosfolípidos de colina. En otra serie de experimentos se inyectó citicolina intraventricularmente a las ratas envejecidas 10 minutos antes del sacrificio, realizándose los mismos ensayos de radioactividad descritos. La distribución de la radioactividad contenida en la citicolina en el cerebro 10 minutos después de su administración muestra un enriquecimiento, en las áreas estudiadas, de los nucleótidos y de los compuestos hidrosolubles relacionados. La incorporación de glicerol marcado, que está muy disminuida en las ratas envejecidas, se vio incrementada en todas las áreas. La incorporación de colina marcada también disminuye con el envejecimiento y la citicolina consigue incrementar esta incorporación en la corteza. Como consecuencia, la razón
3H/
14C se vio incrementada en los lípidos totales y en la fosfatidilcolina y los plasmalógenos de colina tras el tratamiento con citicolina. Siguiendo esta línea de investigación, López-Coviella et al [383] estudiaron los efectos de la citicolina administrada por vía oral sobre el contenido cerebral de fosfolípidos en ratón. Estos autores suplementaron la dieta de los animales con 500 mg/kg/día de citicolina durante 27 meses en ratones de 3 meses y, durante 90, 42 y 3 días, en ratones de 12 meses, midiendo entonces los niveles de fosfatidilcolina, fosfatidiletanolamina, fosfatidilserina y el contenido de fosfatidilinositol más ácido fosfatídico en la corteza cerebral. Tras 27 meses de tratamiento, los niveles de fosfatidilcolina y de fosfatidiletanolamina se incrementaron significativamente un 19 y un 20% respectivamente, mientras que el nivel de fosfatidilserina se incrementó un 18%, aunque no se alcanzó significación estadística (Fig. 10). Elevaciones similares se observaron cuando los animales de 12 meses fueron tratados durante 3 meses, pero no con períodos de tratamiento más cortos. Estos resultados sugieren que la administración crónica de citicolina puede tener importantes efectos sobre la composición fosfolipídica cerebral, que pueden ser responsables, en parte, de la eficacia terapéutica descrita de este fármaco. En este sentido tenemos el trabajo de Wang y Lee [384], quienes han obtenido resultados similares. Plataras et al [385] han demostrado que la citicolina es capaz de restaurar la actividad de la acetilcolinesterasa hipocámpica y la actividad de las bombas de Na
+/K
+, involucrando estos mecanismos en la mejoría en los rendimientos de memoria que ejerce la citicolina. Zhang et al [386] sugieren que la citicolina podría mejorar la capacidad de memoria y ejercer un efecto protector ante la enfermedad de Alzheimer por medio del incremento de la expresión y la actividad de la Na
+/K
+-ATPasa. Giménez et al [387] han demostrado que la citicolina, administrada durante dos meses a ratas envejecidas, produce una significativa activación de la citidintrifosfato:fosfocolina citidiltransferasa, lo que para los autores explicaría los efectos reparadores del fármaco sobre las membranas lesionadas de los animales envejecidos. Este mismo equipo investigador ha profundizado en los efectos de la citicolina sobre la actividad de este sistema enzimático y ha demostrado que, además del efecto sobre el metabolismo fosfolipídico, también ejerce un efecto regulador sobre los niveles del factor activador plaquetario a nivel cerebral [357,358]. Todos estos efectos se producen sin que se alteren los niveles plásmicos de homocisteína, conocido factor de riesgo [388]. Pero, además, la citicolina también ofrece unas acciones beneficiosas sobre el metabolismo cerebral de ácidos nucleicos y proteínas [385,389-391], sobre receptores dopaminérgicos, muscarínicos y nicotínicos [324], y sobre las alteraciones neuroendocrinas y neurosecretoras [392-394] en modelos experimentales de envejecimiento, así como un efecto neuroprotector frente a agresiones neurotóxicas [394-402], un efecto inmunomodulador [403] y un efecto antiapoptósico [404,405] en diversos modelos de neurodegeneración y de demencia cerebrovascular. Sahraiian y Khazali [406] demostraron que la citicolina, como la grelina, mejora el aprendizaje de evitación pasiva al alterar la expresión del receptor de N-metil-D-aspartato (NMDAR1) y del receptor de serotonina 1A (HTR1a) en el hipocampo de ratas macho adultas.
Figura 10. Efecto de la administración crónica de citicolina sobre los niveles cerebrales de fosfolípidos en ratones de 30 meses de edad, que recibieron un suplemento dietético con citicolina (500 mg/kg/día) o placebo durante 27 meses. a p < 0,05; b p < 0,01.

Por estas acciones, en diversos estudios, se han demostrado los efectos positivos de la citicolina sobre el aprendizaje y la memoria de animales envejecidos [373,407,408]. Basándose en esto y en sus efectos sobre la neuroplasticidad [409] y sobre la diferenciación y proliferación de células astrogliales [15,410], se postula su uso en procesos neurodegenerativos, aunque, por ejemplo, no ha mostrado ningún efecto protector en un modelo de enfermedad de Huntington [411] y en otro modelo de esclerosis lateral amiotrófica [412]. Gromova et al [413] consideran que los efectos farmacológicos de la CDP-colina se realizan a través de múltiples mecanismos moleculares que contribuyen a las acciones noótropas de esta molécula en diferentes modelos experimentales.
Síndrome de abstinencia experimental e intoxicaciones
Si se inyectan 300 mg de citicolina por vía intracarotídea en el gato, se obtienen unos efectos análogos a los observados con la administración de 2 mg de morfina por la misma vía. El animal da síntomas de furia y de alerta, y el rabo se coloca en posición rígida y erecta. Este hallazgo hizo pensar que ambas sustancias podrían presentar algún paralelismo en sus efectos a nivel de los neurorreceptores de los opiáceos endógenos y que la administración de citicolina podría tener utilidad en el síndrome de abstinencia por opiáceos, al frenar los efectos de la interrupción brusca del fármaco [414]. Tornos et al [415] estudiaron los efectos de la administración de citicolina sobre el síndrome de abstinencia experimental mediante el análisis de diversos métodos, como el
jumping test en el ratón y los estudios de comportamiento y de las modificaciones de la temperatura corporal en la rata. El síndrome de abstinencia, provocado por la administración de naloxona a ratones dependientes de la morfina, fue valorado por el número de saltos efectuados por los animales, mostrando un descenso en la intensidad en el grupo de animales tratados con 2 g/kg de citicolina por vía oral en comparación con el grupo control de animales no tratados. Esta menor intensidad del síndrome de abstinencia se manifestó por un descenso del 39% en el promedio de saltos efectuados por los animales en los 10 minutos siguientes a la administración del antagonista opiáceo. Análogamente, en el estudio de comportamiento en ratas dependientes de la morfina, se comprobó que la administración de una dosis oral de 2 g/kg de citicolina, simultáneamente con la naloxona, es capaz de disminuir significativamente la agudeza de las manifestaciones que caracterizan el cuadro de abstinencia provocado. En cuanto a la hipotermia provocada por la administración de naloxona en ratas dependientes de la morfina, la administración de una dosis oral única de citicolina neutraliza casi por completo dicho efecto. Nejati et al [416] estudiaron los efectos de las inyecciones intraperitoneales de citalopram y citicolina sobre los efectos ansiolíticos inducidos por la morfina en ratones no sensibilizados y sensibilizados con morfina, y demostraron un efecto sinérgico de citalopram y citicolina sobre la inducción de un comportamiento ansiolítico en ratones no sensibilizados y ratones sensibilizados con morfina.
Hallazgos característicos de la fetopatía alcohólica son el retraso en la maduración y el desarrollo tardío de las dendritas en el neocórtex, el hipocampo y el cerebelo. Basándose en estos datos, Patt et al [417] realizaron un estudio para investigar los efectos de la citicolina sobre las células de Purkinje de ratas recién nacidas de madres alcohólicas. Se demostró cómo este agente estabilizador de las membranas neuronales reduce el efecto nocivo del alcohol sobre el sistema nervioso central. Wang and Bieberich [418] han demostrado que la exposición prenatal al alcohol promueve apoptosis inducida por la caramida en tejidos derivados de la cresta neural concurrentes con defectos en el desarrollo craneal y que el tratamiento con CDP-colina puede disminuir el daño tisular inducido por el alcohol. Petkov et al [419] también han demostrado que la citicolina disminuye los déficits mnésicos en ratas expuestas pre- y postnatalmente al alcohol, lo que podría estar en relación con los efectos beneficiosos sobre la síntesis y la liberación de acetilcolina que se han demostrado mediante microdiálisis cerebral en ratas expuestas crónicamente al alcohol [420,421]. Asimismo, la citicolina ha mostrado un efecto protector en la intoxicación nicotínica [422] y en el caso de la intoxicación por mercurio [423]. Buelna-Chontal et al [424] demostraron que la citicolina elude el daño mitocondrial inducido por mercurio y la disfunción renal en un modelo de insuficiencia renal en ratas. Laksmita et al [425] demostraron los beneficios potenciales de la citicolina para el tratamiento de la intoxicación ocular por metanol en un modelo experimental de ratas.
Aminzadeh y Salarinejad [426] analizaron el efecto de la citicolina sobre la apoptosis inducida por plomo en células PC12 y sus hallazgos revelaron que la citicolina ejerce un efecto neuroprotector contra la lesión inducida por plomo en células PC12 a través de la mitigación del estrés oxidativo y, al menos en parte, a través de la supresión de la vía apoptósica mediada por mitocondrias. Gudi et al [427] intentaron confirmar resultados previos que mostraban que la citicolina mejora la remielinización y determinar los posibles efectos regenerativos de dosis más bajas de citicolina (100 y 50 mg/kg). Los efectos de la citicolina se investigaron en el modelo de ratón inducido por cuprizona tóxica de desmielinización y remielinización. Los autores encontraron que incluso las dosis bajas de citicolina mejoraron efectivamente la remielinización temprana. Los efectos beneficiosos sobre la regeneración de la mielina estuvieron acompañados de un mayor número de oligodendrocitos. Llegaron a la conclusión de que la citicolina podría convertirse en una sustancia regeneradora prometedora para pacientes con esclerosis múltiple y debería probarse en un ensayo clínico. Shaffie y Shabana [428] indicaron que el tratamiento con citicolina puede proteger contra la toxicidad inducida por tolueno en ratas.
Masud et al [429], en un estudio experimental en ratones, demostraron que la dexametasona y la citicolina atenúan la neuropatía periférica inducida por cisplatino a través de un efecto antiinflamatorio, mejorando la capacidad antioxidante e inhibiendo la peroxidación lipídica.
Zhong et al [430] concluyeron que la citicolina puede proteger contra la pérdida de células ciliadas inducida por la neomicina al inhibir la agregación de especies reactivas de oxígeno y, por lo tanto, prevenir la apoptosis en las células ciliadas, y esto sugiere que la citicolina podría servir como un fármaco terapéutico potencial en la clínica para proteger las células ciliadas y, por lo tanto, prevenir la pérdida auditiva asociada al uso de aminoglucósidos.
Toxicidad
Toxicidad aguda
La toxicidad aguda por administración única de citicolina se ha estudiado en diversas especies animales y por distintas vías de administración. La DL
50 por vía intravenosa en ratón, rata y conejo es de 4,6, 4,15 y 1,95 g/kg, respectivamente [431,432]. Por vía oral, la DL
50 es de 27,14 g/kg en el ratón y de 18,5 g/kg en la rata [433]. La DL
50 de la citicolina por vía intravenosa resulta ser unas 44 veces superior a la DL
50 del clorhidrato de colina, en dosis equivalentes, y se ha constatado que las dosis de colina que producen crisis colinérgicas no dan lugar a signo alguno de toxicidad cuando se administran dosis equivalentes de citicolina [434,435]. Ello indica que la administración de citicolina comporta unas consecuencias metabólicas claramente diferenciadas de las que presenta la administración de colina exógena. La administración por vía oral de 2.000 mg/kg de citicolina se toleró bien [436].
Toxicidad subaguda
La administración intraperitoneal a la rata de dosis de hasta 2 g/kg/día de citicolina durante 4,5 semanas no dio lugar a signos clínicos de toxicidad ni a modificaciones significativas de los parámetros hematológicos, bioquímicos o histológicos analizados. Sólo se observó una ligera disminución de la ingesta y de la ganancia de peso a partir de las dos semanas del estudio [433]. Resultados análogos ofreció la administración subcutánea a la rata macho de hasta 1 g/kg/día durante cuatro semanas [432]. La administración por vía oral de 1,5 g/kg/día a la rata durante 30 días no ocasionó alteraciones ponderales, hematológicas, bioquímicas o histológicas [437].
Toxicidad crónica
Los estudios de toxicidad crónica por vía oral (1.5 g/kg/día durante 6 meses en perros) e intraperitoneal (1 g/kg/día durante 12 semanas en ratas) no revelaron tampoco anomalías significativas en relación con la administración del fármaco [432, 438]. La administración intravenosa de 300-500 mg/kg/día de citicolina durante tres meses en perros sólo ocasionó manifestaciones tóxicas inmediatamente después de la inyección, como vómitos, y diarreas y sialorrea ocasionales [435]. En un estudio en ratas, la administración por vía oral de 100, 350 y 1.000 mg/kg/día/90 días no supuso un incremento de la mortalidad. En machos se observó un incremento ligeramente significativo de la creatinina sérica (350 y 1.000 mg/kg/día) y un descenso del volumen de orina (todos los grupos). En hembras, se observó un incremento ligeramente significativo en el recuento de leucocitos y linfocitos (1.000 mg/kg/día), y del nitrógeno ureico en la sangre (100 y 350 mg/kg/día). Se encontró un incremento dependiente de la dosis de la mineralización tubular renal, sin cambios inflamatorios ni degenerativos, en todas las hembras tratadas con las diferentes dosis y en dos machos tratados con 1.000 mg/kg/día. La mineralización renal en ratas, especialmente en hembras, se ve influida por la
ratio calcio:fósforo de la dieta. Este fenómeno se podría explicar basándose en que un consumo elevado de citicolina podría dar lugar a un incremento de la ingesta de fósforo [436].
Teratogenicidad
La citicolina se administró a conejos albinos en una dosis de 800 mg/kg durante la fase de organogenia, es decir, desde el séptimo al 18.º día de gestación. Los animales fueron sacrificados el día 29.º y se realizó un minucioso examen de los fetos y de sus madres. No se observaron signos de toxicidad materna ni embriofetal. Los efectos sobre la organogenia fueron inapreciables, y se observó sólo, en un 10% de los fetos tratados, un ligero retraso en la osteogenia craneal (datos no publicados).
Farmacocinética
Curvas de niveles plásmicos. Biodisponibilidad
Se administró citicolina marcada (metil
14C) a ratas en dosis de 4 mg/kg mediante inyección en la vena yugular y por vía oral, mediante sonda nasogástrica [439]. Los resultados obtenidos, expresados en forma de porcentaje de radioactividad en 10 mL de sangre para cada una de las vías de administración, se muestran en la tabla II. A partir de estos datos se calculó la biodisponibilidad de la vía de administración oral respecto a la endovenosa, y se encontró que aquélla resultó ser prácticamente la unidad, lo que está en consonancia con el hecho, constatado en el mismo estudio, de que no se encuentra radioactividad residual en las heces eliminadas durante las 72 horas posteriores a la administración oral.
Tabla II. Cinética sanguínea de la radioactividad total después de la administración por vía oral y endovenosa a ratas macho de 4 mg/kg de (metil 14C)citicolina. Se indica el porcentaje de radioactividad (media ± desviación estándar) respecto de la total administrada.
|
|
Tiempo
|
Vía oral
|
Vía endovenosa
|
|
10 min
|
0,26 ± 0,12
|
3,05 ± 0,24
|
|
20 min
|
0,40 ± 0,02
|
2,59 ± 0,31
|
|
30 min
|
0,74 ± 0,01
|
1,47 ± 0,22
|
|
1 h
|
1,32 ± 0,40
|
1,40 ± 0,02
|
|
2 h
|
2,33 ± 0,63
|
2,84 ± 0,02
|
|
3 h
|
3,31 ± 0,86
|
2,50 ± 0,05
|
|
4 h
|
3,57 ± 0,88
|
2,77 ± 1,00
|
|
5 h
|
4,17 ± 0,83
|
3,37 ± 0,31
|
|
6 h
|
4,18 ± 0,03
|
3,68 ± 0,02
|
|
7 h
|
3,81 ± 0,73
|
–
|
|
24 h
|
2,48 ± 0,40
|
3,12 ± 0,19
|
López-Coviella et al [440] estudiaron los efectos de la citicolina sobre los niveles plásmicos de citidina, colina y CDP-colina en voluntarios sanos que recibieron la sustancia por vía oral o vía endovenosa y en ratas, por vía endovenosa. Dos horas después de la administración de una dosis oral única de 2 g de citicolina, los niveles plásmicos de colina se incrementaron un 48% y los de citidina, un 136% (Fig. 11). En los individuos que recibieron tres dosis de 2 g en intervalos de dos horas, la colina plásmica alcanzó un pico, aproximadamente del 30% del valor basal, a las cuatro horas de la administración de la dosis inicial de citicolina, mientras que los niveles plásmicos de citidina se incrementaron hasta las seis horas (Fig. 12), y fueron cinco veces superiores al nivel basal (
p < 0,001). La citicolina administrada por vía endovenosa fue rápidamente hidrolizada, tanto en humanos como en ratas [441]. En individuos sanos que reciben una infusión de citicolina de 3 g en 500 mL de suero salino fisiológico durante 30 minutos, los niveles de CDP-colina son prácticamente indetectables inmediatamente después de finalizar el período de infusión, momento en el que los niveles plásmicos de citidina y colina alcanzan un pico, aunque su concentración permanece elevada significativamente hasta las seis horas de iniciada la infusión (Fig. 13). Estas observaciones muestran que la citicolina, administrada tanto por vía oral como por vía endovenosa, se convierte en dos metabolitos circulantes principales, citidina y colina, si bien, en el ser humano, la citidina a nivel plásmico se transforma en uridina, que es como circula, y en uridintrifosfato a nivel cerebral, el cual se convertirá en citidintrifosfato a nivel neuronal [442].
Figura 11. Concentraciones plasmáticas de colina y citidina inmediatamente después de la administración de una única dosis de 2 g de citicolina por vía oral a humanos.

Figura 12. Niveles plasmáticos de colina y citidina tras la administración de tres dosis consecutivas de 2 g de citicolina por vía oral a humanos.

Figura 13. Concentraciones de colina, citidina y CDP-colina en plasma humano tras la infusión intravenosa de una solución de citicolina (3 g/500 mL de solución salina fisiológica).

Difusión tisular y distribución. Transporte y metabolismo
La difusión tisular de citicolina y sus componentes se ha estudiado en ratas, a las que se administró, por vía endovenosa, (metil
14C, 5-
3H) citicolina, marcada en la fracción de colina y en la fracción de citidina [443,444]. En la misma batería de pruebas se determinaron los niveles de radioactividad en plasma durante 30 minutos después de la administración, así como la excreción renal y fecal, durante 48 horas, de los metabolitos marcados. Se encontró que, ya dos minutos después de la inyección, se encontraba en el plasma menos del 10% de la radioactividad administrada. Por otra parte, la radioactividad excretada por el riñón durante las primeras 48 horas sólo representa el 2,5% del
14C y el 6,5% del
3H administrados. La excreción fecal, en el mismo intervalo de tiempo, no superaba el 2% de la dosis administrada. Estos resultados sugieren que la citicolina difunde rápidamente hacia los tejidos tras su administración, y se utiliza activamente por éstos. La figura 14 muestra los niveles de radioactividad encontrados en el hígado, el cerebro y el riñón, en distintos tiempos, tras la administración endovenosa de citicolina doblemente marcada. De especial interés es la evolución de los niveles en el cerebro, y se observa que la incorporación de la radioactividad en este órgano aumenta progresivamente durante las primeras 10 horas posteriores a la administración del fármaco y que los niveles alcanzados persisten, sin disminuir, al cabo de 48 horas.
Figura 14. Niveles de radioactividad en el hígado (a), cerebro (b) y riñón (c) de ratas en distintos tiempos después de la inyección de citicolina doblemente marcada en dosis de 2 mg/kg. Todos los valores representan el promedio obtenido a partir de 10 animales.
En un grupo de animales, se determinaron los niveles de radioactividad correspondientes a los compuestos marcados presentes en el cerebro a las 0,5, 1, 4 y 48 horas de la administración de citicolina doblemente marcada. Se observó que la radioactividad cerebral correspondiente al
3H se concentraba principalmente en los nucleótidos citidínicos al principio, para posteriormente concentrarse en los ácidos nucleicos. Por lo que respecta a los compuestos marcados con
14C, los mayores niveles correspondieron inicialmente a la betaína, la colina y la fosforilcolina, mientras que, a las cuatro horas, la
14C-metionina y los
14C-fosfolípidos representaban el 26,4 y el 24,2%, respectivamente, de la radioactividad cerebral total correspondiente al
14C. A las 48 horas, esta radioactividad se concentraba principalmente en los fosfolípidos y las proteínas. Se observó, por lo tanto, que los fosfolípidos marcados se incrementaban continuamente en las 48 horas siguientes a la administración de citicolina doblemente marcada. Tal y como se observa en la figura 15, este aumento es rápido en las primeras cinco horas y más lento posteriormente.
Figura 15. Evolución de los niveles de 14C-fosfolípidos en el cerebro de rata después de la administración intravenosa de citicolina doblemente marcada. Los niveles representan promedios obtenidos a partir de tres animales y se expresan como porcentaje de la radioactividad total correspondiente al 14C en el cerebro.

En otra batería de pruebas, tras la administración de (metil
14C) citicolina, se determinó la presencia del fármaco en diversas áreas cerebrales y su distribución en las ultraestructuras cerebrales [445-449]. En un estudio, realizado con autorradiografía de alta resolución en cerebro de ratón a las 24 horas de la administración de citicolina marcada [445], se observó que el marcador radioactivo se incorporaba ampliamente a las distintas áreas cerebrales estudiadas, corteza cerebral, sustancia blanca y núcleos grises centrales, y se encontró tanto en los espacios intra- como extracelulares, y destacó su presencia en las membranas celulares. Realizando el mismo modelo experimental, pero a los 10 días de la administración del fármaco marcado [446], se observó una concentración de la radioactividad en las zonas más mielinizadas, así como una marcada captación por parte de las células de Purkinje cerebelosas. Utilizando autorradiografía de baja resolución, se analizó la distribución de la radioactividad de citicolina marcada en el cerebro de rata a las cinco y 24 horas de la administración del fármaco [447], y se encontró que, a las 24 horas, la mayor parte de la radioactividad se detecta a nivel intracelular. En otro estudio se analizó la incorporación de la radioactividad procedente de la (metil
14C) citicolina, tras su administración por vía oral a ratas Sprague-Dawley macho, en las diferentes fracciones fosfolipídicas cerebrales [448]. Un 62,8% de la radioactividad total determinada en el cerebro se encuentra formando parte de fosfolípidos cerebrales, especialmente fosfatidilcolina y esfingomielina, lo que demuestra que la citicolina administrada por vía oral tiene efecto sobre la síntesis de los fosfolípidos estructurales de las membranas celulares. Estos resultados coinciden con los obtenidos por Aguilar et al [449], quienes demostraron que la radioactividad procedente de citicolina marcada se asociaba a las membranas citoplásmica y mitocondrial, en homogenado de cerebro.
En conclusión, estos estudios demuestran que la citicolina se distribuye ampliamente en las estructuras cerebrales, con una rápida incorporación de la fracción colina en los fosfolípidos estructurales y de la fracción citosina en los nucleótidos citidínicos y los ácidos nucleicos. La citicolina alcanza el cerebro y se incorpora activamente en las membranas celulares, citoplásmica y mitocondrial, formando parte de la fracción de los fosfolípidos estructurales [441,450,451].
Vía y cinética de eliminación
Cuando se administra citicolina marcada, ya sea por vía oral o por vía endovenosa, se observa una eliminación muy lenta de la radioactividad, que se produce por vía urinaria, fecal y por el CO
2 espirado [452].
En la figura 16 se muestra la excreción total de la radioactividad durante cinco días después de la administración, por vía oral, de
14C citicolina a voluntarios sanos. La tabla III recoge los principales datos referentes a la cinética de eliminación del producto.
Figura 16. Excreción total de la radioactividad (porcentaje respecto al total administrado) durante cinco días después de la administración oral de 14C-citicolina. Se expresa el valor medio de seis individuos.
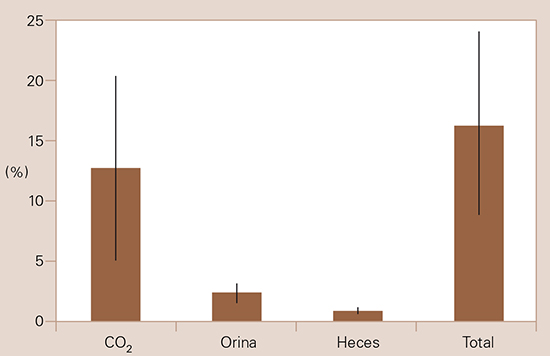
Tabla III. Parámetros más significativos de la cinética de eliminación de la 14C-citicolina después de su administración por vía oral. Los datos expresan la media de seis individuos.
|
| |
CO2
|
Orina
|
Heces
|
Velocidad máxima de excreción (% dosis/h)
|
1,22 ± 0,59
|
0,159 ± 0,084
|
0,021 ± 0,008
|
Momento de máxima excreción (h)
|
1,60 ± 0,73
|
1,3 ± 0,8
|
56 ± 18
|
Primera fase de eliminación
Vida media aparente (h)
Velocidad de eliminación aparente (% dosis/h)
|
2,58 ± 0,60
0,279 ± 0,055
|
6,62 ± 1,28
0,107 ± 0,017
|
–
–
|
Segunda fase de eliminación
Vida media aparente (h)
Velocidad de eliminación aparente (% dosis/h)
|
56,22 ± 33,39
0,030 ± 0,049
|
71,08 ± 58,16
0,013 ± 0,006
|
19,39 ± 6,63
0,039 ± 0,014
|
En la eliminación urinaria del fármaco se distinguen dos fases: una primera fase, de unas 36 horas, durante la cual la velocidad de excreción disminuye rápidamente, y una segunda fase en la que la velocidad de excreción disminuye mucho más lentamente. Lo mismo sucede con el CO2 espirado, cuya velocidad de eliminación disminuye rápidamente durante las primeras 15 horas, aproximadamente, para disminuir más lentamente con posterioridad.
Experiencia clínica
Traumatismos craneoencefálicos y secuelas
En los estudios experimentales anteriormente descritos se ha comprobado que la administración de citicolina da lugar a una regresión significativa del edema cerebral y a una mejoría del trazado electroencefalográfico y de la alteración de la conciencia, así como de la calidad de la supervivencia. El efecto sobre el nivel de conciencia es atribuible a la acción facilitadora de la reacción electroencefalográfica del despertar, provocada por la estimulación del sistema reticular activador ascendente, a nivel del tronco cerebral.
Con estas premisas experimentales, se han llevado a término numerosos estudios clínicos, a fin de comprobar si estos efectos tienen alguna traducción en el tratamiento de los pacientes afectos de traumatismo craneoencefálico (TCE).
En 1967, Moriyama et al [453] publicaron su estudio sobre los efectos de la citicolina en 25 pacientes con trauma craneal y depresión del nivel de conciencia, demostrando su eficacia, con la recuperación de los síntomas clínicos neurológicos y del estado de conciencia, en el 70% de los casos; y, por otra parte, la perfecta tolerancia del producto, sin que se constatase efecto secundario alguno.
Ayuso y Saiz [454] realizaron un estudio doble ciego sobre el valor de la citicolina en la disfunción mnésica inducida por el electroshock bilateral, en una serie de 22 enfermos ingresados por una depresión endógena. El grupo que recibió el medicamento activo mostró una menor reducción del rendimiento de la memoria, tras cuatro sesiones de electroshock, en comparación con el grupo control, demostrando la utilidad de la citicolina en el tratamiento de pacientes con trastornos de la memoria de base orgánica.
De La Herrán et al [455] compararon los efectos de la administración de citicolina en una serie de 50 pacientes con deterioro del nivel de conciencia, que, en 32 casos, era de origen traumático, con otra serie de enfermos de características similares y que recibían el tratamiento habitual. El 34% de los pacientes recuperaba la conciencia en las primeras 48 horas. A los pocos días, el 66% de los pacientes había recuperado la conciencia, y estos resultados eran superiores a los obtenidos en el grupo control. Con estos resultados demostraron cómo la citicolina reactiva y acelera la normalización del estado de conciencia en los pacientes afectos de TCE.
Carcassonne y LeTourneau [456] realizaron un estudio doble ciego, en una serie de 43 niños con trastorno verdadero de la conciencia de causa traumática, y descartaron los casos de gravedad y los que precisaban tratamiento quirúrgico. Tras el análisis de los resultados obtenidos, estos autores llegaron a las siguientes conclusiones:
- La citicolina se tolera perfectamente, tanto local como generalmente.
- La citicolina acelera significativamente la recuperación de un estado de conciencia normal.
- La citicolina acelera la desaparición de los trastornos neuropsíquicos y de los trastornos de la electrogenia cerebral.
- La citicolina confiere una mejor calidad a la evolución de los pacientes.
Espagno et al [457] compararon los efectos de la citicolina frente al placebo en una serie de 46 pacientes que habían sufrido un TCE. Plantearon un estudio doble ciego, en el que 22 pacientes recibieron 250 mg/día de citicolina por vía parenteral, durante 20 días, y 24 pacientes, el placebo. Los resultados obtenidos mostraron que, en los comas ligeros, la citicolina aceleraba significativamente (p < 0,05) la recuperación de la conciencia, mientras que, en los comas más graves y en la dosis administrada, que hoy se considera muy insuficiente, la citicolina mejoraba el pronóstico, de forma que el 75,2% de los pacientes del grupo placebo presentaba una recuperación tardía (>15 días) de la conciencia y/o evolución al fallecimiento; en cambio, en el grupo tratado con el producto activo, la recuperación del coma por encima del 15.º día se dio en el 31% de los casos y la incidencia del coma prolongado y/o fallecimiento fue del 12,5%. En conclusión, la citicolina condicionaba una recuperación más precoz de la conciencia y un mayor número de mejorías clínicas y electroencefalográficas, destacando, por otro lado, su perfecta tolerancia.
Richer y Cohadon [458] efectuaron un estudio doble ciego en un grupo de 60 pacientes con coma de etiología traumática, distribuidos en dos grupos homogéneos, uno de los cuales recibía el medicamento activo, y el otro, el placebo. En cuanto a la duración del coma, a los 60 días, el número de pacientes que había recuperado la conciencia era significativamente mayor (p < 0,01) en el grupo tratado con citicolina. A los 90 días, había una mayor recuperación (p < 0,04) del déficit motor en el grupo tratado con citicolina. También se comprobó que, en el grupo del activo, se aceleraba de forma significativa la recuperación de la marcha. En consecuencia, a los 60 días, había una reinserción socioprofesional mayor en el grupo tratado con citicolina (p < 0,06). Así, se puso en evidencia el efecto limitador de la duración del coma postraumático que tiene citicolina, así como su participación en la restauración de los déficits ligados a las lesiones encefálicas que acompañan a estos comas. En cambio, la mortalidad no se vio alterada por los tratamientos.
Lecuire y Duplay [459], en un ensayo doble ciego, compararon los efectos de citicolina, en dosis de 750 mg/día por vía endovenosa, con los de meclofenoxato, a dosis de 3 g/día por vía intravenosa, en un grupo de 25 pacientes. El análisis de los resultados demostró una mejoría significativa en el grupo de pacientes tratados con citicolina, sobre todo en lo referente a la recuperación de la conciencia, las modificaciones electroencefalográficas y la recuperación funcional. La duración media del coma fue de 10 días en el grupo de citicolina, mientras que en el grupo de meclofenoxato fue de 20 días. A los 10 días, había mejorado el trazado electroencefalográfico en el 50% de los pacientes tratados con citicolina y en el 18% de los pacientes que recibían meclofenoxato. En conclusión, la citicolina se mostró superior al meclofenoxato, y su principal característica fue la aceleración de la recuperación del nivel de conciencia, lo que se relaciona con la mejoría del trazado electroencefalográfico. Estos mismos autores realizaron un estudio abierto en una serie de 154 pacientes con TCE [460], en el que valoraron los efectos del tratamiento con citicolina, y encontraron que aceleraba el despertar de los pacientes y la recuperación de los síndromes deficitarios, así como que mejoraba la calidad de la supervivencia. Posteriormente, Lecuire [461] realizó un estudio doble ciego comparativo de piracetam (6 g/día) frente a citicolina (750 mg/día), en un grupo de 40 pacientes afectos de TCE, y encontró que había un 75% de evoluciones favorables en el grupo de pacientes que recibía citicolina frente a un 33% en el grupo de piracetam.
Cohadon et al [21,462] han comprobado la eficacia clínica de la citicolina en un estudio doble ciego, realizado sobre una serie de 60 pacientes con TCE grave. En ambos grupos, el tratamiento seguido fue el habitual y, cuando fue necesario, se practicó tratamiento quirúrgico. Un grupo de pacientes recibió citicolina en dosis de 750 mg/día, los primeros seis días por vía endovenosa, pasando luego a vía intramuscular durante 20 días más. El otro grupo recibía un tratamiento con placebo. La evaluación clínica se continuó hasta los seis meses. A los 15 días, la respuesta al estímulo doloroso ya era superior en el grupo de pacientes tratados con citicolina (p < 0,01), obteniendo una recuperación de la conciencia más precoz en este grupo (Fig. 17). También observaron una mayor recuperación de los déficits neurológicos en el grupo del activo. A los 120 días, el 84% de los pacientes del grupo de citicolina tenía una marcha autónoma, mientras que, en el grupo placebo, la había recuperado el 62,5%, y esta diferencia era estadísticamente significativa a partir del 60.º día (p < 0,01). La tabla IV expone el resultado final obtenido en ambos grupos y valorado según la escala de recuperación de Glasgow, y se puede observar que el índice de mortalidad fue similar. Los datos obtenidos en este trabajo demuestran que la citicolina acorta el tiempo que tarda en recuperarse la conciencia y que acelera la recuperación de los déficits neurológicos en los pacientes con TCE grave.
Figura 17. Normalización del nivel de conciencia en función del tiempo y del tratamiento recibido; p < 0,01 en el día 60.

Tabla IV. Resultados finales según el tratamiento.
|
| |
Escala de recuperación de Glasgow
|
I
|
II
|
III
|
IV
|
V
|
Grupo placebo
|
12
|
5
|
4
|
3
|
6
|
Grupo citicolina
|
11
|
9
|
3
|
2
|
5
|
Deleuze et al [463] han demostrado que la citicolina es capaz de reducir los niveles de creatinfosfocinasa sérica y los niveles de lactato en el líquido cefalorraquídeo, con disminución de la razón lactatos/piruvatos, en pacientes con sufrimiento cerebral grave y coma, y destaca, por otra parte, la perfecta tolerancia del producto.
Ogashiwa et al [115] realizaron un ensayo clínico en 101 pacientes con trastornos del nivel de conciencia de diversa etiología (el 20% de causa traumática), y demostraron la efectividad de líquido cefalorraquídeo citicolina, al mejorar la tasa de recuperación general, que está muy relacionada con la
Principal Component Analysis Score. Encontraron que líquido cefalorraquídeo citicolina era más efectiva en los ítems relacionados con el factor ejecutivo que en los relacionados con el factor verbal, y que el mayor efecto obtenido era en pacientes de menos de 60 años y con un período estabilizado del deterioro de la conciencia no superior a tres semanas. Destacan, además, la excelente tolerabilidad del producto, y llega incluso, en determinados casos, a administrarlo por vía intratecal [464,465].
En el Servicio de Neurocirugía del Centro Especial Ramón y Cajal de Madrid, se comparó una serie de 100 pacientes con TCE, tratados con citicolina hasta el momento del alta, y los resultados fueron comparados con otra serie de 100 individuos de características similares, pero que no recibieron citicolina [466]. El tratamiento con citicolina se inició en dosis de 600-1.200 mg/día, por vía parenteral, pasando a 300-900 mg/día, por vía oral, en la fase de rehabilitación. La evolución se controló valorando la duración media del coma, la persistencia de síntomas neurológicos y psíquicos, la escala Wechsler de inteligencia para adultos y estudios electrofisiológicos de la tensión muscular. Los resultados obtenidos indicaron que la adición de citicolina a la pauta de tratamiento origina una disminución de la duración del coma postraumático y de la tasa de secuelas, tanto neurológicas como psíquicas, consiguiendo la mejor respuesta en la recuperación de los trastornos de la esfera intelectual y en los déficits motores.
Raggueneau y Jarrige [467], en una encuesta a nivel nacional realizada en Francia, han recogido 921 casos de TCE grave, es decir, con una puntuación inicial en la escala de coma de Glasgow menor o igual a 8. De estos pacientes, 219 habían recibido tratamiento con citicolina, lo que permitió establecer dos grupos y comparar los resultados obtenidos. No se encontraron diferencias significativas en cuanto a la mortalidad, pero sí en el número de estados dependientes, y se observó que el mayor efecto se daba en los pacientes con una puntuación en la escala de coma de Glasgow inicial de 6-7 (Fig. 18). La citicolina mejoró la calidad de la supervivencia, permitiendo una reinserción social y familiar más frecuentemente, así como el retorno al trabajo o a la escolarización. La mortalidad del TCE depende esencialmente de las lesiones iniciales, que, salvo el hematoma epidural, están fuera de toda resolución terapéutica real.
Figura 18. Incidencia del tratamiento con citicolina en el resultado final. Los resultados se expresan como porcentaje. a p > 0,001 respecto al grupo de pacientes no tratados con citicolina.
Calatayud et al [468] presentaron los resultados de la influencia de la incorporación de citicolina en el tratamiento del TCE. Se recogió a 216 pacientes, con una puntuación en la escala de coma de Glasgow inicial comprendida entre 5 y 10, de los que 115 recibieron tratamiento con citicolina. La dosis media de citicolina administrada fue de 4 g/día. Del análisis de los resultados se comprueba que la citicolina:
- Disminuye la estancia hospitalaria (p < 0,05) y la duración del control ambulatorio (p < 0001), resultando estas diferencias más marcadas en el grupo de pacientes con una puntuación en la escala de coma de Glasgow inicial entre 5 y 7.
- Favorece la recuperación de la memoria, los trastornos motores, las funciones neurológicas superiores y las alteraciones del carácter.
- Mejora el resultado funcional global (Tabla V).
Tabla V. Resultado final, valorado con la escala de recuperación de Glasgow (GOS), en función del tratamiento recibido (p < 0,05).
|
| |
Citicolina
|
Control
|
GOS I
|
77
|
51
|
GOS II
|
19
|
31
|
GOS III
|
1
|
7
|
GOS IV
|
0
|
2
|
GOS V
|
18
|
10
|
Lozano [469] presentó los resultados de la repercusión del tratamiento con citicolina en la evolución del edema cerebral postraumático, en un estudio realizado en 78 casos con TCE, que tenían una puntuación en la escala de coma de Glasgow inicial comprendida entre 5 y 7. En todos los casos se realizó una tomografía computarizada craneal al inicio y al final del estudio, para valorar la evolución de la imagen tomográfica del edema cerebral. Otros parámetros que se investigaron fueron la duración de la estancia hospitalaria y el grado de autonomía en el momento del alta hospitalaria. La citicolina se administró a 39 pacientes durante las dos primeras semanas, en una dosis que oscilaba entre 3 y 6 g/día, mediante perfusión endovenosa. Tras 14 días de tratamiento con citicolina, la imagen del edema cerebral evolucionó de la forma que se muestra en la figura 19. Se observa cómo en el grupo de pacientes tratados con citicolina, el edema cerebral se había reducido o normalizado en un número de pacientes superior al del grupo control, y estas diferencias eran altamente significativas (
p < 0,005). En cuanto a los requerimientos terapéuticos, no se observaron diferencias significativas entre ambos grupos, ni en cuanto a los tratamientos recibidos. La estancia hospitalaria media fue de 28,718 ± 21,6 días para el grupo que había recibido el tratamiento activo y de 37,323 ± 35,22 días para el grupo control, resultando unas diferencias estadísticamente significativas (
p < 0,001). En los resultados finales, valorados según la escala de recuperación de Glasgow, las diferencias obtenidas no alcanzaron significación estadística, debido al escaso número de casos y a las características especiales de este tipo de pacientes. No obstante, se observa que hay una tendencia hacia una resolución más favorable en el grupo de pacientes tratados con citicolina (Tabla VI).
Figura 19. Evolución de la imagen tomográfica de edema cerebral tras 14 días de tratamiento (p < 0,005).
Tabla VI. Resultado final, valorado con la escala de recuperación de Glasgow (GOS), en función del tratamiento recibido (no significativo).
|
| |
Citicolina
|
Control
|
GOS I
|
15
|
11
|
GOS II
|
8
|
8
|
GOS III
|
6
|
7
|
GOS IV
|
4
|
6
|
GOS V
|
6
|
7
|
Levin [470] realizó un estudio en 14 pacientes con síndrome posconmocional tras un TCE leve o moderado. Este síndrome se caracteriza por la presencia de síntomas del tipo cefalea, vértigo, trastornos mnésicos y alteraciones del sueño, principalmente. En este estudio, los pacientes tratados con citicolina durante un mes tuvieron una mejoría en las pruebas de memoria, especialmente en las de reconocimiento, que fue estadísticamente significativa en comparación con el placebo. En la figura 20 se muestra la evolución de los síntomas al cabo de un mes de tratamiento, y se observa que las mejorías obtenidas en los pacientes tratados con citicolina son superiores a las del grupo placebo, a excepción de las molestias gastrointestinales. La sensación vertiginosa fue significativamente más frecuente en los pacientes del grupo placebo tras un mes de estudio. En un reciente estudio simple ciego realizado en India [471] con citicolina en pacientes con TCE leve, no obstante, no se encontraron diferencias respecto al control en la evolución de los síntomas posconmocionales. A pesar de esto, la CDP-colina se considera como una opción terapéutica para el síndrome posconmocional [472].
Figura 20. Evolución de los síntomas posconmocionales tras un mes de tratamiento con citicolina o placebo. Se representa el número de pacientes que referían cada una de las alteraciones contempladas.

León-Carrión et al [473-475], en una serie de estudios, han investigado los efectos de la citicolina sobre los trastornos de memoria postraumáticos. En un grupo de siete pacientes con déficits de memoria graves, investigaron los efectos de la administración de 1 g de citicolina sobre el flujo sanguíneo cerebral, medido mediante la técnica de inhalación de Xe
133. Se realizaron dos mediciones, una basal y otra a las 48 horas, en las mismas condiciones, con la excepción de que los pacientes habían tomado el fármaco una hora antes del examen. Todos los pacientes presentaron una significativa hipoperfusión a nivel de la zona inferoposterior del lóbulo temporal izquierdo en la primera determinación, la cual desapareció tras la administración de citicolina. En un segundo estudio, 10 pacientes con déficits graves de memoria fueron aleatorizados en dos grupos. Ambos grupos de pacientes se sometieron a un programa breve de rehabilitación de la memoria. Un grupo recibió 1 g/día por vía oral de citicolina durante los tres meses que duró el programa de tratamiento neuropsicológico, mientras que el otro grupo recibió placebo. Los resultados obtenidos se muestran en la tabla VII, y se observa que la rehabilitación neuropsicológica asociada a la citicolina consigue mejorías en todas las áreas evaluadas, las cuales alcanzan significación estadística en la fluencia verbal y en el test de Luria de recuerdo de palabras. Se considera la citicolina una opción válida para el tratamiento de las secuelas cognitivas tras un traumatismo craneoencefálico [476], además de ofrecer una mejor calidad de la supervivencia [477].
Tabla VII. Puntuaciones (media ± desviación estándar) obtenidas por los pacientes antes y después de los tratamientos.
|
| |
Grupo A (placebo + rehabilitación)
|
Grupo B (citicolina + rehabilitación)
|
Antes
|
Después
|
Antes
|
Después
|
Atención
|
95,60 ± 5,73
|
97,60 ± 2,19
|
82,00 ± 33,79
|
90,80 ± 20,57
|
Vigilancia
|
88,40 ± 8,65
|
96,80 ± 1,79
|
89,60 ± 17,74
|
98,80 ± 1,79
|
Fluidez verbal
|
22,40 ± 9,91
|
23,60 ± 11,01
|
24,80 ± 14,65
|
31,80 ± 9,36 a
|
Test de Benton
|
8,20 ± 3,63
|
9,40 ± 6,95
|
8,80 ± 5,45
|
7,20 ± 3,70
|
Test de Luria
|
62,80 ± 13,24
|
62,00 ± 11,58
|
63,20 ± 17,31
|
71,00 ± 12,98 a
|
a p < 0,05, en relación con antes del tratamiento.
|
Está pendiente de aparecer una revisión Cochrane referente a la citicolina en el tratamiento de los TCE [478].
Krishna et al [479] realizaron un ensayo prospectivo aleatorizado, simple ciego, controlado con placebo, de un solo centro, en una muestra de 100 pacientes. Los pacientes fueron aleatorizados para recibir citicolina (2 g/día/60 días por vía oral) o placebo y las evaluaciones de los resultados se realizaron al alta y después de 30 y 90 días. Los autores concluyeron que la tasa de recuperación fue más temprana en el grupo de citicolina en términos de una estancia más corta, recuperación temprana de la conciencia y alivio de los síntomas cognitivos.
En 2012 se finalizó el estudio Citicoline Brain Injury Treatment (COBRIT) [480,481], registrado con el número NCT00545662. El COBRIT es un estudio en fase 3, aleatorizado, doble ciego, llevado a cabo entre julio de 2007 y febrero de 2011, que incluyó a 1.213 pacientes con el objetivo de determinar la capacidad de la citicolina frente al placebo de modificar positivamente el estado funcional y cognitivo de pacientes con traumatismos craneales leves complicados, moderados y graves. Los pacientes se aleatorizaron para recibir un régimen de tratamiento con una dosis diaria de citicolina (2.000 mg), por vía enteral u oral, o placebo. La variable principal del estudio fue el estado funcional y cognitivo valorado a los 90 días con la TBI-Clinical Trials Network Core Battery, valorada conjuntamente mediante un test estadístico global. Objetivos secundarios fueron la mejoría funcional y cognitiva valorada a los 30, 90 y 180 días, así como la valoración de la persistencia de los efectos del tratamiento a largo plazo. Las tasas de mejoría según la escala de recuperación de Glasgow extendida fueron del 35,4% en el grupo de pacientes tratados con citicolina y del 35,6% en el grupo placebo. Para las demás escalas, la tasa de mejoría estuvo en un rango entre el 37,3 y el 86,5% en el grupo de citicolina, mientras que, en el grupo placebo, el rango de mejoría estuvo entre el 42.7% y el 84%. No hubo diferencias significativas entre ambos grupos en la evaluación a los 90 días –odds ratio (OR) global, 0,98; intervalo de confianza al 95% (IC 95%), 0,83-1,15–. Tampoco se detectaron diferencias entre grupos cuando se analizaron los pacientes según su gravedad –OR global 1,14 (IC 95%, 0,88-1,49) y 0,89 (IC 95%, 0,72-1,49) para pacientes con TCE moderado/grave y leve complicado, respectivamente–. A los 180 días, no hubo diferencias significativas entre los grupos para la variable principal del estudio (OR global, 0,87; IC 95%, 0,72-1,04). De acuerdo con estos resultados, los autores concluyeron que la citicolina no era eficaz en el tratamiento de pacientes con TCE. Este estudio es, efectivamente, el de mayor envergadura realizado hasta el momento con citicolina para esta indicación, pero no está carente de defectos metodológicos que cuestionan seriamente su validez y aplicabilidad. En primer lugar, se debe considerar que el COBRIT fue un estudio independiente, financiado por los National Institutes of Health estadounidenses, lo que implica un presupuesto limitado. Parece ser que una de las consecuencias de la limitación presupuestaria fue la acotación del tamaño muestral del estudio, por lo que los investigadores asumieron un efecto previsible del tratamiento con un OR de 1,4, con lo que el tamaño muestral ‘entraba’ dentro del presupuesto. De otro modo, si hubiesen utilizado un OR más razonable, el tamaño muestral se habría aumentado y no hubiesen tenido suficiente financiación. Otro de los aspectos metodológicos que se pueden cuestionar es la inclusión de pacientes con TCE desde leve complicado a grave, que son poblaciones diferentes, con fisiopatologías distintas, lo que disminuye la potencia de los resultados. Tampoco podemos obviar el hecho de utilizar el tratamiento por vía oral/enteral, sobre todo en los pacientes más graves, ya que esto puede interferir con la biodisponibilidad del medicamento en la fase aguda de este tipo de lesiones. Pero quizás el punto más controvertido del estudio COBRIT haya sido el bajísimo cumplimiento terapéutico, ya que sólo el 44,4% de los pacientes tomó más del 75% de la medicación prevista; en otras palabras, menos de la mitad de los pacientes recibió la dosis terapéutica de citicolina. Con estas premisas, no se puede considerar el estudio COBRIT como el estudio ‘definitivo’ para valorar el efecto de la citicolina en pacientes con TCE.
Ante la situación creada tras la publicación del estudio COBRIT, se ha publicado un metaanálisis [482] en el que se valora la eficacia real de la citicolina en el tratamiento de pacientes con TCE. Para completar esta revisión sistemática se realizó una búsqueda exhaustiva, con las palabras clave adecuadas, de todos los estudios clínicos disponibles sobre el uso de citicolina en el tratamiento de los TCE en fase aguda en las bases de datos disponibles (Medline y Embase), así como en la base de datos bibliográfica del Grupo Ferrer, la compañía comercializadora del producto en diversos países. Para ser incluidos en el metaanálisis, los trabajos debían estudiar el efecto de la citicolina en la fase aguda del TCE, ser por lo menos comparativos y disponer de datos de independencia, valorados con la escala de recuperación de Glasgow o similar. No se consideraron limitaciones de edad ni sexo en los participantes en los estudios, y tampoco se limitó el idioma de los artículos seleccionados. Para la realización del metaanálisis se usó el valor de corte de la escala de recuperación de Glasgow de 4-5, lo que refleja una recuperación excelente o con mínimas secuelas, y que garantiza un estado de independencia tras el TCE. En la búsqueda realizada se detectaron 23 estudios clínicos, de los que se seleccionaron 12 como válidos para el metaanálisis. Los 12 estudios seleccionados suman una muestra total de 2.706 pacientes con TCE de diversa gravedad, incluyendo casos leves, leves complicados, moderados y graves, y tratados con citicolina, con dosis que van desde los 250 mg al día hasta los 6 g diarios, usando tanto la vía oral como vías parenterales para su administración, y con una duración del tratamiento comprendida entre 7 y 90 días. Según el metaanálisis formal, basado en el método de efectos aleatorios (Fig. 21), el uso de citicolina se asocia con una mejor tasa de independencia, con una OR de 1,815 (IC 95%, 1,302-2,53), pero con una heterogeneidad significativa (I2 = 54,6%; p = 0,001), debida principalmente a la diferencia temporal en que se llevaron a cabo las diferentes investigaciones incluidas en el metaanálisis. Entre el primer estudio, que se publicó en 1978, y el último, aparecido en 2012, hay 34 años de diferencia. Al repetir el análisis con el método de efectos fijos, la OR obtenida fue de 1,451 (IC 95%, 1,224-1,721), que se corresponde con un resultado igualmente significativo y favorable a la citicolina, en cuanto a la recuperación funcional de los pacientes afectados por TCE. Pero se ha publicado otros metaanálisis con algunas limitaciones [483,484] que muestran efectos neutros de la CDP-colina en el tratamiento de pacientes con TCE.
Figura 21. Gráfico tipo Forest del metaanálisis para valorar el efecto de la citicolina en la independencia de pacientes con traumatismo craneoencefálico: odds ratio (OR): 1.815; intervalo de confianza al 95% (IC 95%): 1,302-2,530. Con permiso de J.J. Secades. Citicoline for the treatment of head injury: a systematic review and meta-analysis of controlled clinical trials. J Trauma Treat 2014; 4: 227. doi:10.4172/2167-1222.1000227.

Interesantes son los resultados obtenidos por Varadaraju y Ananthakishan [485], que demuestran cierto efecto sinérgico cuando se administra citicolina junto con cerebrolisina, ya que los pacientes tratados con esta asociación tienen mejor evolución que los pacientes tratados con citicolina sola. Titov et al [486] también demostraron un efecto positivo de la combinación de citicolina y cerebrolisina en el tratamiento del TCE en la fase aguda. Trimmel et al [487] investigaron el papel potencial de la administración de citicolina en pacientes con TCE tratados en el hospital Wiener Neustadt. En un análisis de subgrupos retrospectivo, compararon a 67 pacientes en el sitio del estudio tratados con citicolina (3 g/día/3 semanas por vía intravenosa) y a 67 pacientes emparejados de otros centros austríacos no tratados con citicolina. Se incluyó a pacientes con TCE de moderado a grave. El análisis encontró un efecto significativo de la citicolina, expresado por la reducción de las tasas de mortalidad en la unidad de cuidados intensivos (5% frente a 24%; p < 0,01), durante la estancia hospitalaria (9% frente a 24%; p = 0,035), y a los 6 meses de seguimiento (13% frente a 28%; p = 0,031). También se detectó una reducción significativa en las tasas de resultado desfavorable (34% frente a 57%; p = 0,015) y en la razón de mortalidad observada frente a la esperada (0,42 frente a 0,84) en el grupo de citicolina (Fig. 22). Ahmadi et al [488] publicaron un ensayo clínico aleatorizado, doble ciego, en 30 pacientes con TCE grave. De acuerdo con el protocolo IRCT20140611018063N7 y el resumen, los pacientes se dividieron aleatoriamente en tres grupos: A (control), B (citicolina 0,5 g/12 horas/24 días por vía intravenosa) y C (citicolina 1,5 g/12 horas/14 días por vía intravenosa), pero una vez que los autores explicaron los métodos en el artículo, estos grupos cambiaron a: A (citicolina 0,5 g/12 horas/24 días por vía intravenosa), B (citicolina 1,5 g/12 horas/14 días por vía intravenosa) y C (placebo). Esta incongruencia dificulta la interpretación de los resultados, porque si la asignación del grupo era la original, entonces se puede encontrar un efecto dependiente de la dosis significativo de la citicolina, pero con la asignación establecida en el artículo, los resultados son difíciles de interpretar, pero los autores concluyeron que la citicolina no tuvo un efecto positivo en el resultado de dichos pacientes.
Figura 22. Efecto del tratamiento con citicolina sobre las tasas de mortalidad y desenlaces desfavorables. UCI: unidad de cuidados intensivos.
En estos últimos años, se han publicado nuevos estudios que ha encontrado un efecto significativo de la citicolina en la recuperación de los pacientes con TCE graves [489], especialmente en pacientes con lesión axonal difusa [490-492].
Como conclusión final, podríamos decir que ha quedado demostrado que los pacientes afectos de TCE (especialmente los que presentan una puntuación en la escala de coma de Glasgow inicial de 5-7) se benefician de la incorporación de la citicolina al esquema terapéutico, ya que consiguen acelerar la reabsorción del edema cerebral y la recuperación (tanto de la conciencia como de los trastornos neurológicos), lo que se traduce en una menor estancia hospitalaria y en una mejor calidad de la supervivencia, con un mayor grado de independencia. Agarwal y Patel [493], en su revisión sistemática sobre el papel de la citicolina en el tratamiento de pacientes con TCE, concluyeron que los resultados funcionales mejoraron significativamente con la citicolina en estos pacientes. Estos efectos se ven refrendados por las características farmacodinámicas del producto y su efecto pleiótropo sobre los mecanismos involucrados en el desarrollo de la lesión cerebral traumática [494,495]. Además, están disponibles dos revisiones recientes completas sobre el papel de la citicolina en el tratamiento de pacientes con TCE [496,497].
Patología vascular cerebral aguda y secuelas
Los procesos neurobiológicos implicados en la isquemia cerebral son extremadamente complejos [498], por lo que actualmente se plantea la posibilidad de utilizar tratamientos multifuncionales para abordar esta patología [499-504], las hemorragias intracerebrales [505,506] y las secuelas de éstas [507, 508]. Como hemos visto experimentalmente, la citicolina es un fármaco con unas acciones pleiótropas, que implican la activación del metabolismo neuronal, la estabilización de las membranas neuronales y de su función, así como la normalización de la neurotransmisión [20,39-41,180, 81,282]. En los años sesenta se realizaron diversos estudios con citicolina en los que se atisbó su eficacia para reducir la sintomatología neurológica en pacientes con isquemia cerebral [509,510].
Hazama et al [511] realizaron un estudio doble ciego a fin de evaluar el efecto de citicolina en la recuperación funcional de la hemiplejia en 165 pacientes afectos de patología vascular cerebral. Estos autores demostraron que la citicolina, en dosis de 1.000 mg/día durante ocho semanas, era superior al placebo, especialmente en la recuperación motora de las extremidades superiores, y concluyeron que este fármaco promueve la recuperación natural de la hemiplejía.
Goas et al [512] realizaron un estudio doble ciego comparativo de citicolina (750 mg/día/10 día por vía intravenosa) frente a placebo en 64 pacientes con infarto cerebral de menos de 48 horas de evolución. En la valoración a los tres meses se pudo comprobar que la citicolina era superior al placebo en la mejoría del déficit motor (p < 0,05), la hipertonía (p < 0,03), la recuperación de la marcha (p < 0,02), la evolución del trazado electroencefalográfico (p < 0,01) y la de los test psicométricos (p < 0,05), consiguiendo un mayor número de estados independientes (el 51,6% con la citicolina; el 24,24% con el placebo) (Fig. 23). En un estudio de las mismas características, Boudouresques et al [513] consiguieron resultados similares. En este estudio se incluyó a 52 pacientes, de los que 27 recibieron citicolina (750 mg/día/10 día por vía intravenosa), y 25, placebo. La valoración se hizo a los 10 días y se pudo comprobar que los pacientes tratados con citicolina tuvieron una mejor evolución de los trastornos de conciencia, con recuperación de ésta en el 66,7% de los casos, en comparación con el 32% del grupo placebo (p < 0,01), así como de los síndromes deficitarios (el 82,6% de pacientes recuperados con citicolina frente al 54.5% con placebo; p < 0,04) y del trazado electroencefalográfico (el 83,3% con citicolina frente al 35,3% con placebo; p < 0,01). En ambos estudios, la tolerancia a la citicolina se catalogó de excelente por los investigadores.
Figura 23. Resultado final conseguido en función del tratamiento recibido. Destaca el mayor número de buenos resultados obtenidos con citicolina, en comparación con el grupo control.

Corso et al [514], en un estudio doble ciego de citicolina (1 g/día/30 día por vía intravenosa) frente a placebo en una muestra de 33 pacientes, observaron que, al final del estudio, el 76,5% de los pacientes tratados con citicolina había mejorado el síndrome deficitario (p < 0,01 respecto al placebo) y el 70,6% mostraba mejorías en el trazado del electroencefalograma (p < 0,01 respecto al placebo).
Tazaki et al [515] realizaron un estudio doble ciego, prospectivo, multicéntrico y controlado con placebo sobre la utilidad de la citicolina en el tratamiento del infarto cerebral en fase aguda. En este estudio participaron 63 centros académicos japoneses y se incluyó a un total de 272 pacientes, según unos estrictos criterios de inclusión. Los pacientes fueron distribuidos aleatoriamente para recibir 1 g/día por vía intravenosa de citicolina o de suero salino (placebo) durante 14 días. Al final del tratamiento se pudo comprobar que la citicolina conseguía mejorar de forma significativa la conciencia (el 51% frente al 33% para el placebo; p < 0,05) y las tasas de mejoría global (el 52% frente al 26%; p < 0,01) y de utilidad global (el 47% frente al 24%; p < 0,001). Por otro lado, en el grupo de pacientes tratado con citicolina se produjeron menos complicaciones (1%) que en el grupo del placebo (8,1%). Estos autores concluyen que la citicolina es un fármaco eficaz y seguro para el tratamiento del infarto cerebral en la fase aguda. Estos resultados coinciden con los obtenidos por otros autores [516-519].
Guillén et al [520] presentaron un estudio comparativo aleatorizado sobre la eficacia de la citicolina en el tratamiento de la fase aguda del ictus isquémico, frente a la terapéutica convencional, comprobando que la mejoría obtenida en el grupo de citicolina era significativamente superior que la del grupo control (p < 0,05). En los estudios abiertos de Bruhwyler et al [521] y de Fridman et al [522] también se han obtenido resultados favorables a la citicolina, con una significativa mejoría clínica de los pacientes, y destaca el excelente perfil de seguridad del fármaco. Alviarez y González [523] han notificado recientemente efectos positivos para la citicolina en un estudio doble ciego realizado en Venezuela. Asimismo, León-Jiménez et al [524], en un estudio retrospectivo realizado en México, han concluido que el uso de citicolina en pacientes con ictus isquémico agudo se asocia con un mejor resultado funcional.
En la segunda mitad de la década de los noventa, se inició el estudio de la citicolina en Estados Unidos para el tratamiento, por vía oral, del accidente vascular cerebral isquémico en fase aguda. El primer ensayo clínico fue un estudio aleatorio de dosis-respuesta [525]. En este estudio doble ciego, aleatorizado y multicéntrico, se compararon tres dosis de citicolina (500, 1.000 y 2.000 mg por vía oral) con placebo, para confirmar la seguridad del fármaco, determinar la dosis óptima y obtener datos de la eficacia de la citicolina en el tratamiento del accidente vascular cerebral isquémico agudo. Se incluyó a 259 pacientes con accidente vascular cerebral isquémico de territorio de la arteria cerebral media en las 24 horas siguientes al inicio de los síntomas. Se distribuyó aleatoriamente a los pacientes en cuatro grupos: administración de placebo o de 500, 1.000 o 2.000 mg/día de citicolina por vía oral, durante un período de seis semanas. Se valoró la recuperación de los pacientes al final del período de tratamiento de seis semanas y después de un período posterior de seguimiento de seis semanas más. La variable principal de eficacia fue el índice de Barthel (IB) a las 12 semanas. Como variables secundarias se analizó la escala de Rankin modificada (mRS), la escala de ictus del Instituto Nacional de la Salud (NIHSS), el Minimental State Examination (MMSE), la duración de la estancia hospitalaria y la mortalidad. Se observó una diferencia significativa entre los grupos, que era favorable a la citicolina, en relación con el estado funcional (IB y mRS), la valoración neurológica (NIHSS) y la función cognitiva (MMSE). En un análisis de regresión del IB incluyendo como covariable la puntuación basal de la NIHSS, se observó un efecto significativo del tratamiento con citicolina a las 12 semanas (p < 0,05). El porcentaje de pacientes que consiguieron obtener una puntuación entre 85 y 100 en el IB fue del 39,1% para el placebo, del 61,3% para la dosis de 500 mg, del 39,4% para la dosis de 1.000 mg y del 52,3% para la dosis de 2.000 mg. Las OR para una mejora del resultado fueron de 2 para la dosis de 500 mg y de 2,1 para la dosis de 2.000 mg. La falta de eficacia que se observó en el grupo de 1.000 mg podría deberse al mayor sobrepeso de los pacientes incluidos en este grupo y a su peor estado neurológico basal. La puntuación media en la mRS fue de 3,1 con placebo, 2,5 con 500 mg de citicolina, 3,1 con 1.000 mg y 2,6 con 2.000 mg, y la diferencia entre el grupo de 500 mg y el de placebo fue significativa (p < 0,03). No se observaron efectos adversos graves ni muertes relacionados con la citicolina. Según estos resultados, el tratamiento con citicolina por vía oral condiciona un mejor resultado funcional, y la dosis más eficaz es la de 500 mg.
En el siguiente estudio [526], también multicéntrico, doble ciego, controlado con placebo y aleatorizado, se incluyó a 394 pacientes con ictus isquémico agudo de origen en la arteria cerebral media, de menos de 24 horas de evolución y con una puntuación en la NIHSS superior o igual a 5. Se asignó a los pacientes a la administración por vía oral de placebo (n = 127) o de 500 mg/día de citicolina (n = 267). El tratamiento se mantuvo durante seis semanas y se efectuó un seguimiento ulterior durante seis semanas más. El tiempo medio de inclusión fue de 12 horas tras el ictus y la edad media fue de 71 años en el grupo placebo y de 71 años en el grupo de citicolina. Si bien la media de la puntuación basal de la NIHSS fue similar en ambos grupos, se encontró un mayor porcentaje de pacientes con una NIHSS basal <8 en el grupo placebo (34% frente a 22%; p < 0,01). La variable de valoración principal prevista (regresión logística para cinco categorías del IB) no cumplía la suposición de posibilidades proporcionales y no era, por tanto, fiable. No se observaron diferencias significativas entre grupos en ninguna de las variables secundarias planificadas, incluyendo IB superior o igual a 95 a las 12 semanas (placebo, 40%; citicolina, 40%) o la tasa de mortalidad (placebo, 18%, citicolina, 17%). Sin embargo, un análisis post hoc de subgrupos demostró que, en pacientes con ictus de intensidad moderada a grave, definidos por una NIHSS basal superior o igual a 8, el tratamiento con citicolina confería una mayor posibilidad de obtener una recuperación completa, definida por un IB ≥95 a las 12 semanas (21%, placebo; 33%, citicolina; p = 0,05), mientras que no se encontraron diferencias en pacientes con ictus de intensidad leve, es decir, con una puntuación basal en la NIHSS <8. No se detectaron efectos adversos graves atribuibles al fármaco, lo que redunda en su seguridad. Según estos datos, se podría pensar que la citicolina es un fármaco seguro y que puede producir efectos favorables en pacientes con ictus isquémico agudo de intensidad moderada a grave.
El último estudio clínico realizado en Estados Unidos ha sido el estudio ECCO 2000 [527]. En este estudio, con unas características similares a los anteriores, se incluyó a 899 pacientes con ictus isquémico agudo de intensidad moderada a grave (NIHSS basal ≥8), de origen en la arteria cerebral media y con una evolución de menos de 24 horas. Los pacientes fueron aleatorizados a recibir 2.000 mg/día de citicolina (n = 453) o placebo (n = 446) por vía oral durante seis semanas, con un seguimiento ulterior de seis semanas más. La variable principal del estudio fue el porcentaje de pacientes que al cabo de las 12 semanas presentaba una reducción de 7 puntos o más en la NIHSS. Al final del estudio, el 51% de los pacientes del grupo placebo y el 52% del grupo de citicolina habían conseguido la reducción de 7 puntos o más en la NIHSS, sin que existiesen diferencias significativas entre grupos. En cambio, se observó una tendencia favorable a la citicolina a obtener una recuperación neurológica completa, definida por una puntuación en la NIHSS inferior o igual a 1 (el 40% con citicolina frente al 35% con placebo; p = 0,056), y en la recuperación funcional completa, definida por una puntuación superior o igual a 95 en el IB (el 40% con citicolina frente al 35% con placebo; p = 0,108). En cuanto a la mRS, el 20% de los pacientes del grupo placebo consiguió una recuperación completa (mRS ≤1), en comparación con el 26% de pacientes del grupo de citicolina, y estas diferencias fueron estadísticamente significativas (p = 0,025). No hubo diferencias entre tratamientos en cuanto a mortalidad o incidencia de efectos adversos graves, si bien se observó una reducción significativa del empeoramiento del ictus (el 3% con citicolina frente al 6% con placebo; p = 0,02). Por otro lado, se redujo la incidencia de nuevos ictus en los pacientes tratados con citicolina (el 2,9% con placebo frente al 1,8% con citicolina), lo que supone una reducción del riesgo del 62,1%. En un análisis post hoc se valoró el efecto de la citicolina en una valoración global de múltiples resultados, utilizando el método de la Generalized Estimating Equations definido por Tilley et al [528], en el que se contempla el porcentaje de pacientes que consiguieron una recuperación completa en las tres escalas utilizadas, es decir, que obtuvieron una puntuación de 0-1 en la NIHSS, 0-1 en la mRS y ≥95 en el IB a las 12 semanas. Según este análisis, la citicolina se mostró significativamente superior al placebo y consiguió esta recuperación completa en el 19% de los casos, en comparación con el 14% del grupo placebo (OR 1,32; 1,03-1,69; p = 0,03).
De forma paralela, se ha investigado los efectos de la citicolina sobre el volumen del infarto cerebral. El primer análisis realizado fue un estudio piloto para valorar los efectos de la citicolina sobre el volumen lesional medido mediante resonancia magnética por difusión ponderada en pacientes con infarto cerebral agudo [529]. En este estudio se incluyó a 12 pacientes del primer estudio clínico de citicolina en Estados Unidos [525]. De los cuatro pacientes tratados con placebo, en tres casos se observó un crecimiento de la lesión, mientras que en siete de los ocho pacientes tratados con citicolina se observó una disminución del volumen lesional (p < 0,01, con la puntuación basal de la NIHSS como covariante). En un segundo estudio, doble ciego, diseñado para este fin, es decir, medir la evolución del volumen lesional mediante técnicas de difusión ponderada, se incluyó a 100 pacientes que fueron aleatorizados a recibir 500 mg/día de citicolina o placebo por vía oral durante seis semanas [530]. Estos pacientes debían ser incluidos dentro de las primeras 24 horas tras el inicio de los síntomas, tener una puntuación basal en la NIHSS de 5 puntos o más y un volumen lesional en la sustancia gris cerebral de 1-120 cm3 en la resonancia magnética por difusión ponderada. Las técnicas de neuroimagen (resonancia magnética de difusión ponderada, resonancia magnética en T2, resonancia magnética de perfusión ponderada y angiografía por resonancia magnética) se obtuvieron basalmente y las semanas 1 y 12. La variable primaria fue la progresión de la lesión isquémica desde la valoración basal a la valoración final a las 12 semanas, medida mediante resonancia magnética. El análisis primario previsto se pudo realizar en 41 pacientes tratados con citicolina y en 40 pacientes tratados con placebo, y no se obtuvieron diferencias significativas. Desde el inicio hasta las 12 semanas, el volumen de la lesión isquémica se expandió un 180 ± 107% en el grupo placebo y un 34 ± 19% en el grupo de citicolina. En un análisis secundario se demostró que, desde la semana 1 a la semana 12, se produjo un descenso del volumen lesional de 6,9 ± 2,8 cm3 en el grupo placebo y de 17,2 ± 2,6 cm3 con citicolina (p < 0,01). Un hallazgo importante de este estudio fue la gran correlación existente, indiferentemente del tratamiento, entre la reducción del volumen lesional y la mejoría clínica, lo que permite soportar la idea de utilizar esta metodología en la valoración de tratamientos para el ictus. Dentro del estudio ECCO 2000 [527], se realizó un subestudio para valorar los efectos de la citicolina sobre el volumen lesional [531]. En este subestudio se plantearon tres objetivos. El primer objetivo fue valorar los efectos del fármaco sobre el volumen de la lesión crónica mediante secuencias en T2 de resonancia magnética, en toda la muestra de pacientes, aunque sólo en 676 pacientes se pudo realizar esta valoración. El segundo objetivo fue analizar los efectos de la citicolina en el cambio de volumen de la lesión, mediante resonancia magnética con difusión ponderada realizada basalmente y en la semana 12. Para este segundo objetivo se incluyó a 181 pacientes, aunque sólo 134 fueron valorables. El tercer objetivo fue metodológico, es decir, se trataba de correlacionar los cambios clínicos con los cambios volumétricos y comprobar si la reducción del volumen lesional se asociaba a una mejoría clínica. No se encontraron diferencias significativas en la valoración del volumen lesional crónico (mediana de 25 cm3 para la citicolina; mediana de 31,3 cm3 para el placebo). En el estudio realizado mediante difusión ponderada se comprobó que, en el grupo placebo (n = 71), la lesión se incrementó un 30,1 ± 20,5%, con una mediana del –8,7%, mientras que el cambio que se produjo en el grupo de citicolina (n = 63) fue del 1,3 ± 14,3%, con una mediana del –22,9%, sin que se alcanzasen diferencias significativas (p = 0,077), aunque, cuando se analizó el logaritmo de cambio y se introdujo la puntuación basal de la NIHSS como covariante, estas diferencias sí que fueron significativas (p = 0,02). Se comprobó que, en este subestudio con difusión ponderada, el 54% de los pacientes del grupo placebo y el 67% de pacientes tratados con citicolina presentaban una reducción del volumen lesional en comparación con el volumen inicial, si bien estas diferencias no fueron significativas (p = 0,122). Si se analizaba a los pacientes que basalmente tenían una lesión cortical cuyo volumen estaba comprendido entre 1 y 120 cm3, se comprobó que en los pacientes tratados con placebo (n = 47) la lesión se incrementaba un 40,5 ± 28,7%, con una mediana del 4,5%, mientras que en los pacientes que habían recibido tratamiento con citicolina (n = 43) la lesión se incrementó un 7,3 ± 19,9%, con una mediana del –23,9%, y las diferencias entre grupos fueron estadísticamente significativas (p = 0,006, comparación de medianas). En este subgrupo de pacientes con lesiones iniciales corticales con volumen de 1-120 cm3 se produjo una reducción del volumen lesional en el 47% de los pacientes del grupo placebo y en el 70% de los pacientes del grupo citicolina, y estas diferencias fueron significativas con una p = 0,028. Asimismo, se comprobó que la disminución de volumen se correlacionó significativamente con la mejoría clínica de los pacientes.
Aunque los resultados obtenidos en los estudios realizados en Estados Unidos con citicolina oral para el tratamiento del ictus isquémico agudo no fueron concluyentes en cuanto a su eficacia, se puede observar que, además de la seguridad del fármaco, existe una cierta tendencia a mejorar el pronóstico de los pacientes tratados. Dado que hasta ese momento no existía ningún fármaco neuroprotector que hubiese demostrado eficacia en el tratamiento de esta patología tan grave [532], se decidió realizar un metaanálisis de los resultados obtenidos con citicolina por vía oral en el tratamiento del ictus isquémico agudo para analizar los efectos del fármaco sobre la recuperación neurológica y funcional de los pacientes [533]. Para ello, y siguiendo la sistemática de la Cochrane Library [534] y la normativa de la International Conference of Harmonization [535], se realizó una búsqueda bibliográfica exhaustiva, tanto en Medline como en nuestra propia base de datos bibliográfica, que detectó que sólo existían cuatro estudios clínicos doble ciego y aleatorizados realizados con citicolina por vía oral en el tratamiento del ictus isquémico agudo, que corresponden a los cuatro ensayos realizados en Estados Unidos [525-527,529]. La muestra total de pacientes fue de 1.652, con 686 pacientes en el grupo placebo y 966 en el grupo de citicolina (381 con 500 mg/día, 66 con 1.000 mg/día y 519 con 2.000 mg/día). El primer análisis se hizo independientemente de la dosis y en la muestra total de pacientes. En cuanto a la recuperación neurológica completa (NIHSS ≤1) a los tres meses, la OR fue 1,22 (0,98-1,52), que no alcanzó la significación estadística (p = 0,07); en cambio, si se obtuvieron diferencias significativas favorables a la citicolina al analizar los pacientes que conseguían una recuperación prácticamente total en las actividades de la vida diaria (IB ≥95) a los tres meses –OR, 1,26 (IC 95%, 1,02-1,55); p = 0,01–, y la recuperación funcional a los tres meses, definida como una puntuación menor o igual a 1 en la mRS –OR, 1,36 (IC 95%, 1,06;1,74); p = 0,01–. Dado que la experiencia obtenida en los estudios clínicos referenciados nos dice que el fármaco va mejor en los pacientes con ictus isquémico agudo de intensidad moderada a grave (NIHSS basal ≥8), se obtuvieron las bases de datos de los estudios originales y se procedió a seleccionar a los pacientes que cumpliesen esta premisa y un estado funcional óptimo previo al ictus (mRS ≤1). Del total de pacientes, 1.372 cumplían estos criterios y con ellos se realizó la misma valoración. En este caso, el metaanálisis encontró diferencias estadísticamente significativas para todas las variables analizadas (Tabla VIII).
Tabla VIII. Resultados obtenidos a los tres meses en las escalas individuales.
|
| |
N.º de estudios
|
N.º de pacientes
|
Odds ratio de Peto (IC 95%)
|
p
|
NIHSS ≤ 1
|
4
|
1.372
|
1,34 (1,05-1,71)
|
0,020
|
mRS ≤ 1
|
4
|
1.351
|
1,45 (1,11-1,90)
|
0,007
|
IB ≥ 95
|
4
|
1.372
|
1,28 (1,03-1,59)
|
0,003
|
IB: índice de Barthel; IC 95%: intervalo de confianza del 95%; mRS: escala de Rankin modificada; NIHSS: escala de ictus del Instituto Nacional de la Salud.
|
Para proseguir el análisis de estos datos, se decidió realizar un análisis de datos agrupados [536], disponiendo de los datos individuales de cada paciente. En este nuevo análisis se incluyó la muestra de 1.372 pacientes, que cumplían los criterios establecidos de gravedad (NIHSS basal ≥8), estado funcional previo (mRS ≤1), ventana terapéutica no superior a 24 horas y neuroimagen compatible. La variable de eficacia que se eligió fue la recuperación total a los tres meses en las tres escalas analizadas (mRS ≤1 + NIHSS ≤1 + IB ≥95), utilizando el análisis de la Generalized Estimating Equations anteriormente descrito [527]. De los 1.372 pacientes, 583 recibieron placebo y 789 citicolina (264 pacientes con 500 mg, 40 con 1.000 mg y 485 con 2.000 mg). La recuperación total a los tres meses se obtuvo en el 25,2% de los pacientes tratados con citicolina y en el 20,2% de pacientes del grupo placebo –OR, 1,33 (IC 95%, 1,1-1,62); p = 0,003– y la dosis que demostró ser más eficaz fue la de 2000 mg, con un 27,9% de los pacientes que recibieron esta dosis recuperados totalmente a los tres meses –OR, 1,38 (IC 95%, 1,1-1,72); p = 0,004– (Fig. 24). Además, la seguridad de la citicolina fue similar a la del placebo.
Figura 24. Probabilidades estimadas –análisis GEE (Generalized Estimating Equations)– de recuperación global a los tres meses del inicio de los síntomas. La recuperación global se define como una diferencia consistente y persuasiva en la proporción de pacientes que consiguen puntuaciones de escala de ictus del Instituto Nacional de la Salud ≤ 1, índice de Barthel ≥ 95 y escala de Rankin modificada ≤ 1 al mismo tiempo.

En 2002 se comunicaron los resultados preliminares de una revisión Cochrane sobre los efectos de los precursores de la colina, como la citicolina, en el tratamiento del ictus agudo y subagudo [537]. En este metaanálisis se recopilaron los datos de ocho estudios doble ciego realizados con citicolina, con dosis que oscilaban entre 500 y 2.000 mg al día, con administración tanto por vía oral como por vía intravenosa. A pesar de la heterogeneidad entre los estudios, el tratamiento con citicolina se asoció a una reducción en las tasas de mortalidad e incapacidad tardías: citicolina 611/1.119 (64,6%) frente a placebo 561/844 (54,4%) –OR, 0,64 (IC 95%, 0,53-0,77); p < 0,00001–. Para disminuir la heterogeneidad, se restringió el análisis a los cuatro estudios con mayor tamaño muestral (n > 100), manteniéndose el efecto positivo observado: citicolina 574/1048 (54,58%) frente a placebo 500/773 (64,7%) –OR, 0,7 (IC 95%, 0,58-0,85); p = 0,0003–. En el análisis de seguridad se comprobó que no había diferencias entre la citicolina y el placebo en cuanto a la tasa de mortalidad. Los autores concluyen que el metaanálisis formal de los estudios con citicolina en el ictus agudo y subagudo sugiere un efecto beneficioso y sustancial del fármaco, con reducciones absolutas del 10-12% en la tasa de incapacidad y mortalidad a largo plazo, es decir, se reduce significativamente el número de pacientes con una puntuación de 3 o más en la mRS. Estos resultados concuerdan con los expuestos anteriormente en relación con el análisis de datos agrupados [536].
También se dispone de un análisis de datos agrupados que evaluó el efecto de la citicolina en el crecimiento del tamaño del infarto cerebral [538]. Los datos utilizados en este análisis provienen de dos estudios con datos disponibles de neuroimagen utilizando técnicas de resonancia magnética [527, 530]. La variable principal de este análisis fue el cambio porcentual del tamaño del infarto desde el inicio del estudio hasta su final, a los tres meses. Se disponía de datos de 111 pacientes que recibieron placebo, 41 pacientes tratados con citicolina 500 mg/día/6 semanas y 62 pacientes tratados con citicolina 2.000 mg/día/6 semanas. Los pacientes que habían recibido placebo presentaron un incremento promedio del 84,7 ± 41,2%, mientras que se observó un efecto dependiente de la dosis asociado a la citicolina: incremento promedio del 34 ± 18,5% con citicolina 500 mg y del 1,8 ± 14,5 con citicolina 2.000 mg.
Estos efectos beneficiosos demostrados en estas revisiones sistemáticas, además, se asocian a una reducción de los costes del tratamiento integral del paciente con ictus isquémico agudo [539], incluso en Rusia [540,541].
Se ha comunicado que uno de los mecanismos que podría estar implicado en el efecto beneficioso de la citicolina en los pacientes con ictus isquémico agudo sería el incremento de células progenitoras endoteliales circulantes [542], lo que representaría un novedoso mecanismo de acción del fármaco.
En un estudio postautorización realizado en Corea del Sur [543], 4.191 pacientes con ictus agudo fueron tratados con citicolina, de acuerdo con el esquema de tratamiento aprobado en Corea, y se confirmó el efecto del fármaco en la evolución de los pacientes, así como su seguridad.
Se ha publicado un estudio piloto sobre la seguridad y la eficacia de la citicolina en el tratamiento de la hemorragia intracerebral primaria [544]. En este estudio se incluyó a 38 pacientes con edades comprendidas entre 40 y 85, que debían ser independientes previamente y ser incluidos dentro de las seis horas siguientes al inicio de los síntomas causados por la hemorragia intracerebral primaria, diagnosticada por neuroimagen (tomografía computarizada o resonancia magnética). Los pacientes debían tener una gravedad basal determinada por una puntuación superior a 8 en la escala de coma de Glasgow y superior a 7 en la NIHSS. Los pacientes se aleatorizaron para recibir 1 g/12 horas de citicolina o placebo por vía por vía intravenosa u oral durante dos semanas. El objetivo primario del estudio fue evaluar la seguridad del tratamiento, según la aparición de acontecimientos adversos. Como variable de eficacia se escogió el porcentaje de pacientes que a los tres meses tenían una puntuación de 0-2 en la mRS. Se incluyó a 19 pacientes en cada grupo, y ambos grupos fueron perfectamente comparables en función de sus características basales. La incidencia de acontecimientos adversos no fue diferente entre ambos grupos (cuatro casos en cada uno). En cuanto a la eficacia, un paciente del grupo placebo fue catalogado como independiente (mRS <3) en comparación con cinco pacientes en el grupo de citicolina (OR, 5,38; IC 95%, 0,55-52, n.s.). Como conclusión, se puede adelantar que la citicolina parece ser un fármaco seguro en pacientes con hemorragia intracerebral primaria, lo que puede permitir su administración en pacientes con clínica sugestiva de accidente vascular cerebral previamente a la realización de la neuroimagen, lo que supondría un adelanto en el tiempo de administración del fármaco. En cuanto a su eficacia, los datos obtenidos son muy prometedores, aunque se deberían confirmar en un estudio de mayor tamaño. Se ha comunicado el resultado final de un estudio doble ciego realizado en Filipinas (estudio RICH) [545] en pacientes con hemorragia cerebral que recibieron citicolina 4 g /día/14 día por vía intravenosa o placebo. A los 90 días se comprobó una mejor evolución de los pacientes, según la mRS y el IB, que recibieron tratamiento con citicolina. La seguridad del fármaco volvió a mostrarse muy satisfactoria. Además, se ha comunicado un efecto beneficioso en el tratamiento de las secuelas en pacientes con hemorragia cerebral [546]. Con estos resultados, parece que la citicolina puede tener un lugar en el tratamiento de pacientes con hemorragia intracerebral [547,548] y en la hemorragia subaracnoidea [549]. Zhu [550] investiga la eficacia clínica de la citicolina y el oxiracetam en pacientes con hemorragia cerebral y concluye que esta combinación terapéutica puede promover de manera efectiva la absorción del hematoma, y mejorar el resultado y la calidad de vida de este tipo de pacientes.
En un nuevo metaanálisis publicado recientemente por Saver [551,552], en el que se reúnen todos los estudios doble ciego realizados con citicolina en patología cerebrovascular aguda, se vuelve a sugerir el efecto beneficioso del fármaco al evidenciar la reducción de la dependencia a largo plazo (Fig. 25).
Figura 25. Mortalidad e incapacidad a largo plazo. Gráfico Forest del metaanálisis del efecto de la citicolina frente a control en estudios con pacientes con infarto cerebral, hemorragia intracerebral e ictus sin confirmación del subtipo con neuroimagen. C010: estudio 010 de citicolina; CSSG: Grupo de Estudio de Citicolina en Ictus (Citicoline Stroke Study Group); df: grados de libertad; Fixed: modelo de efectos fijos; IC: intervalo de confianza; M-H: estimador de Mantel-Haenszel. Con permiso de J.L. Saver. Citicoline: update on a promising and widely available agent for neuroprotection and neurorepair. Rev Neurol Dis 2008; 5: 167-77.

Se han comunicado diversas experiencias sobre el uso de citicolina en pacientes con ictus agudos en diversas partes del mundo [553-563], incluso en asociación con otros neuroprotectores [564].
Entre 2006 y 2012, se realizó en Europa el estudio ICTUS [565-568] para corroborar los datos de eficacia obtenidos con citicolina en las circunstancias actuales. Se trataba de un estudio aleatorizado, doble ciego, controlado por placebo y basado en un modelo secuencial en pacientes con ictus isquémico agudo moderado a grave, que se realizó en hospitales universitarios de España, Portugal y Alemania. Los pacientes fueron aleatorizados, mediante un proceso centralizado de minimización, a recibir citicolina o placebo en las primeras horas tras el inicio de los síntomas –1.000 mg/12 horas por vía intravenosa durante los tres primeros días y luego por vía oral hasta completar las seis semanas de tratamiento (2 × 500 mg/12 horas)–. Todos los pacientes fueron enmascarados. La variable principal fue la recuperación a los 90 días medida con un test global combinando tres medidas de éxito: NIHSS ≤1, mRS ≤1 e IB ≥95 [567]. Las variables de seguridad incluyeron la aparición de hemorragia intracraneal sintomática en pacientes tratados con rTPA, el deterioro neurológico y la mortalidad. El estudio fue registrado, NCT00331890. Reclutaron pacientes 37 centros en España, 11 en Portugal y 11 en Alemania. De los 2.298 pacientes que dieron su consentimiento y fueron aleatorizados, 1.148 recibieron tratamiento con citicolina y 1.150 con placebo. El estudio se detuvo por futilidad en el tercer análisis intermedio, basado en los datos completos de 2.078 pacientes. El análisis aleatorio final se basó en datos de 2.298 pacientes: 1.148 en el grupo de citicolina y 1.150 en el grupo placebo. La recuperación global fue similar en ambos grupos (OR, 1,03; IC 95%, 0,86-1,25; p = 0,364). No se observaron diferencias en las variables de seguridad ni en la incidencia de efectos adversos. Por lo tanto, bajo las circunstancias del estudio ICTUS, la citicolina no muestra eficacia en el tratamiento de pacientes con ictus isquémico agudo moderado a grave. Cuando se pusieron en contexto los resultados obtenidos con los datos previos, la interpretación del estudio fue que, cuando se añade citicolina al mejor tratamiento posible del ictus isquémico (tratamiento muy precoz, tratamiento en unidades de ictus certificadas y tratamiento con rTPA), no se muestra ninguna mejoría clínica, pero, como se muestra en un metaanálisis incluido el artículo original, el efecto del fármaco permanece significativo (OR, 1,14; IC 95%, 1-1,3]. Se especuló con la posibilidad de que la eficacia de la citicolina se haya ido diluyendo a lo largo del tiempo, en paralelo con la mejoría de los tratamientos estándar aplicados a pacientes con ictus isquémico agudo. Un punto que cabe considerar para la interpretación de los resultados es que más del 46% de los pacientes recibió tratamiento con rTPA. Por lo tanto, las guías clínicas se deberían actualizar en vista de los resultados de este estudio [569].
Un nuevo metaanálisis se ha publicado [570] con el objetivo de valorar si comenzando el tratamiento con citicolina en los 14 días tras el inicio del ictus mejora el resultado, medido como una puntuación de 0-2 en la mRS o equivalente, en pacientes con ictus isquémico agudo en comparación con placebo. Adicionalmente, se exploró si el efecto de la citicolina se ha ido diluyendo a lo largo del tiempo en paralelo a la mejoría del tratamiento estándar de este tipo de pacientes. Se realizó una búsqueda sistemática, con los términos adecuados, en Medline, PubMed, Embase, Cochrane Specialised Register of Clinical Trials, Clinicaltrials.gov, Internet Stroke Center y la base de datos bibliográfica de Ferrer para identificar todos los estudios clínicos publicados, sin factores de confusión, aleatorizados, doble ciego y controlados por placebo de citicolina en pacientes con ictus isquémico agudo. Diez estudios clínicos (n = 4.436, pero sólo 4.420 fueron válidos para el análisis) cumplieron los criterios de inclusión y calidad necesarios. En estos estudios, la citicolina se usó en dosis entre 500 y 2.000 mg diarios administrados por vía oral y/o intravenosa. Se detectó una heterogeneidad significativa entre los estudios, que reflejaba el desfase temporal de 32 años entre los estudios incluidos en el metaanálisis. La administración de citicolina se asoció con una mayor tasa de independencia (Fig. 26), independientemente del método de valoración empleado (OR, 1,56; IC 95%, 1,12-2,16 bajo efectos aleatorios; OR, 1,2; IC 95%, 1,06-1,36 bajo efectos fijos). Los resultados obtenidos en el subgrupo de pacientes no tratados con rTPA (OR, 1,63; IC 95%, 1,18-2,24 bajo efectos aleatorios; OR, 1,42; IC 95%, 1,22-1,66 bajo efectos fijos) y los resultados en pacientes no tratados con rTPA que recibieron la dosis más alta de citicolina (2 g/día/6 semanas) iniciada en las primeras 24 horas tras el inicio de los síntomas (OR, 1,27; IC 95%, 1,05-1,53) demostraron que, efectivamente, el efecto de la citicolina se ha ido diluyendo a lo largo del tiempo en paralelo con la mejoría del tratamiento estándar. En conclusión, en esta revisión sistemática se comprueba el beneficio de la administración de citicolina en la fase aguda del ictus isquémico agudo, incrementando el número de pacientes independientes, si bien este efecto se ve reducido en pacientes tratados con rTPA. Yu y Zelterman [571], utilizando un nuevo método de metaanálisis paramétrico, confirmaron los resultados informados en este metaanálisis. Sanossian y Saver [572] replicaron nuestro metaanálisis anterior y concluyeron que el tratamiento con citicolina se asoció con una mayor frecuencia de independencia funcional en el seguimiento a largo plazo, el 36,4% frente al 31,6%, con un OR de 1,2 (IC 95%, 1,05-1,55) y p = 0,02. Agarwal y Patel [493], en su revisión sistemática sobre el papel de la citicolina en el tratamiento de pacientes con accidente cerebrovascular isquémico agudo, concluyeron que los resultados funcionales mejoraron significativamente con la citicolina en estos pacientes. No obstante, en otro metaanálisis basado en estudios publicados en chino e inglés, por lo tanto, con un mayor riesgo de sesgo, estos resultados no se han corroborado [573], resultados similares a los obtenidos por Pinzón y Sanyasi [574]. Martí-Carvajal et al [575] publicaron una controvertida revisión Cochrane sobre el uso de citicolina en el tratamiento del accidente cerebrovascular isquémico agudo. Concluyeron que los hallazgos de la revisión sugieren que puede haber poca o ninguna diferencia entre la citicolina y sus controles con respecto a la mortalidad por todas las causas, la discapacidad o la dependencia en las actividades diarias, los eventos adversos graves, la recuperación funcional y la evaluación de la función neurológica, según evidencia de certeza baja. Los ‘problemas’ más relevantes con esta revisión fueron: los autores también fueron los revisores, la selección de los ensayos estuvo sesgada e incompleta, y algunos de los comentarios incluidos en la revisión no eran ciertos, como cuando los autores mencionan que ‘la citicolina ha sido prohibida en Estados Unidos y Canadá’, cuando se comercializa en Estados Unidos como alimento médico.
Figura 26. Estimación del efecto e intervalos de confianza al 95% (IC 95%) de la intervención con citicolina en las tasas de independencia (mRS de 0-2 o equivalente) en comparación con placebo en pacientes con ictus isquémico agudo. Con permiso de J.J. Secades, et al. Citicoline for acute ischemic stroke: a systematic review and formal meta-analysis of randomized, double-blind, and placebo-controlled trials. J Stroke Cerebrovasc Dis 2016; 25: 1984-96.
yle="text-align:center">

Touré et al [576], en un estudio realizado en Senegal, confirmaron la eficacia de la citicolina en el tratamiento de pacientes con ictus agudo, reflejada en una mejora del resultado funcional. Charán et al [577] realizaron un estudio comparativo de citicolina frente a hidrolizado de cerebroproteína en pacientes con accidente cerebrovascular isquémico y hemorrágico, y concluyeron que ambos tratamientos tienen una eficacia similar. Kobets [578] confirma la eficacia de la citicolina en el manejo del accidente cerebrovascular isquémico agudo. Sergeev et al [579] concluyeron que el efecto máximo de la citicolina se observa cuando se administra lo antes posible después del inicio del accidente cerebrovascular en pacientes que no son elegibles para la terapia de reperfusión. Seifaddini et al [580] concluyeron que la prescripción de citicolina para el tratamiento del accidente cerebrovascular isquémico agudo está asociada con cambios hemodinámicos en las arterias cerebrales y que este hallazgo puede ser uno de los mecanismos de acción de la citicolina en el proceso de accidente cerebrovascular isquémico. Mehta et al [581] realizaron un estudio prospectivo, de centro único, simple ciego y hospitalario con el propósito de evaluar la eficacia de la citicolina, la edaravona, la minociclina y la cerebrolisina en comparación con placebo en pacientes con un infarto cerebral en el territorio de la arteria cerebral media. con 20 pacientes en cada grupo. Hubo una mejora significativa en el resultado funcional de los pacientes con accidente cerebrovascular isquémico agudo que involucra el territorio de la arteria cerebral media a los 90 días que recibieron citicolina, edaravona y cerebrolisina. Sin embargo, la minociclina no ofreció la misma eficacia en comparación con otros agentes neuroprotectores. Diana et al [582] investigaron la mejora motora en pacientes con accidente cerebrovascular isquémico agudo en el hospital Siti Khodijah Sepanjang en un estudio observacional retrospectivo de casos y controles, y concluyeron que la citicolina 500 mg/día/5 días mejoró significativamente la función motora en pacientes con accidente cerebrovascular isquémico agudo. Kuryata et al [583] realizaron un estudio para estimar los efectos del tratamiento con citicolina sobre los niveles de marcadores de proteínas neuroespecíficas circulantes en el suero de pacientes con accidente cerebrovascular isquémico y fibrilación auricular. Los resultados obtenidos permiten a los autores plantear la hipótesis de que el beneficio terapéutico de la citicolina en pacientes con accidente cerebrovascular isquémico y fibrilación auricular puede estar mediado por el aumento de la viabilidad neuronal, la protección contra la lesión axonal, la disminución del nivel de astrogliosis reactiva, la prevención de deficiencias en la integridad hematoencefálica y la reducción de la intensidad de la desmielinización. Mazaheri et al [584] investigan la eficacia de la citicolina en pacientes con accidente cerebrovascular agudo en un ensayo clínico aleatorizado en 160 pacientes con accidente cerebrovascular hemorrágico e isquémico. Los participantes fueron asignados aleatoriamente a dos grupos de intervención y control. El grupo de intervención recibió diariamente inyecciones de 1 g de citicolina durante 10 días, además de la terapia estándar. Independientemente del tipo de accidente cerebrovascular, la gravedad de la enfermedad disminuyó con el tiempo en ambos grupos. Sin embargo, al final del estudio (el día 90.º), el grupo de intervención tenía una menor gravedad de la enfermedad, en comparación con el grupo control (p < 0,05). En cuanto a los pacientes con accidente cerebrovascular isquémico, la gravedad de la enfermedad fue significativamente menor en el grupo de intervención en el día 90.º en comparación con el grupo control. Según los autores, la administración a largo plazo de citicolina podría tener un impacto significativo en el tratamiento de los pacientes, especialmente aquellos con accidente cerebrovascular isquémico, y mejorar su eficacia.
Agarwal et al [585] publicaron un estudio piloto para determinar si la administración de citicolina inmediatamente después de la terapia de recanalización para un accidente cerebrovascular isquémico agudo mejoraría el resultado clínico y radiológico a los tres meses en comparación con el tratamiento estándar solo. Reclutaron a participantes con accidente cerebrovascular isquémico agudo sometidos a terapia de recanalización y los asignaron aleatoriamente para recibir citicolina o placebo en una proporción de 1:1. Los pacientes del grupo de citicolina recibieron citicolina 1 g dos veces al día por vía intravenosa durante tres días, seguido de citicolina oral 1 g dos veces al día durante 39 días. Los pacientes del brazo de placebo recibieron 100 mL de solución salina normal por vía intravenosa durante tres días, seguidos de tabletas multivitamínicas dos veces al día durante 39 días. Los autores no encontraron ninguna diferencia significativa entre los brazos de citicolina o placebo con respecto a los resultados primarios o secundarios. Las razones del fracaso incluyeron:
- El efecto techo de máximo beneficio logrado por trombólisis y mecánica y trombectomía.
- El poder estadístico bajo del estudio (tamaño de muestra pequeño) para detectar una diferencia significativa en los resultados funcionales.
- El estudio no pudo alcanzar el tamaño de muestra planificado, lo que provocó una reducción en el poder con posibilidad de error de tipo 2.
- Incluso para el resultado sustituto del volumen sistólico no fue posible alcanzar el tamaño de la muestra debido al reclutamiento deficiente durante la pandemia de COVID-19.
- Otra razón podría ser que el accidente cerebrovascular lacunar fue el subtipo de accidente cerebrovascular común en el estudio.
Premi et al [586], en un estudio experimental piloto, aleatorizado, simple ciego, evaluaron si el tratamiento con citicolina era capaz de restaurar las medidas de excitabilidad intracortical, evaluadas a través de protocolos de estimulación magnética transcraneal, en pacientes con accidente cerebrovascular isquémico agudo. Los autores concluyen que el tratamiento de ocho semanas con citicolina después de un accidente cerebrovascular isquémico agudo puede restaurar las medidas de excitabilidad intracortical, que depende en parte de la transmisión colinérgica.
Abou Zaki y Lokin [587] comunicaron un metaanálisis que tiene como objetivo evaluar el grado de efecto y seguridad de los neuroprotectores citicolina, cerebrolisina, edaravona y MLC601 (NeuroAid) en la recuperación de pacientes con infartos cerebrales. El análisis mostró que el resultado de los pacientes con accidentes cerebrovasculares isquémicos agudos mejoró significativamente cuando recibieron neuroprotectores frente a placebo (OR, 0,29; IC 95%, 0,09-0,5). Según los autores, este estudio respalda el uso de neuroprotectores en pacientes con accidentes cerebrovasculares isquémicos agudos que no pueden recibir trombólisis o trombectomía para mejorar los resultados funcionales a largo plazo y, en última instancia, la calidad de vida.
En la fase de rehabilitación, se ha demostrado que cuando se añade citicolina a la rehabilitación motora se obtienen mejores resultados que con la rehabilitación sola en la recuperación de la función motora [511,546,588,589]. En un metaanálisis publicado, se muestra cómo añadiendo citicolina al programa de rehabilitación motora se mejora la función motora en las extremidades superiores [590], lo que demuestra que el producto desempeña un papel relevante en la neurorrehabilitación [591]. Mushba et al [592] evaluaron el efecto de la citicolina sobre la eficacia de las medidas de rehabilitación en pacientes con accidente cerebrovascular isquémico y concluyeron que la citicolina mejora significativamente la función cognitiva, lo que a su vez tiene un efecto positivo sobre la eficacia de la remediación e indirectamente mejora la perfusión cerebral medida con tomografía computarizada por emisión de fotón único en pacientes con ictus isquémico hemisférico. Kostenko y Petrova [593] presentaron los resultados de su propia observación del uso de citicolina en el programa complejo de rehabilitación médica de pacientes después de un accidente cerebrovascular isquémico y describieron que la alta eficiencia de la aplicación de la citicolina en la rehabilitación compleja de pacientes en el período de recuperación temprana del ictus isquémico se manifiesta en forma de mejora de la función de la marcha, y aumento de la independencia funcional, la actividad diaria y la calidad de vida. Szelenberger et al [594] postulan la citicolina entre las intervenciones farmacológicas para mejorar la autorreparación del cerebro y la recuperación del accidente cerebrovascular. Singh et al [595] realizaron un estudio prospectivo para probar el papel de la citicolina en pacientes con accidente cerebrovascular en términos de cognición, memoria y discapacidad posterior al accidente cerebrovascular. Los pacientes recibieron un placebo (n = 40) o 500 mg/12 horas de citicolina (n = 35) durante 12 semanas (por vía oral o intravenosa). La citicolina muestra efectos beneficiosos en el accidente cerebrovascular en términos de cognición, memoria y discapacidad posterior al accidente cerebrovascular. Alizadeh et al [596] demostraron que la citicolina es un fármaco más útil para mejorar las habilidades del habla y el lenguaje que el piracetam en la afasia posterior al accidente cerebrovascular. Shulginova et al [597] describieron el papel de la citicolina sola o en combinación con otros fármacos en pacientes con isquemia cerebral crónica con trastornos del estado inmunitario.
Corallo et al [598] realizaron una revisión narrativa para investigar si la terapia antidepresiva, incluido el uso de inhibidores selectivos de la recaptación de serotonina, inhibidores de la recaptación de la serotonina y la norepinefrina, y fármacos de apoyo (es decir, citicolina o alfoscerato de colina), como sustituto para la terapia antidepresiva, reduce la depresión en pacientes con enfermedades cerebrovasculares. Los autores concluyeron que los hallazgos respaldan la eficacia de la citicolina como tratamiento para la depresión. Arcadi et al [599], en un estudio de cohorte retrospectivo, concluyeron que la administración de fármacos noótropos, como la citicolina, podría ser una estrategia terapéutica válida para el manejo de pacientes postictus con ansiedad leve-moderada o síndrome ansiosodepresivo. Tykhomyrov et al [600] indicaron por primera vez que la citicolina protege tanto a los astrocitos como a las neuronas y mejora la capacidad angiógena a través de la regulación a la baja de la angiostatina en pacientes postisquémicos con fibrilación auricular después de un accidente cerebrovascular isquémico agudo.
Como conclusión, se podría decir que ha quedado suficientemente demostrado que los pacientes con infarto cerebral en fase aguda, así como en la fase de secuelas, se pueden beneficiar del tratamiento con citicolina, consiguiendo una mejor recuperación funcional y neurológica, y éste es un tratamiento seguro y bien tolerado, como viene siendo reconocido por diversos autores [601-615], así como autoridades [616,617].
Trastornos cognitivos
Diversas investigaciones experimentales sobre el denominado envejecimiento cerebral han conducido, en los últimos años, a dar una importancia creciente a las alteraciones del metabolismo neuronal como factor participante en la fisiopatología de este proceso. En el cerebro senil existe una disminución general de las actividades enzimáticas ligadas al metabolismo energético, así como modificaciones bioquímicas más específicas que afectan al metabolismo lipídico y de los ácidos nucleicos. También se ha comprobado que, tanto en los procesos de envejecimiento como en determinadas enfermedades preseniles y seniles, se asocian alteraciones específicas de ciertos neurotransmisores (dopamina, acetilcolina) y hormonas (hormona del crecimiento, prolactina) [618], aunque recientemente han aparecido diversas publicaciones promulgando una creciente evidencia de la contribución de los diferentes factores de riesgo vascular como mecanismos clave involucrados en el desarrollo del deterioro cognitivo y la demencia [619-622].
La citicolina, según se ha demostrado en los diversos estudios experimentales analizados, incrementa la síntesis de fosfolípidos y la captación de glucosa en el cerebro, en condiciones en que estos procesos se encuentran disminuidos. También influye en el metabolismo de los neurotransmisores, y se ha demostrado que incrementa la síntesis de dopamina en determinadas regiones cerebrales. Sobre la base de estos hechos, se han llevado a cabo numerosos ensayos clínicos para valorar la eficacia de la citicolina en el tratamiento de los trastornos cognitivos asociados al envejecimiento cerebral, la patología vascular cerebral crónica y demencias [623]. Mediante técnicas de espectroscopia por resonancia magnética, se ha demostrado que la citicolina estimula la síntesis de fosfatidilcolina en el cerebro de sujetos ancianos [624-627] y mejora el metabolismo energético cerebral en sujetos ancianos [628], lo que se correlaciona con la mejoría de sus capacidades cognitivas [629], especialmente de la memoria [630-632] y del tiempo de reacción [633]. En voluntarios sanos, la administración de citicolina se ha asociado con mejorías en la atención [634,635], la memoria [636,637] y algunos parámetros neurofisiológicos [638-641]. Algunos autores destacan el papel de la citicolina en el manejo del deterioro cognitivo vascular [642], especialmente como compuesto activador de sirtuina, y consideran ésta una acción relevante sobre la neuroinflamación implicada en el deterioro cognitivo [643]. Baumel et al [644] observaron la utilidad de la suplementación con uridina/colina en el tratamiento del deterioro cognitivo leve. Gromova et al [413] consideran que los efectos farmacológicos de la CDP-colina están mediados por múltiples mecanismos moleculares que contribuyen a la acción noótropa de esta molécula y su eficacia en el manejo de los trastornos cognitivos. Farooq et al [645] incluyeron la citicolina entre la farmacoterapia para el deterioro cognitivo vascular, y Lewis et al [646], entre los nutrientes y fitonutrientes con efecto sobre la función cognitiva.
En uno de los primeros estudios realizados en este campo, Madariaga et al [647] demostraron cómo un tratamiento con citicolina en un grupo de enfermas seniles inducía una mejoría en la memoria, la cooperación y la capacidad de relación con el medio. Fassio et al [648] comentaron la utilidad de la citicolina en psicogeriatría, destacando, además, que la aplicación de citicolina como tratamiento de fondo permite reducir la dosificación de los psicofármacos utilizados habitualmente en psicogeriatría. En numerosos estudios se ha demostrado la utilidad de la citicolina en el tratamiento de la denominada involución cerebral senil, consiguiendo una disminución de la sintomatología característica [649-658]. Lingetti et al [649], en un estudio abierto controlado realizado con un grupo de 30 pacientes con cerebropatía involutiva senil, obtuvieron un 83,3% de mejorías sintomáticas, y destacaron la ausencia de efectos secundarios asociados al tratamiento. Stramba-Badiale y Scillieri [650] consiguieron demostrar una mejoría significativa en las puntuaciones del Mental Status Questionnaire de Fishback en un grupo de 24 sujetos ancianos tras 20 días de tratamiento con 500 mg/día por vía intramuscular de citicolina. Bonavita et al [651] destacaron la eficacia de la citicolina en favorecer la evolución de algunos síntomas neuropsíquicos, como la memoria y la atención, en pacientes seniles, sin inducir efectos secundarios. Lozano et al [652] revisaron una serie de 2.067 pacientes ancianos tratados con citicolina, en dosis de 300-600 mg/día, durante dos meses. En la tabla IX se exponen los resultados obtenidos, sobre la base de la remisión y la mejoría de determinados síntomas neuropsíquicos. Palleschi y Capobianco [653] demostraron mejorías significativas en las puntuaciones de la escala de valoración clínico-geriátrica de Sandoz (SCAG) y el MMSE, en pacientes con envejecimiento cerebral patológico, después de un tratamiento con citicolina. Schergna y Lupo [654], en un estudio multicéntrico, en el que participaron 502 pacientes seniles, comprobaron que citicolina inducía mejorías significativas en la atención, el comportamiento, la vida de relación y la independencia, sin que se presentasen efectos secundarios asociados a este tratamiento. Suryani et al [655] demostraron que la citicolina es eficaz en el tratamiento de los déficits de memoria del anciano, consiguiendo mejorías significativas y progresivas en todos los parámetros analizados (Tabla X). La citicolina ha conseguido mejorar las puntuaciones de enfermos seniles de diversas escalas, como la de Plutchik [656], el Trail Making Test, el test de memoria de Randt y el test de atención de Toulouse-Piéron [657,658].
Tabla IX. Porcentajes de remisión y mejoría sintomática (p < 0,001 para cada uno de los síntomas, respecto al inicio del tratamiento).
|
| |
N.o de pacientes
|
Remisión
|
Mejoría
|
Estado de ánimo
|
1.521
|
38,2%
|
40,9%
|
Emotividad
|
1.559
|
36,9%
|
39,7%
|
Intranquilidad
|
1.504
|
41,3%
|
34,1%
|
Iniciativa propia
|
1.378
|
35,8%
|
32,9%
|
Memoria reciente
|
1.614
|
26,0%
|
45,5%
|
Interés por el entorno
|
1.410
|
38,3%
|
34,5%
|
Apariencia
|
1.132
|
40,0%
|
26,9%
|
Vértigo
|
1.463
|
59,4%
|
31,3%
|
Movilidad
|
1.234
|
35,2%
|
30,5%
|
Cefalea
|
1.425
|
57,7%
|
31,2%
|
Tabla X. Puntuaciones de repetición de dígitos, una adaptación de Wechsler de la prueba de historia lógica de Stanford-Benet, la prueba de Bali de memorización de imágenes y déficits de memoria y trastornos físicos comunicados por los pacientes, antes y después del tratamiento con citicolina. Los valores se expresan como media ± desviación estándar.
|
| |
Basal
(n = 10)
|
Después del tratamiento
|
1 semana
(n = 10)
|
2 semanas
(n = 10)
|
3 semanas
(n = 6)
|
Repetición directa de dígitos
|
14,6 ± 4,6
|
19,6 ± 5,6 b
|
20,2 ± 4,5 b
|
22,8 ± 6,0 b
|
Repetición inversa de dígitos
|
5,60 ± 4,1
|
7,30 ± 3,4 b
|
11,3 ± 7,1 b
|
12,1 ± 7,7 b
|
Prueba de historia lógica
|
6,10 ± 4,4
|
9,60 ± 3,8 b
|
12,7 ± 3,7 b
|
13,6 ± 4,8 b
|
Prueba de imágenes de Bali
|
5,20 ± 3,2
|
9,30 ± 3,5 b
|
11,7 ± 3,4 b
|
12,0 ± 2,4 b
|
Déficits de memoria
|
2,5 ± 0,9
|
1,00 ± 0,9 a
|
0,30 ± 0,4 b
|
0,30 ± 0,5 b
|
Trastornos físicos
|
2,3 ± 0,9
|
1,00 ± 0,8 a
|
0,20 ± 0,6 b
|
0,10 ± 0,4 b
|
a p < 0,05; b p < 0,01, respecto a los valores basales.
|
Se ha comprobado que la administración de citicolina a individuos adultos sanos actúa sobre la hipófisis anterior, induciendo un incremento en la secreción de hormona del crecimiento y una disminución de la secreción de prolactina, gracias a la activación del sistema dopaminérgico inducida [659,660]. Ceda et al [661] demostraron que la citicolina es capaz de incrementar la secreción de hormona del crecimiento, tanto la basal como la estimulada por la hormona liberadora de hormona del crecimiento, en ancianos, fenómeno que se encuentra alterado en estos individuos y, en mayor grado, en pacientes con enfermedades degenerativas cerebrales.
Una de las principales causas de deterioro cognitivo en el anciano corresponde a la patología vascular cerebral crónica, también denominada insuficiencia cerebral, cuyo grado máximo de expresión clínica lo supone la demencia vascular. En un estudio multicéntrico, aleatorizado y doble ciego frente a placebo, se evaluó la eficacia de la citicolina en el tratamiento de pacientes con patología vascular crónica [662]. Se incluyó a 33 pacientes que recibieron tratamiento con 1 g/día de citicolina o suero salino en perfusión endovenosa durante 28 días. Al final del período de tratamiento se observaron mejorías significativas en el grupo tratado con citicolina en el test Bender-Gestalt, la escala de depresión de Hamilton, la escala de Parkside, la escala de valoración neurológica y la prueba de atención. Falchi Delitalia et al [663] y Moglia et al [664] han observado que la mejoría clínica se acompaña de una mejoría en el trazado del electroencefalograma de estos pacientes. Merchan et al [665] demostraron una mejoría progresiva de la sintomatología asociada a la insuficiencia cerebrovascular en un grupo de 40 ancianos tratados con citicolina, en dosis de 1 g/día por vía intramuscular durante 60 días.
Agnoli et al [666] realizaron un estudio doble ciego en 100 pacientes con enfermedad vascular cerebral crónica en el que evaluaron la efectividad de la administración de citicolina, 1 g/día/28 días por vía intravenosa, en comparación con placebo. Tras el período de tratamiento se observó que en el grupo de pacientes tratados con citicolina se produjeron mejorías estadísticamente significativas en las puntuaciones obtenidas en la escala de depresión de Hamilton y en la escala de comportamiento de Parkside modificada, así como en las pruebas psicométricas y observacionales utilizadas, concluyendo que la citicolina mejora la capacidad perceptivomotora y la atención de estos pacientes, además de poseer un efecto estabilizador sobre el comportamiento. Sinforani et al [667], Motta et al [668] y Rossi y Zanardi [669] obtuvieron resultados muy similares en sus respectivos estudios. Los mejores resultados, desde el punto de vista clínico y conductual, se observaron en pacientes con una vasculopatía cerebral difusa [670-675].
Eberhardt y Derr [676] realizaron un estudio doble ciego cruzado para valorar la eficacia y la tolerancia de la citicolina en pacientes con insuficiencia cerebral senil. En el estudio se incluyó a 111 pacientes, con una edad media de 74,6 ± 6,9 años, con diagnóstico clínico de insuficiencia cerebral senil. Tras un período de lavado con placebo, se formaron dos grupos homogéneos, uno de los cuales recibió tratamiento con 600 mg/día por vía oral de citicolina durante cinco semanas y placebo durante cinco semanas más, con un período de lavado con placebo entre ambas tandas de tratamiento. En el otro grupo, el orden de administración fue el inverso. Los controles se realizaron a las 2, 7, 9 y 12 semanas. La citicolina mejoró de forma significativa el estado clínico en las seis pruebas utilizadas (recuerdo numérico, laberinto, conexión numérica, escala de autoevaluación neuropsicológica, escala de observación gerontopsicológica y SCAG) como primer tratamiento y aportó una mejoría adicional estadísticamente significativa como segundo tratamiento tras el placebo, que logró cierto grado de mejoría en cinco de las seis pruebas. Las comparaciones interindividuales también demostraron una eficacia superior de la citicolina. En la tabla XI se exponen los porcentajes de pacientes que mejoraron en cada una de las fases de tratamiento en ambos grupos. No se observaron efectos secundarios graves asociados a los tratamientos. Los autores concluyeron que estos resultados confirman la eficacia de la citicolina en el tratamiento de la insuficiencia cerebral senil y su excelente tolerancia en pacientes geriátricos. Estos efectos beneficiosos se deberían a la capacidad de la citicolina para inhibir la degradación de los fosfolípidos de la membrana neuronal, aumentar los niveles plásmicos de colina y activar la síntesis de los fosfolípidos estructurales, y la síntesis y la liberación de catecolaminas. Además, se ha comprobado que los efectos de la citicolina en la mejoría de los test se mantenían tras cambiar a placebo, lo que indica su relación con el proceso metabólico neuronal que tiende a restaurar y mantener el funcionalismo de la neurona.
Tabla XI. Porcentaje de pacientes que mejoraron en cada uno de los grupos, según se iniciase el tratamiento con citicolina o placebo.
|
| |
Grupo I
|
Grupo II
|
Citicolina
|
Placebo
|
Placebo
|
Citicolina
|
Recuento numérico
|
47
|
31
|
21
|
52
|
Laberinto
|
73
|
69
|
71
|
83
|
Conexión numérica
|
67
|
76
|
67
|
87
|
NAS
|
57
|
41
|
44
|
69
|
NAB
|
63
|
57
|
48
|
67
|
SCAG
|
80
|
73
|
65
|
83
|
NAB: escala de observación gerontopsicológica; NAS: escala de autoevaluación neuropsicológica; SCAG: escala de evaluación clínica geriátrica de Sandoz.
|
Chandra [677] ha presentado recientemente los resultados de un estudio doble ciego en el tratamiento de la demencia multiinfarto con citicolina. El estudio incluyó a 146 pacientes que fueron aleatoriamente asignados a dos grupos, uno de los cuales recibió tratamiento con citicolina, 750 mg/día por vía intravenosa, y el otro suero salino, durante dos meses, aunque el seguimiento se prolongó hasta los 10 meses. Al final del período de tratamiento se observó cómo los pacientes tratados con citicolina mejoraban significativamente las puntuaciones del MMSE, mientras que éstas empeoraban ligeramente en el grupo placebo. A los 10 meses, los pacientes tratados con citicolina mantuvieron la mejoría observada, mientras que los pacientes del grupo placebo continuaron empeorando.
Piccoli et al [678] presentaron los resultados de un estudio doble ciego realizado en 92 pacientes con patología vascular cerebral crónica, tratados con citicolina (1.000 mg/día por vía intramuscular) o placebo, en dos ciclos de tratamiento de cuatro semanas cada uno separados por un intervalo de una semana. Se aleatorizó a 46 pacientes a cada grupo, y ambos grupos eran totalmente comparables en relación con el deterioro cognitivo. La valoración psicométrica se realizó con el test de Toulouse-Piéron (atención a estímulos no verbales), el test de memoria de Randt y la SCAG (medida de conducta y control emocional). La comparación entre grupos reveló mejorías significativas en el grupo de citicolina en las pruebas de atención, con descenso en el número de respuestas erróneas en el test de Toulouse-Piéron (
p < 0,05), en capacidades mnésicas, según el subtest de información general del test de memoria de Randt (
p < 0,05), y en la puntuación de trastornos afectivos de la SCAG (
p < 0,02). Además de la eficacia clínica, la citicolina se mostró como un fármaco muy seguro, ya que no se detectaron efectos adversos asociados al tratamiento.
Capurso et al [679] evaluaron la eficacia de la citicolina en el tratamiento de la enfermedad cerebrovascular crónica en un estudio multicéntrico, doble ciego y controlado por placebo. Se valoró, mediante escalas y test psicométricos, las funciones cognitivas y conductuales de 31 pacientes, que fueron aleatorizados a recibir citicolina (17 casos) o placebo (16 casos). Tras un período de lavado de dos semanas, se iniciaron tres períodos de tratamiento de 28 días cada uno, en el que los pacientes recibieron 1 g/día por vía intramuscular de citicolina o placebo. Entre cada uno de los ciclos de tratamiento se estableció un período de lavado de una semana. Diversas funciones cognitivas mejoraron en el grupo de pacientes tratados con citicolina, particularmente la memoria a corto y largo plazo. El test de memoria de Randt mostró una mejoría constante en diversos subtest, así como mejoraron significativamente la eficiencia cognitiva y la eficiencia de atención. La escala de Glasgow-Blatchford, que evalúa índices conductuales, también demostró mejorías asociadas al tratamiento con citicolina. Los autores concluyen que los pacientes tratados con citicolina mostraron una mejoría significativa de las funciones cognitivas, mientras que los pacientes que recibieron placebo no mostraron ninguna tendencia favorable. Por otro lado, se abunda en la perfecta tolerancia al fármaco.
No obstante, en pacientes con demencia vascular, Cohen et al [680] no fueron capaces de demostrar ningún efecto beneficioso de la citicolina en su estudio piloto.
Mediante técnicas de tomografía por emisión de positrones, Tanaka et al [681] han correlacionado la mejoría cognitiva con un incremento significativo del flujo sanguíneo cerebral en pacientes con demencia vascular que recibieron tratamiento con citicolina (1 g/día/1 semana por vía intravenosa).
Lozano [682] presentó los resultados de un estudio realizado por el Grupo Iberoamericano para el estudio de la enfermedad de Alzheimer y la Longevidad, cuya finalidad era valorar la situación y la evolución, al cabo de un año, de un grupo de pacientes con deterioro psicoorgánico de tipo demencial, previo diagnóstico y clasificación de su causa etiológica, en degenerativo, vascular o mixto, y tratamiento con citicolina por vía oral. Se administraron 600 mg/día por vía oral de citicolina durante un año a 314 pacientes, con una edad media de 75,02 ± 7,72 años, para valorar la evolución durante este plazo de su demencia. La demencia fue catalogada de degenerativa en el 41,1% de los casos, mientras que la demencia vascular suponía el 39,5%, y la demencia mixta, el 11,4%. Para la valoración se utilizaron el MMSE y el IB, y los controles se realizaron los meses 1, 3 y 12. En la evolución de las puntuaciones del MMSE se observa cómo éstas mejoraron significativamente en las demencias de tipo vascular y mixto y cómo se mantuvieron estables, con una cierta tendencia a mejorar, en las demencias de tipo degenerativo. Las puntuaciones del IB presentaron mejorías estadísticamente significativas en cada uno de los controles y para cada tipo de demencia. Estos resultados indican que la citicolina tiene un efecto beneficioso sobre la evolución a largo plazo de las demencias y resulta, a la vez, un tratamiento seguro.
Corona et al [683] observaron que los efectos beneficiosos que tiene la citicolina en el tratamiento de pacientes con demencia se debería, en parte, a la capacidad de este fármaco de mejorar la actividad de los sistemas noradrenérgico, dopaminérgico y serotoninérgico, como han demostrado en un estudio que valoraba la evolución de los niveles licuorales y urinarios de los metabolitos de las monoaminas implicadas en estos sistemas durante el tratamiento de pacientes con demencia senil de tipo Alzheimer.
Cacabelos et al [684] realizaron un estudio para valorar los efectos terapéuticos de la citicolina en pacientes con demencia. En este estudio se incluyó a 40 pacientes, que se distribuyen en cuatro grupos: a) 10 ancianos sanos; b) 10 pacientes con enfermedad de Alzheimer de origen precoz; c) 10 pacientes con enfermedad de Alzheimer de origen tardío; y d) 10 pacientes con demencia multiinfarto. Estos pacientes recibieron un tratamiento con citicolina en dosis de 1 g/día por vía oral durante tres meses. Tras este período de tratamiento se observó que en todos los grupos se produjo una mejoría significativa en las puntuaciones del MMSE (Fig. 27) y un significativo efecto antidepresivo, valorado con la escala de Hamilton para la depresión (Fig. 28). Además, se constató que, en los pacientes con enfermedad de Alzheimer de origen precoz, basalmente, existen unos niveles plásmicos de interleucina 1β significativamente más altos que en el resto de los grupos, lo que traduce la presencia de una alteración neuroinmunológica en la fisiopatología de la enfermedad de Alzheimer. Tras el tratamiento con citicolina, los niveles plásmicos de interleucina 1β se normalizaron, lo que indica que este fármaco posee cierta acción neuroinmunomoduladora. En una fase posterior de su estudio, este mismo equipo investigador ha demostrado que, en pacientes con enfermedad de Alzheimer, la citicolina mejora no sólo la función cognitiva, sino también la función cerebrovascular, valorada mediante la utilización de ultrasonografía Doppler transcraneal [685], y han comprobado el efecto neuroinmunológico del fármaco al observar que el tratamiento con citicolina reduce los niveles plásmicos de histamina, que están anormalmente elevados en los pacientes con enfermedad de Alzheimer [686], y eleva los niveles plásmicos del factor de necrosis tumoral alfa [687].
Figura 27. Efectos de la citicolina sobre la función cognitiva, evaluada mediante la Minimental State Examination (MMSE), en ancianos sanos (control), pacientes con enfermedad de Alzheimer de inicio precoz (EAIP) o tardío (EAIT) y enfermos con demencia multiinfarto (DMI). a p < 0,02; b p < 0,01.

Figura 28. Efectos antidepresivos de la citicolina en ancianos sanos (control), pacientes con enfermedad de Alzheimer de inicio precoz (EAIP) o tardío (EAIT) y enfermos con demencia multiinfarto (DMI), evaluados mediante la escala para la depresión de Hamilton. a p < 0,02; b p < 0,01; c p < 0,05.
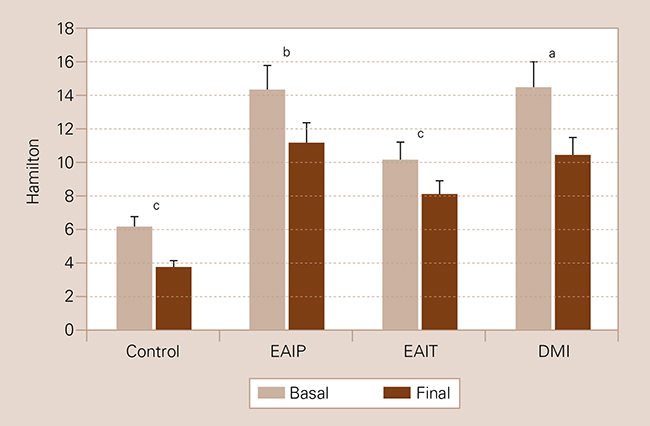
Este mismo grupo investigador ha publicado recientemente los resultados de un estudio piloto, doble ciego, aleatorizado y controlado con placebo, en el que se administró citicolina (1 g/día/12 semanas por vía oral) o placebo a 30 pacientes con demencia senil de tipo Alzheimer de intensidad leve o moderada [688]. En comparación con los 17 pacientes tratados con placebo, los pacientes que recibieron citicolina y que tenían un genotipo positivo para la APOE ε4 mostraron una significativa mejoría en su capacidad cognitiva valorada con la escala para la evaluación de la enfermedad de Alzheimer (
p < 0,05). También se demostró, como se había visto con anterioridad, que la citicolina incrementó el flujo sanguíneo cerebral y mejoró la actividad bioeléctrica cerebral.
Soto et al [689] han demostrado la utilidad de la asociación terapéutica de citicolina, piracetam y un calcioantagonista dihidropiridínico, nicardipino o nimodipino, en el tratamiento de la demencia senil de tipo Alzheimer. Cacabelos et al [690] también abogan por un tratamiento multifactorial, en el que se incluiría la citicolina, para la enfermedad de Alzheimer, en pacientes genotipados. Zhuravin et al [691] han demostrado que las actividades plásmicas de la acetilcolinesterasa, la butirilcolinesterasa y la neprilisina reflejan el nivel de disfunción cognitiva en la enfermedad de Alzheimer, y que pueden usarse como biomarcadores del nivel de evolución de la demencia, así como que el tratamiento con citicolina modifica de forma positiva los niveles de estos marcadores.
En una revisión sistemática, publicada por la Cochrane Library, Fioravanti y Yanagi [692] analizaron los efectos de la citicolina en el tratamiento de los déficits cognitivos, emocionales y conductuales asociados a trastornos cerebrales crónicos en el anciano. Los resultados obtenidos en esta revisión sistemática no evidenciaron ningún efecto significativo de la citicolina sobre la atención de los pacientes. En cambio, se encontró un significativo efecto beneficioso de la citicolina sobre la memoria y la conducta. En la valoración de la impresión clínica global, la OR de mejoría en los sujetos tratados con citicolina, en comparación con los pacientes tratados con placebo, fue de 8,89 (5,19-15,22). Los autores concluyen que existe evidencia de un efecto positivo de la citicolina sobre la memoria y la conducta, que es más homogéneo en pacientes con deterioro cognitivo secundario a patología vascular cerebral.
Se está explorando la asociación de la citicolina con la galantamina en el tratamiento de pacientes esquizofrénicos [693,694]. También se han obtenido interesantes resultados con el uso de citicolina en la prevención de la disfunción cognitiva postanestesia [695-698]. Li et al [699] han comprobado el efecto beneficioso de la citicolina como tratamiento coadyuvante en pacientes parkinsonianos con deterioro cognitivo leve. Putignano et al han publicado el estudio VITA [700], un estudio observacional retrospectivo para valorar la eficacia de la citicolina en ancianos con estupor relacionado con el síndrome geriátrico complejo, y han encontrado que, tras el tratamiento con citicolina, se obtenía una mejoría en las medidas claves de rendimiento. El mismo equipo publicó el estudio IDEALE [701], que fue un estudio abierto y multicéntrico, cuyo objetivo fue verificar la eficacia y la seguridad de la citicolina oral en pacientes ancianos con deterioro cognitivo leve de origen vascular. Los pacientes fueron reclutados considerando los siguientes criterios de inclusión:
- Edad mayor de 65 años.
- MMSE > 21.
- Percepción subjetiva de trastornos de memoria sin evidencia de déficit en el MMSE.
- Evidencia de lesión vascular en neurorradiología.
Fueron excluidos los pacientes con probabilidad de padecer enfermedad de Alzheimer. El total de pacientes incluidos en el estudio fue de 387. En todos ellos:
- Se realizó una tomografía computarizada o una resonancia magnética cerebral.
- Se determinó la concentración plásmica de vitamina B12, ácido fólico y hormonas tiroideas.
- Se evaluó la dependencia funcional con la escala Activities of Daily Living y la escala Instrumental Activities of Daily Living.
- Se evaluó el estado emocional con la Geriatric Depression Scale.
- Se evaluaron los desórdenes de comportamiento mediante la Neuropsychiatric Inventory Scale.
- Se evaluó la comorbilidad utilizando la Cumulative Illness Rating Scale, un test que evalúa el número y la gravedad de las enfermedades en pacientes individuales.
Un total de 349 pacientes cumplieron los criterios de inclusión y completaron el estudio. Los pacientes fueron divididos en dos grupos: uno que fue tratado con 1 g/día de citicolina (265 pacientes) y otro grupo control no tratado (84 pacientes). Se excluyó a 21 pacientes por sospecha de padecer enfermedad de Alzheimer, dos murieron antes del fin del estudio y 15 abandonaron. El seguimiento estuvo compuesto por una evaluación basal (T0), una evaluación tras tres meses (T1) y una última evaluación tras nueve meses (T2). El MMSE en el grupo tratado permaneció sin cambios a lo largo del período de seguimiento (22,4 ± 4 en T0; 22,7 ± 4 en T1; 22,9 ± 4 en T2). Durante los nueve meses de seguimiento del estudio se apreció una mejora promedio de 0,5 puntos en el deterioro cognitivo, sin diferencia significativa. El grupo no tratado (Fig. 29) mostró un declive significativo del MMSE durante los nueve meses de tratamiento (21,5 en T0; 20,4 en T1 y 19,6 en T2; −1,9 puntos entre T0 y T2). No se encontraron diferencias entre grupos en cuanto a las actividades de la vida diaria. No hubo efectos adversos informados durante el período de seguimiento. Según los autores, este estudio mostró que la citicolina es efectiva y segura en el tratamiento del deterioro cognitivo leve de origen vascular. Recientemente, el mismo equipo ha publicado el estudio CITIRIVAD [702], con el objetivo de mostrar la eficacia de la asociación de citicolina oral junto con rivastigmina en pacientes con enfermedad de Alzheimer o demencia mixta. Los resultados demostraron la eficacia y la seguridad de la combinación frente a la rivastigmina sola, principalmente enlenteciendo la progresión de la enfermedad y, consecuentemente, del manejo de la enfermedad, en ambos tipos de pacientes. Gareri et al [703] publicaron el Citicholinage Study y concluyeron que los pacientes tratados con citicolina más un inhibidor de la acetilcolinesterasa mostraron una mejora estadísticamente significativa en la función cognitiva. La asociación citicolina más donepecilo mostró ser aún mejor que citicolina más rivastigmina. Definitivamente, el presente estudio demostró que un precursor colinérgico como la citicolina más un inhibidor de la acetilcolinesterasa es capaz de ralentizar la progresión de la enfermedad en pacientes con enfermedad de Alzheimer [704]. Gareri et al [705,706], en el estudio CITIMEM, demostraron la eficacia de la citicolina oral más memantina en pacientes afectados de enfermedad de Alzheimer y demencia mixta, y fomentan el papel de esta terapia combinada en el manejo de la enfermedad y en la ralentización de su progresión. Castagna et al [707] estudiaron los beneficios del tratamiento combinado con citicolina, memantina y un inhibidor de la acetilcolinesterasa en pacientes mayores afectados de enfermedad de Alzheimer y concluyeron que esta triple terapia con citicolina, memantina y un inhibidor de la acetilcolinesterasa era más eficaz que memantina y un inhibidor de la acetilcolinesterasa sin citicolina, manteniendo la puntuación total del MMSE después de 12 meses. Castagna et al [708] publicaron el estudio CITIMERIVA (CITIcolina más MEmantina más RIVAstigmina) en pacientes mayores afectados por la enfermedad de Alzheimer. Fue un estudio retrospectivo multicéntrico de casos y controles realizado en los centros italianos para el deterioro cognitivo y la demencia en pacientes consecutivos de 65 años o más afectados por la enfermedad de Alzheimer. En total, se reclutó a 104 pacientes (27%, hombres; edad media, 76,04 ± 4,92 años); 41 (39,42%) tratados con citicolina 1.000 mg/día por vía oral + memantina + rivastigmina (casos) y 63 (60,58%) tratados con memantina + rivastigmina (controles). En el grupo de casos (terapia triple) hubo un aumento estadísticamente significativo en la puntuación del MMSE entre el inicio y el final del estudio. Gareri et al [709], en el estudio CITIDEMAGE, demostraron la eficacia de citicolina oral más inhibidores de la acetilcolinesterasa más memantina en pacientes ambulatorios con enfermedad de Alzheimer. Gareri et al [710] informaron de un resumen de los estudios sobre el tratamiento combinado con citicolina de la enfermedad de Alzheimer y la demencia mixta y demostraron los beneficios en términos de retraso en el empeoramiento cognitivo. Piamonte et al [711], en su revisión, concluyeron que la citicolina utilizada junto con un inhibidor de la acetilcolinesterasa en el tratamiento de la enfermedad de Alzheimer se toleró bien y mostró una mejoría en la cognición, el estado de ánimo y los síntomas conductuales en comparación con el tratamiento con un inhibidor de la acetilcolinesterasa solo.
Figura 29. Comparación de la evolución de las puntuaciones del Minimental State Examination corregido entre el grupo de la citicolina y el grupo control.

Los trastornos cognitivos son secuelas comunes de los ictus y pueden deteriorar la recuperación funcional [712]. El ictus isquémico es un factor de riesgo significativo para el deterioro cognitivo vascular y la demencia vascular [713]. En este contexto, Alvarez-Sabín et al realizaron un estudio para valorar la seguridad de la administración de citicolina a largo plazo, así como para evaluar su posible eficacia en prevenir o reducir el deterioro cognitivo en pacientes con un primer ictus isquémico agudo [714], siguiendo un diseño abierto, aleatorizado y paralelo para comparar la citicolina con el tratamiento usual. Los pacientes se seleccionaron a las seis semanas de haber sufrido el ictus y fueron aleatorizados de acuerdo con la edad, el sexo, la educación y el subtipo de ictus en dos ramas paralelas para recibir tratamiento con citicolina (1 g/día por vía oral) durante 12 meses o no (grupo control). Por otro lado, el tratamiento médico fue similar en ambos grupos. Todos los pacientes se evaluaron con una batería de test neuropsicológicos al mes, a los seis meses y a los 12 meses tras el ictus. Los resultados de los diferentes test neuropsicológicos se agruparon para crear índices de seis dominios neurocognitivos: atención y funciones ejecutivas, memoria, lenguaje, percepción espacial, velocidad motora y orientación temporal. Se determinó la asociación del tratamiento con citicolina y el declinar cognitivo para cada uno de los dominios a los seis y 12 meses mediante modelos de regresión logística ajustada. Se reclutaron 347 pacientes (edad media, 67,2 años; 186 de sexo masculino, 56,6%), con una educación media de 5,7 años); 172 (49,6%) fueron tratados con citicolina durante 12 meses. Tanto los datos demográficos como los factores de riesgo, la gravedad inicial del ictus y la clasificación clínica y etiológica del ictus, fueron similares en ambos grupos. Sólo 37 pacientes (10,7%) discontinuaron el tratamiento (el 10,5% con citicolina frente al 10,9% del grupo control) a los seis meses; 30 (8,6%) por fallecimiento –16 (9,3%) con citicolina frente a 14 (8%) del grupo control;
p = 0,74–, siete por pérdida de seguimiento o tratamiento incorrecto y cuatro (2,3%) tuvieron efectos adversos con la citicolina, aunque siguieron con el tratamiento. Fueron evaluados neuropsicológicamente 199 pacientes al cabo de los 12 meses. Las funciones cognitivas mejoraron en todos los pacientes a los seis y 12 meses, pero, en comparación con el grupo control, los pacientes tratados con citicolina tuvieron una mejor evolución de los déficits en atención-funciones cognitivas (OR, 1,721; IC 95%, 1,065-2,781;
p = 0,027 a los seis meses; OR, 2,379; IC 95%, 1,269-4,462; p = 0,007 a los 12 meses) y orientación temporal (OR, 1,78; IC 95%, 1,02-3,104;
p = 0,042 a los seis meses; OR, 2,155; IC 95%, 1,017-4,566;
p = 0,045 a los 12 meses) durante el seguimiento. Además, en el grupo de pacientes tratados con citicolina se observó una clara tendencia a obtener un mejor resultado funcional (mRS ≤2) a los 12 meses (57,3 frente a 48,7%), aunque sin alcanzar significación estadística (
p = 0,186). Los autores concluyeron que el tratamiento con citicolina durante 12 meses en pacientes con un primer ictus isquémico es seguro y probablemente efectivo para mejorar el deterioro cognitivo postictus. Por lo tanto, según los autores, la citicolina parece ser un tratamiento prometedor para mejorar la recuperación tras un ictus. Recientemente, los autores han publicado el seguimiento de este estudio tras dos años de tratamiento con citicolina [715], añadiendo una valoración de la calidad de vida, medida con el cuestionario EuroQoL-5D, a la valoración cognitiva. Se siguió a 163 pacientes durante dos años. La edad media fue de 67,5 años, y el 50,9% eran mujeres. La edad y la ausencia de tratamiento con citicolina fueron predictores independientes de utilidad y de peor calidad de vida. Los pacientes con deterioro cognitivo tenían una significativa peor calidad de vida a los dos años (0,55 frente a 0,66 en utilidad;
p = 0,015). El tratamiento con citicolina mejoró significativamente el estado cognitivo durante el seguimiento (
p = 0,005), mostrando una mejoría gradual a lo largo de todo el período de seguimiento (Fig. 30). Otros autores también han comunicado efectos positivos de citicolina en el tratamiento de los trastornos cognitivos postictus [716,717].
Figura 30. Deterioro cognitivo global durante el seguimiento. Los pacientes tratados con citicolina muestran una mejoría significativa de su estado cognitivo durante el seguimiento (p = 0,005). Tras el primer año, sólo los pacientes tratados con citicolina continúan mejorando el estado cognitivo. Con permiso de J. Álvarez-Sabín, et al. Long-term treatment with citicoline prevents cognitive decline and predicts a better quality of life after a first ischemic stroke. Int J Mol Sci 2016; 17: 390.
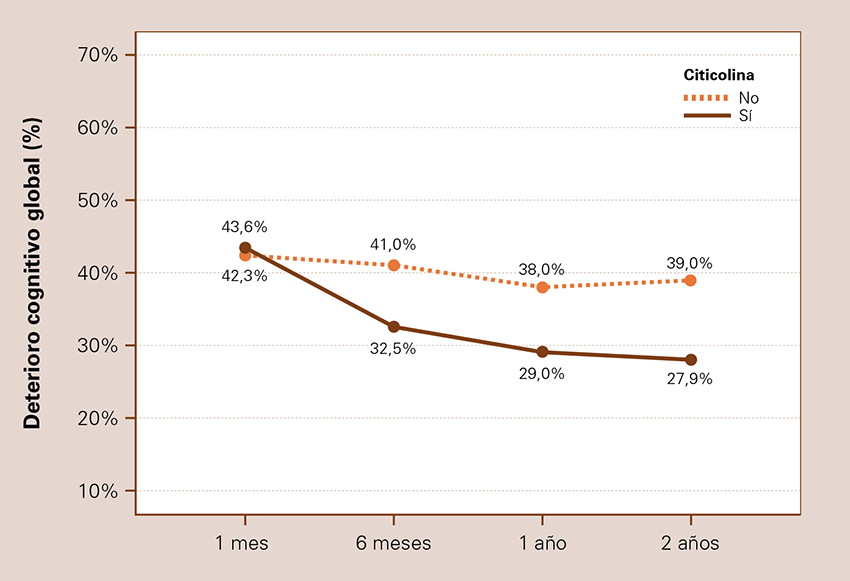
Feng et al [718] investigaron los efectos de la terapia con citicolina en la conectividad de la red del cuerpo calloso en pacientes con leucoaraiosis mediante imágenes de tensión de difusión. Después de un año de tratamiento, la citicolina pudo retrasar la interrupción de la conectividad de la red del cuerpo calloso en esos pacientes. Kovalenko y Lytvyn [719] demostraron que el tratamiento con citicolina en pacientes con encefalopatía discirculatoria hipertensiva e hipotiroidismo concomitante mejora significativamente el rendimiento de la electrogenia cerebral. Mashin et al [720] concluyeron que el tratamiento con citicolina en pacientes con patologías cerebrovasculares crónicas mejoraba la función cognitiva, la memoria y la coordinación visuoespacial, y disminuía la gravedad de la depresión. Chutko et al [721] indicaron que el uso de citicolina en el tratamiento de pacientes con disfunción somatomorfa del sistema nervioso autónomo fue altamente efectivo (se produjeron mejoras en el 67,4% de los pacientes), incluida la función cognitiva. Qureshi et al [722] consideran que la citicolina será la forma rentable de administrarla para la hiperhomocisteinemia.
Turana et al [723] describieron en detalle los mecanismos potenciales de la citicolina como terapia adyuvante y prevención del deterioro cognitivo relacionado con la COVID-19 y otras complicaciones neurológicas a través de las propiedades de la citicolina de síntesis de neurotransmisores antiinflamatorios, antivirales, neuroprotectores, neurorreparadores y de acetilcolina, y proporcionaron una recomendación para futuros ensayos clínicos.
Además, estudios recientes encontraron efectos positivos en personas sanas [724-727]. Choueiry et al [724] realizaron un estudio piloto aleatorizado, doble ciego, controlado con placebo y contrabalanceado en humanos sanos para evaluar los efectos de los índices de activación del habla P50 de una estrategia de receptor de acetilcolina nicotínico alfa 7, que combina citicolina con galantamina, y obtuvieron resultados positivos con esta combinación. Nemkova et al [725] demostraron que el uso de citicolina tiene un efecto positivo en la compensación de trastornos autonómicos y asténicos, mejora el estado cognitivo, y corrige trastornos psicoemocionales en estudiantes universitarios y profesores. Nakazaki et al [726,727] demostraron, en un ensayo aleatorizado, doble ciego y controlado con placebo, que la citicolina mejoró el rendimiento general de la memoria, especialmente la memoria episódica, en hombres y mujeres sanos con deterioro de la memoria asociado con la edad.
Quizás el fármaco sea más eficaz en trastornos cognitivos leves [728-730] y en casos asociados a patología vascular [731-734]. Además, se ha demostrado que el fármaco posee efectos beneficiosos sobre las alteraciones neurofisiológicas y neuroinmunológicas [734].
Otras experiencias clínicas
Enfermedad de Parkinson
Aunque la levodopa sigue siendo el agente terapéutico central en la enfermedad de Parkinson, sus limitaciones son bien conocidas, y la principal de ellas es la pérdida progresiva de eficacia, que muchas veces es ya ostensible a los 3-5 años de tratamiento. Parece, pues, justificado el empleo de otros fármacos que, asociados a la levodopa, permitan reducir la dosis de ésta o, incluso, puedan administrarse como medicación única en las primeras fases de la enfermedad. A este respecto, se ha ensayado la utilización de la citicolina por su capacidad, analizada anteriormente, de incrementar la disponibilidad de dopamina en estriado y de actuar como agonista dopaminérgico, y se ha demostrado su eficacia en diversos modelos experimentales, por lo que su utilización en la enfermedad de Parkinson está aceptada [735].
Ruggieri et al [736], en un estudio doble ciego y cruzado, realizado con 28 pacientes parkinsonianos, comparativo de citicolina, 600 mg/día/10 días por vía intravenosa, con placebo, demostraron que la citicolina es un tratamiento eficaz en el tratamiento de este tipo de pacientes, consiguiendo mejorías en la valoración de la bradicinesia, la rigidez y el temblor, así como en las puntuaciones de la escala de Webster y la escala de incapacidad de la Universidad Northwestern. Más adelante, estos mismos investigadores, en una ampliación del estudio anterior [737], obtuvieron resultados muy similares. Posteriormente, ensayaron los efectos de la citicolina en dos grupos de pacientes con enfermedad de Parkinson [738]. El primer grupo incluía a 28 pacientes que no habían recibido tratamiento con anterioridad, mientras que en el segundo grupo se incluyó a 30 pacientes que ya estaban recibiendo tratamiento con levodopa y carbidopa desde dos meses antes, como mínimo, habiéndose estabilizado la posología en el nivel mínimo efectivo. La metodología seguida fue la misma que en los anteriores estudios de estos investigadores, es decir, un estudio doble ciego cruzado comparativo con placebo. El tratamiento se administró durante 20 días en la dosis de 500 mg/día por vía parenteral. Las valoraciones clínicas se realizaron los días 10 y 20, coincidiendo con el cambio de tratamiento, según el diseño del estudio. El tratamiento con citicolina aportó mejorías estadísticamente significativas en los dos grupos de pacientes en la escala de Webster, la escala de incapacidad de la Universidad Northwestern y la valoración de la bradicinesia. La rigidez también mejoró en ambos grupos, aunque esta mejoría sólo alcanzó significación estadística en el grupo de pacientes tratados previamente. El temblor también mejoró en ambos grupos, aunque no se alcanzó la significación estadística deseada.
Eberhardt et al [739-741] han demostrado que la asociación de citicolina al tratamiento con levodopa permite reducir la dosis de ésta a un 50%, con lo que se minimizan los efectos secundarios asociados a la levodopaterapia. De esta forma, para este grupo de investigadores, la citicolina constituye una alternativa útil en los pacientes que requieren una reducción de las dosis de levodopa, y, por otra parte, la adición de citicolina a un tratamiento con levodopa puede aliviar los estados de descompensación en el curso del parkinsonismo [742].
Loeb et al [743] realizaron un estudio doble ciego multicéntrico con citicolina en el tratamiento de pacientes parkinsonianos. En ese estudio, 65 pacientes fueron distribuidos aleatoriamente a un grupo en el que se adicionaba 1 g/día por vía intravenosa de citicolina o al grupo del placebo, y la duración del tratamiento fue de 21 días. Todos los pacientes continuaron su tratamiento de base con levodopa más carbidopa o benseracida durante un mínimo de ocho semanas. Los autores encontraron diferencias significativas entre la citicolina y el placebo en los controles realizados a los 14 y 21 días de tratamiento en todos los parámetros valorados por las escalas de Webster y la escala de incapacidad de la Universidad Northwestern. Además, comprobaron que los pacientes tratados con citicolina sufrían un empeoramiento significativo a los 45 días de suspender la medicación, con lo que se comprueba la eficacia de la citicolina como tratamiento coadyuvante a la levodopa en pacientes con enfermedad de Parkinson.
Acosta et al [744] trataron con citicolina a 61 pacientes parkinsonianos, de los que 48 ya recibían tratamiento con levodopa. Cada paciente recibió dos tandas de tratamiento. En la primera etapa, de 10 días de duración, se administró citicolina a razón de 500 mg diarios por vía intramuscular, para continuar, en una segunda fase, con el tratamiento, con la misma dosis, por vía oral durante 14 semanas. Los pacientes tratados con levodopa siguieron tomando esta medicación en la misma dosis en un primer período y posteriormente se intentó su reducción. La valoración de la sintomatología parkinsoniana se realizó mediante la escala de Webster. De los enfermos que recibían levodopa, el 36% mejoró al adicionar citicolina, y el mayor porcentaje de mejorías se obtuvo en la bradicinesia, la rigidez, la postura, la marcha y el balanceo de las extremidades. Si se distinguía a los pacientes que habían sido tratados con levodopa durante menos de dos años, se encuentra que el porcentaje de mejorías asciende al 42,12%, frente al 19,08% de mejorías en los pacientes con más de dos años de levodopaterapia. La dosis de levodopa pudo disminuirse entre un 20 y un 100% en el 35,3% de los pacientes con menos de dos años de tratamiento. En los pacientes con más de dos años de tratamiento con levodopa, la dosis de ésta se pudo reducir un 25-33% en el 10% de los casos. Los autores concluyen que el tratamiento con citicolina permite retrasar la instauración de la levodopaterapia, en las primeras fases de la enfermedad, y reducir o mantener su dosis en los sujetos ya tratados.
Cubells y Hernando [745] ensayaron citicolina en 30 pacientes parkinsonianos que ya estaban siendo tratados con levodopa. La dosis administrada fue de 500 mg/día por vía intramuscular durante dos meses, reduciendo la dosis de levodopa a un tercio al finalizar el primer mes de tratamiento. La evolución de la sintomatología parkinsoniana, según la escala de Yahr, demostró, al primer mes de tratamiento, una mejoría moderada de la expresión facial y la destreza digital, y una mejoría evidente en la estabilidad postural, las alteraciones motoras y la bradicinesia. También se observó una mayor estabilización de la respuesta terapéutica, con una menor incidencia de fenómenos
wearing-off y
on-off, aunque aumentaron las discinesias. Al disminuir la dosis de levodopa durante el segundo mes de estudio, se mantuvo la mejoría clínica, y la incidencia de discinesias se redujo. Las determinaciones de diversos parámetros electrofisiológicos, según una técnica original de los autores, revelaron, al mes de tratamiento con citicolina, una recuperación de la hiporreflexia y de la hipotonía, así como una gran mejoría de la contracción muscular activa, una disminución de la fatiga muscular y una evidente recuperación de la velocidad contráctil, parámetro que se encontraba muy disminuido antes de iniciar el tratamiento con citicolina. Los autores consideran que el aumento de la concentración plásmica de levodopa es tan significativo que no se puede interpretar únicamente como debido a una mayor liberación de la dopamina almacenada en las vesículas presinápticas, por lo que asumen que la citicolina ejerce una acción sobre el mecanismo de síntesis de la dopamina, actuando a través del sistema enzimático de la tirosinhidroxilasa. Además, el incremento de los receptores dopaminérgicos cuantificados en linfocitos es indicativo, según los autores, del papel favorecedor de la citicolina sobre la disponibilidad de los receptores dopaminérgicos postsinápticos.
Martí-Massó y Urtasun [746] analizaron los efectos de la citicolina en 20 pacientes parkinsonianos en tratamiento con levodopa durante más de dos años. A estos pacientes se les administró citicolina 1 g/día/15 días por vía intramuscular, y luego siguieron con la mitad de la dosis durante 15 días más. Se obtuvo una progresiva mejoría sintomatológica. Así, en la escala de la Universidad de Columbia se obtuvo una mejoría global del 4,16% a los 15 días y del 7,26% al finalizar el tratamiento, y destacaron las mejorías parciales obtenidas en la deambulación, el tiempo de giro en la cama y el tiempo de escritura. En la valoración que efectuaron los familiares destacó la mejoría obtenida en la agilidad, la deambulación y el estado general del paciente.
García-Más et al [747] realizaron un estudio con electroencefalografía cuantificada mediante transformadas rápidas de Fourier en dos grupos de pacientes con enfermedad de Parkinson idiopática, uno de los cuales presentaba deterioro cognitivo cortical. El estudio de los índices específicos de la electroencefalografía cuantificada permitió establecer algunos parámetros diferenciales entre ambos grupos de pacientes, con o sin deterioro cortical. Específicamente, se hallaron diferencias respecto a las potencias globales de los ritmos delta y alfa, el índice alfa/theta, las actividades posteriores, el índice de anteriorización de los ritmos delta y alfa, y, por último, el índice de espacialización del ritmo alfa. La administración de 3 g de citicolina por vía intravenosa en estos pacientes consigue un aumento global de las potencias correspondientes a los ritmos posteriores, sobre todo del ritmo alfa, que es un marcador de la actividad cognitiva en procesos demenciales. Como se ha visto con anterioridad, la citicolina es un tratamiento coadyuvante eficaz para el deterioro cognitivo leve asociado en la enfermedad de Parkinson [699]. Por otro lado, la citicolina mejora significativamente el temblor esencial [748].
Con los estudios que se han expuesto y comentado, se puede afirmar que la citicolina supone un tratamiento efectivo en la enfermedad de Parkinson, tanto en pacientes no tratados como en los que ya reciben tratamiento con levodopa, en los que, además, permite reducir la dosis de ésta. En pacientes con enfermedad de Parkinson y deterioro cognitivo, la administración de citicolina ocasiona una tendencia a la normalización clínica y de los principales parámetros electrofisiológicos alterados. Que y Jamora [749] realizaron una revisión sistemática con el objetivo de sintetizar la evidencia existente actual sobre la eficacia de la terapia adyuvante con citicolina para mejorar los síntomas de la enfermedad de Parkinson y concluyeron que la terapia adyuvante con citicolina tiene efectos beneficiosos como terapia adyuvante en pacientes con enfermedad de Parkinson. Sin embargo, debido a la heterogeneidad de los estudios, se necesitan más estudios de alta calidad.
Alcoholismo y toxicomanías
La experiencia clínica en el alcoholismo y las toxicomanías con la citicolina no es muy extensa, pero existen algunas evidencias de su eficacia en estas aplicaciones.
Chinchilla et al [750] estudiaron, de forma aleatorizada y doble ciego, los efectos de la citicolina en 20 pacientes con síndrome de abstinencia alcohólica. Al final del estudio, es decir, a los dos meses, se comprobó una mejoría significativa de la atención-concentración y de la orientación temporoespacial en el grupo de pacientes que recibieron citicolina, lo que sugiere, según los autores, que el fármaco podría ser útil en el tratamiento del alcoholismo crónico. Brown et al [751] informaron de un estudio neutral en pacientes con trastorno por consumo de alcohol. Kang y Choi [752], a pesar de los resultados neutrales del estudio de Brown et al [751], consideran que el uso de citicolina en el tratamiento del trastorno por consumo de alcohol permanece en etapas de investigación y necesita más estudios, y Shen [753] considera a la citicolina entre las terapias
anticraving para el trastorno por consumo de alcohol.
Renshaw et al [754-756] han publicado un estudio piloto doble ciego en pacientes adictos a la cocaína, en el que demuestran que, tras 14 días de tratamiento, con dosis de 500 mg/12 horas de citicolina o placebo, los pacientes del grupo de citicolina tenían una disminución del ansia
(craving) de tomar cocaína, lo que hace que la citicolina aparezca como una prometedora terapia para este tipo de patología, sin alterar el ciclo sueño/vigilia [757], y puede disminuir el consumo de cocaína y mejorar la cognición [758]. Pero Licata et al [759] han comunicado que la citicolina no es eficaz en reducir el consumo en consumidores empedernidos. También se han comunicado efectos positivos en pacientes con problemas bipolares asociados al uso de cocaína [760, 761], efectos antidepresivos en adictos a la metanfetamina [762] y efectos procognitivos en adictos a la marihuana [763]. Cada vez parece más evidente la implicación del metabolismo cerebral en los procesos de drogadicción [764,765], y es de especial interés el uso de técnicas de neuroimagen para el estudio de estos trastornos [766]. Ése es el caso de Jeong et al [767], quienes realizaron un estudio aleatorizado, doble ciego, controlado con placebo, para evaluar los efectos de la citicolina en las estructuras cerebrales y sus asociaciones con el ansia y el consumo de metanfetamina. Los usuarios de metanfetamina (
n = 44) fueron aleatorizados para recibir 2 g/día de citicolina (
n = 22) o placebo (
n = 22) durante ocho semanas. Los pacientes se sometieron a imágenes de resonancia magnética cerebral al inicio del estudio y a las ocho semanas de seguimiento. Los individuos sanos (
n = 27) también fueron examinados mediante resonancia magnética cerebral en el mismo intervalo. Se realizó un análisis de morfometría basado en vóxeles para examinar los cambios en los volúmenes de materia gris y sus asociaciones con el ansia y el consumo de metanfetamina. El ansia de metanfetamina se redujo significativamente después del tratamiento de ocho semanas con citicolina (
p = 0,01), pero no con el tratamiento con placebo (
p = 0,1). No hubo diferencia significativa en el número total de muestras de orina negativas para metanfetamina entre los dos grupos (
p = 0,19). Con el tratamiento con citicolina, los volúmenes de materia gris en la circunvolución frontal media izquierda (
p = 0,001), el hipocampo derecho (
p = 0,009) y la precuña izquierda (
p = 0,001) aumentaron significativamente en comparación con los grupos de control y placebo. El aumento de los volúmenes de materia gris en la circunvolución frontal media izquierda con el tratamiento con citicolina se asoció con una reducción del ansia de metanfetamina (ρ de Spearman = 0,56;
p = 0,03). Además, los aumentos del volumen del hipocampo derecho se asociaron positivamente con el número total de resultados de orina negativos para metanfetamina en el grupo de citicolina (ρ de Spearman = 0,67;
p = 0,006). Entonces, estos resultados sugieren que los aumentos en el volumen de materia gris inducidos por la citicolina pueden contribuir a la disminución en el uso y el ansia de metanfetamina.
También existen datos que sugieren un potencial uso de citicolina en el tratamiento de trastornos del apetito [768]. Preuss et al [769] consideran a la citicolina entre las terapias para el trastorno bipolar y el uso comórbido de sustancias ilícitas. A pesar de los pocos datos sobre la eficacia de la citicolina en el tratamiento de trastornos adictivos, la bibliografía disponible sugiere resultados prometedores en el tratamiento de estas patologías [770].
Ambliopía y glaucoma
Existen evidencias clínicas de que la citicolina mejora la agudeza visual en pacientes con ambliopía [771-786], la función visual en pacientes con glaucoma [787-814], en pacientes con neuropatía óptica isquémica no arterítica [815,816] y en la retinopatía diabética temprana [817].
Ahora hay citicolina en formulaciones de gotas para los ojos para el manejo del glaucoma [818-821]. Tokuc et al [822] demuestran los efectos protectores de las gotas oftálmicas de citicolina sobre el daño oxidativo corneal inducido por la radiación ultravioleta B en un modelo de rata. Parisi et al [823] comunicaron los resultados de un estudio piloto que evaluó la eficacia a largo plazo de los colirios de citicolina y vitamina B
12 sobre la función macular en pacientes con diabetes de tipo 1 con signos leves de retinopatía diabética no proliferativa. El tratamiento con colirio de citicolina y vitamina B
12 durante un período de 36 meses consiguió una mejora de las respuestas bioeléctricas maculares, mientras que, durante el mismo período de seguimiento, los pacientes tratados con placebo mostraron un empeoramiento de la función macular. La citicolina y la vitamina B
12 tópicas mejoraron tanto la morfología como la función de los nervios corneales en pacientes con neuropatía diabética [824]. Las gotas oftálmicas de citicolina administradas tópicamente tuvieron efectos beneficiosos en la recuperación temprana de la sensibilidad corneal durante las primeras seis semanas después de LASIK, lo que sugiere que la citicolina puede desempeñar un papel importante en la aceleración de la reinervación corneal [825]. A pesar de su efecto neuroprotector, las gotas tópicas de citicolina no tuvieron un efecto significativo sobre las estructuras microvasculares superficiales y profundas de la retina o la coriocapilar [826].
Oddone et al [827] publicaron recientemente una extensa revisión sobre el papel de la citicolina en la enfermedad neurodegenerativa oftalmológica.
Otros usos
Se han descrito resultados positivos descritos para la citicolina en el tratamiento de la neuritis facial [828], la ictiosis ligada al cromosoma X [829], la encefalopatía de inicio tardío causada por envenenamiento por monóxido de carbono [830], la epilepsia [831], el vértigo [832], el trastorno depresivo mayor [833, 834], la esquizofrenia [835-837], el síndrome de temblor/ataxia asociado al X frágil [838] y la COVID-19 [839]. Recientemente, se ha descrito un nuevo mecanismo para mejorar la remielinización del sistema nervioso central a través de la vía de la colina. Debido a su acción regeneradora combinada con un excelente perfil de seguridad, la CDP-colina podría convertirse en una sustancia prometedora para pacientes con esclerosis múltiple como terapia adicional [840-844].
Uso en edades pediátricas. La experiencia en niños es limitada, por lo que la citicolina sólo debería administrarse en el caso de que el beneficio terapéutico esperado fuera mayor que cualquier posible riesgo.
Hay algunos estudios publicados en poblaciones pediátricas utilizando citicolina para el tratamiento de traumatismos craneoencefálicos [406], diversos síndromes orgánicos cerebrales [683-685], encefalopatía neonatal, hipóxica/isquémica [686,687], problemas visuales [688], disfasias evolutivas [689] y trastornos del aprendizaje [690,691]. En ninguno de estos estudios se han comunicado problemas de seguridad asociados al uso de citicolina.
Hay algunos estudios publicados en población pediátrica con citicolina en lesiones cerebrales traumáticas [456], síndromes cerebrales orgánicos [845-847], encefalopatía hipóxico-isquémica neonatal [848-852], discapacidad visual [853], ambliopía refractiva [854], disfasias evolutivas [855], deficiencia de colina cinasa beta [856], niños con posparo cardíaco [857], trastornos del aprendizaje [858,859], y autismo y síndrome de Asperger [860]. Hay una revisión sobre el uso de citicolina en neurología y psiquiatría pediátricas [861]. En estos estudios no se informaron problemas de seguridad relacionados con el uso de citicolina.
Seguridad
Dinsdale et al [862] administraron citicolina a 12 voluntarios sanos en dos regímenes de dosis oral repetida a corto plazo (600 mg/día y 1 g/día), cada uno de cinco días consecutivos, y su comparación se realizó con la correspondiente administración de placebo. Los únicos efectos adversos que se presentaron fueron cefaleas pasajeras, que se dieron en cuatro y cinco sujetos con dosis bajas y altas, respectivamente, y solamente en un sujeto durante la administración de placebo. Los resultados de los análisis hematológicos y clínicos no mostraron ninguna anormalidad asociada con la administración de citicolina, ni se registraron alteraciones clínicamente significativas en el electrocardiograma y el electroencefalograma. Las pruebas empíricas neurológicas, los reflejos tendinosos, la presión arterial y la frecuencia cardiaca no se vieron afectados por ningún nivel de dosis, como con el placebo.
Además de la excelente tolerancia en individuos sanos, demostrada en el estudio anterior, todos los autores de ensayos clínicos en los que se ha utilizado citicolina y que se han revisado en el presente artículo coinciden en calificar de excelente la seguridad de este fármaco, y no se han presentado en ningún caso efectos secundarios graves. En algunos casos, se ha señalado la aparición de intolerancias digestivas y, de forma ocasional, de excitabilidad e inquietud en los primeros días de tratamiento. En este sentido, Lozano [863] monitorizó un estudio de eficacia y seguridad de citicolina en 2.817 pacientes de todas las edades, predominando las comprendidas entre 60 y 80 años, que presentaban procesos neurológicos diversos, en su mayoría trastornos cognitivos de diversa etiología. La duración del tratamiento con citicolina osciló entre 15 y 60 días, y la dosis media administrada fue de 600 mg/día por vía oral. Sólo el 5,01% de los pacientes refirió efectos colaterales asociados al tratamiento con citicolina, y los más frecuentes fueron las intolerancias digestivas (3,6%). En ninguno de los casos fue necesario interrumpir el tratamiento por efectos secundarios atribuibles a la utilización de citicolina.
Los acontecimientos adversos recogidos en el análisis de datos agrupados, que se realizó en base a la experiencia del uso de citicolina en comprimidos para el tratamiento del infarto cerebral agudo en Estados Unidos [536], se muestran en la tabla XII.
Tabla XII. Análisis de seguridad del estudio de datos agrupados de citicolina en el tratamiento del infarto cerebral. Se muestran los acontecimientos adversos que se presentaron en más del 5% de los casos.
|
| |
Placebo
|
Citicolina
|
|
n
|
%
|
n
|
%
|
p
|
Acontecimientos con incidencia > 5% y más frecuentes con citicolina
|
Ansiedad
|
58
|
9,95
|
108
|
13,69
|
0,036
|
Edema de extremidades
|
38
|
6,52
|
77
|
9,76
|
0,032
|
Acontecimientos con incidencia > 5%
|
Caída accidental
|
86
|
14,75
|
135
|
17,11
|
NS
|
Agitación
|
78
|
13,38
|
113
|
14,32
|
NS
|
Estreñimiento
|
228
|
39,11
|
286
|
36,25
|
NS
|
Tos
|
81
|
13,89
|
105
|
13,31
|
NS
|
Diarrea
|
81
|
13,89
|
117
|
14,83
|
NS
|
Mareos
|
46
|
7,89
|
72
|
9,13
|
NS
|
Anomalías electrocardiográficas
|
57
|
9,78
|
74
|
9,38
|
NS
|
Fiebre
|
182
|
31,22
|
241
|
30,54
|
NS
|
Fibrilación auricular
|
65
|
11,15
|
92
|
11,66
|
NS
|
Cefalea
|
186
|
31,90
|
261
|
33,08
|
NS
|
Hematuria
|
53
|
9,09
|
91
|
11,53
|
NS
|
Hipertensión
|
88
|
15,09
|
131
|
16,60
|
NS
|
Hipopotasemia
|
71
|
12,18
|
119
|
15,08
|
NS
|
Hipotensión
|
55
|
9,43
|
90
|
11,41
|
NS
|
Infección urinaria
|
235
|
40,31
|
298
|
37,77
|
NS
|
Insomnio
|
103
|
17,67
|
145
|
18,38
|
NS
|
Dolor articular
|
48
|
8,23
|
78
|
9,89
|
NS
|
Náuseas
|
111
|
19,04
|
157
|
19,90
|
NS
|
Dolor
|
180
|
30,87
|
227
|
28,77
|
NS
|
Dolor de espalda
|
45
|
7,72
|
74
|
9,38
|
NS
|
Dolor precordial
|
55
|
9,43
|
82
|
10,39
|
NS
|
Rash
|
79
|
13,55
|
112
|
14,20
|
NS
|
Cansancio
|
49
|
8,40
|
74
|
9,38
|
NS
|
Dolor de hombros
|
75
|
12,86
|
105
|
13,31
|
NS
|
Vómitos
|
89
|
15,27
|
111
|
14,07
|
NS
|
Acontecimientos con incidencia > 5% y más frecuentes con placebo
|
Depresión
|
160
|
27,44
|
178
|
22,56
|
0.038
|
Caídas
|
109
|
18,70
|
99
|
12,55
|
0.002
|
Incontinencia urinaria
|
82
|
14,07
|
83
|
10,52
|
0.047
|
NS: no significativo.
|
En el estudio de seguridad realizado en Corea del Sur [543], se catalogó la seguridad del fármaco como excelente, ya que sólo se notificaron 37 efectos adversos en 31 pacientes de los 4.191 casos tratados, lo que supone una tasa del 0,73%.
Asimismo, la revisión Cochrane [692] también resalta la seguridad del fármaco, y destaca que la incidencia de acontecimientos adversos es inferior con la citicolina que con el placebo.
Ante la pregunta ¿puede la citicolina causar depresión?, Tardner [864] hizo una revisión de la bibliografía y concluyó que no hay casos registrados de citicolina que causen depresión en nadie, independientemente de su historial médico o psiquiátrico. En todo caso, la evidencia clínica sugiere que la citicolina puede tener propiedades antidepresivas.
Synoradzki y Grieb [865] explicaron por qué, sobre la base de la masa molar, la citicolina es significativamente menos tóxica que la colina, que se ha asociado con su contribución al metabolismo normal de los lípidos, el mantenimiento de la función hepática y el metabolismo normales de la homocisteína. La colina en la citicolina es menos propensa a convertirse en trimetilamina y su putativo N-óxido aterógeno, por lo que la suplementación de colina con citicolina puede ser más segura y eficaz.
En conclusión, la tolerabilidad a la citicolina es excelente y la aparición de efectos secundarios atribuibles a este fármaco es poco frecuente. En todo caso, estos efectos secundarios nunca revisten gravedad, y consisten, principalmente, en molestias gastrointestinales e intranquilidad.
Conclusiones
La citidín 5’-difosfocolina, CDP-colina o citicolina, es un intermediario esencial de la vía biosintética de los fosfolípidos estructurales de las membranas celulares, especialmente de la fosfatidilcolina. La citicolina, tras ser administrada, tanto por vía oral como parenteral, libera sus dos componentes principales, la citidina y la colina. La absorción por vía oral es prácticamente completa, y resulta que la biodisponibilidad de la vía oral es aproximadamente la misma que la de la vía endovenosa. Una vez absorbida, se distribuye ampliamente por el organismo, atraviesa la barrera hematoencefálica y alcanza el sistema nervioso central, donde se incorpora a la fracción de fosfolípidos de membrana y microsómicos. La citicolina activa la biosíntesis de los fosfolípidos estructurales de las membranas neuronales, incrementa el metabolismo cerebral y actúa sobre los niveles de diferentes neurotransmisores. Así, a nivel experimental, se ha demostrado que citicolina incrementa los niveles de noradrenalina y dopamina en el sistema nervioso central. Gracias a estos mecanismos farmacológicos, la citicolina tiene un efecto neuroprotector y neurorreparador en situaciones de hipoxia e isquemia, y mejora los rendimientos de aprendizaje y memoria en modelos animales de envejecimiento cerebral. Por otro lado, se ha demostrado que la citicolina restaura la actividad de la ATPasa mitocondrial y de la Na+/K+ATPasa de membrana, inhibe la activación de la fosfolipasa A2 y acelera la reabsorción del edema cerebral en diversos modelos experimentales. La citicolina es un fármaco seguro, como lo demuestran las pruebas toxicológicas realizadas, carece de efectos colinérgicos sistémicos importantes y es un producto perfectamente tolerado. Estas características farmacológicas y los mecanismos de acción de la citicolina sugieren que este producto puede estar indicado en el tratamiento de la patología vascular cerebral, los TCE de diversa gravedad y los trastornos cognitivos de diversa etiología. En los estudios realizados en el tratamiento de pacientes con TCE, la citicolina consigue acelerar la recuperación del coma postraumático y de la marcha, consiguiendo un mejor resultado funcional final y acortar la estancia hospitalaria de estos pacientes, así como mejorar los trastornos mnésicos y cognitivos observados tras TCE de menor gravedad y que conforman el denominado síndrome posconmocional. En el tratamiento de pacientes con patología vascular cerebral aguda de tipo isquémico, la citicolina acelera la recuperación de la conciencia y del déficit motor, consigue un mejor resultado final y facilita la rehabilitación de estos pacientes. La otra gran indicación de la citicolina es el tratamiento del deterioro cognitivo senil, ya sea secundario a enfermedades degenerativas o a patología vascular cerebral crónica. En los pacientes afectos de deterioro cognitivo vascular, la citicolina mejora las puntuaciones de las escalas de valoración cognitiva, mientras que, en pacientes con demencia senil de tipo Alzheimer, consigue frenar la evolución de la enfermedad, y se han descrito efectos neuroendocrinos, neuroinmunomoduladores y neurofisiológicos beneficiosos. Además, la citicolina también se ha mostrado eficaz como terapia coadyuvante en la enfermedad de Parkinson. En ninguna de las series de pacientes tratados con citicolina han aparecido efectos secundarios graves, lo que redunda en la seguridad de los tratamientos con citicolina [866,867].
Agarwal y Patel [493] señalaron que el uso de citicolina se asocia significativamente con mejores resultados funcionales, pero el papel positivo de este fármaco en la recuperación neurológica, la adaptación doméstica y los resultados cognitivos sigue siendo un tema de discusión para el futuro. Putilina [868] concluyó que los diversos mecanismos de acción de la citicolina permiten recomendarla como un fármaco eficaz tanto en la fase aguda de la enfermedad como en la tardía, otorgándole el estatus de compuesto noótropo universal. Jasielski et al [869], en su revisión sistemática, concluyeron que la citicolina tiene una amplia gama de efectos y podría ser una sustancia esencial en el tratamiento de muchas enfermedades neurológicas, y también cabe destacar su impacto positivo en el aprendizaje y las funciones cognitivas en la población sana. Piotrowska et al [870] concluyeron que la aplicación de citicolina mejora el estado de salud de personas diagnosticadas de ictus y TCE, así como en pacientes con deterioro cognitivo y, además, es eficaz en la enfermedad de Parkinson, el glaucoma y las adicciones, destacando su baja toxicidad, lo cual ha sido confirmado a través de pruebas con animales y estudios clínicos.
Kopka y Sochacki [871] concluyeron que, a la luz de los informes científicos disponibles en la actualidad, la citicolina puede considerarse una sustancia segura y útil para muchas indicaciones, y también se caracteriza por la ausencia de efectos secundarios graves, así como por una muy buena tolerancia entre los pacientes. Por lo tanto, hay 10 razones por las que usar citicolina:
- Mejora el pronóstico en los ictus.
- Mejora la memoria y la atención en personas sanas.
- Mejora la memoria en pacientes con demencia vascular.
- Tiene una influencia beneficiosa sobre las funciones cognitivas en la enfermedad de Alzheimer.
- Mejora el pronóstico después de lesiones en la cabeza.
- Reduce la gravedad de la bradicinesia y la rigidez muscular en personas con enfermedad de Retarda la progresión de la enfermedad en pacientes con glaucoma.
- Mejora la agudeza visual en pacientes con síndrome del ojo vago.
- Tiene un perfil de seguridad útil.
- Reduce el ansia por la cocaína.
Bibliografía
1. Lozano R. La membrana neuronal: implicaciones terapéuticas. Boletín de Neurología 1993; 2: 3-8.
2. McMurray WC, Magee WL. Phospholipid metabolism. Ann Rev Biochem 1972; 41: 129-61.
3. Nilsson B. CDP-choline: a short review. In Tognon G, Garattini S, eds. Drug treatment and prevention in cerebrovascular disorders. Amsterdam: Elsevier/North Holland Biomedical Press; 1979. p. 273-7.
4. Kennedy EP, Weiss SB. The function of cytidine coenzymes in the biosynthesis of phospholipides. J Biol Chem 1956; 222: 193-214.
5. McMaster CR. From yeast to humans - roles of the Kennedy pathway for phosphatidylcholine synthesis. FEBS Lett 2018; 592: 1256-72.
6. Peng KY, Barlow CK, Kammoun H, Mellett NA, Weir JM, Murphy AJ, et al. Stable isotopic tracer phospholipidomics reveals contributions of key phospholipid biosynthetic pathways to low hepatocyte phosphatidylcholine to phosphatidylethanolamine ratio induced by free fatty acids. Metabolites 2021; 11: 188.
7. Horibata Y, Sugimoto H. Differential contributions of choline phosphotransferases CPT1 and CEPT1 to the biosynthesis of choline phospholipids. J Lipid Res 2021; 62: 100100.
8. Fu G, Guy CS, Chapman NM, Palacios G, Wei J, Zhou P, et al. Metabolic control of TFH cells and humoral immunity by phosphatidylethanolamine. Nature 2021; 595: 724-9.
9. Agut J. Neurotransmisores y membrana neuronal. Rev Esp Geriatr Gerontol 1989; 24 (Supl1): S16-21.
10. Farooqui AA, Horrocks LA, Farooqui T. Glycerophospholipids in brain: their metabolism, incorporation to membranes, functions, and involvement in neurological disorders. Chem Phys Lipids 2000; 106: 1-29.
11. González-Padrones T, Rodríguez-Fernández C. Los fosfolípidos como índice de maduración cerebral. Rev Clin Esp 1982; 167: 99-101.
12. Martínez M, Conde, C, Ballabriga A. Some chemical aspects of human brain development. II. Phosphoglyceride fatty acids. Pediat Res 1974; 8: 93-102.
13. Padmini S, Srinivasa Rao P. UDP galactose: ceramide galactosyltransferase, CDP choline: 1,2-diacyl-sn-glycerol phosphocholine transferase and microsomal reductases in major regions of the developing rat brain in nutritional stress. J Neurosci Res 1989; 23: 310-5.
14. Horibata Y, Elpeleg O, Eran A, Hirabayashi Y, Savitzki D, Tal G, et al. Ethanolamine phosphotransferase 1 (selenoprotein I) is critical for the neural development and maintenance of plasmalogen in human. J Lipid Res 2018; 59: 1015-26.
15. Bramanti V, Bronzi D, Tomassoni D, Li Volti G, Cannavò G, Raciti G, et al. Effect of choline-containing phospholipids on transglutaminase activity in primary astroglial cell cultures. Clin Exp Hypertens 2008; 30: 798-807.
16. Paoletti L, Domizi P, Marcucci H, Montaner A, Krapf D, Salvador G, et al. Lysophosphatidylcholine drives neuroblast cell fate. Mol Neurobiol 2016; 53: 6316-31.
17. Alberghina M, Giuffrida-Stella AM Changes of phospholipid-metabolizing and lysosomal enzymes in hypoglossal nucleus and ventral horn motoneurons during regeneration of craniospinal nerves. J Neurochem 1988; 51: 15-20.
18. Boismare F. Souffrance cérébrale: comportement et neurotransmetteurs sur des modeles expérimentaux Symposium Internacional Souffrance Cérébrale et Précurseurs des Phospholipides. Paris, 18.01.1980.
19. Cardenas DD. Cognition-enhancing drugs. J Head Trauma Rehabil 1993; 8: 112-4.
20. Cohadon F, Rigoulet M, Guérin B, Vandendriessche M. Edème cérébral vasogénique. Altérations des ATPases membranaires. Restauration par un précurseur des phospholipides. Nouv Presse Méd 1979; 8: 1589-91.
21. Cohadon F, Rigoulet M, Guérin B, Vandendriessche M. L’activité membranaire dans la souffrance cérébrale. Altérations des ATPases membranaires dans l’edème cérébral vasogénique. Restauration par un précurseur des phospholipides. Symposium Internacional Souffrance Cérébrale et Précurseurs des Phospholipides. Paris, 18.01.1980.
22. Cohadon F. Physiopathologie des edèmes cérébraux. Rev Neurol (Paris) 1987; 143: 3-20.
23. Hayaishi O, Ozawa K, Araki C, Ishii S, Kondo Y. Biochemical studies of head injury and brain edema. Jpn J Med Prog 1961; 48: 519-39.
24. Rigoulet M, Guérin B, Cohadon F, Vandendriessche M. Unilateral brain injury in the rabbit; reversible and irreversible damage of the membranal ATPases. J Neurochem 1979; 32: 535-41.
25. Secades JJ, Lozano R. Traumatismos craneoencefálicos: revisión fisiopatológica y terapéutica. Aportaciones de la citicolina. Ámsterdam: Excerpta Medica; 1991.
26. Homayoun P, Parkins NE, Soblosky J, Carey ME, Rodriguez de Turco EB, Bazan NG. Cortical impact injury in rats promotes a rapid and sustained increase in polyunsaturated free fatty acids and diacylglycerols. Neurochem Res 2000; 25: 269-76.
27. Alberghina M, Giuffrida AM. Effect of hypoxia on the incorporation of [2-3H] glycerol and [1-14C]-palmitate into lipids of various brain regions. J Neurosci Res 1981; 6: 403-19.
28. Dvorkin VY. Turnover of individual phospholipid fractions in the rat during hypoxia. Nature 1966; 212: 1239-40.
29. Decombe R, Bentue-Ferrer D, Reymann JM, Allain H. L’edème dans l’infarctus cérébral. Aspects physiopathologiques et perspectives thérapeutiques. Angéiologie 1990; 42: 45-51.
30. Goldberg WJ, Dorman RV, Horrocks LA. Effects of ischemia and diglycerides on ethanolamine and choline phosphotransferase activities from rat brain. Neurochem Pathol 1983; 1: 225-34.
31. Goldberg WJ, Dorman RV, Dabrowiecki Z, Horrocks LA. The effects of ischemia and CDPamines on Na+,K+-ATPase and acetylcholinesterase activities in rat brain. Neurochem Pathol 1985; 3: 237-248.
32. Goto Y, Okamoto S, Yonekawa Y, Taki W, Kikuchi H, Handa H, et al. Degradation of phospholipid molecular species during experimental cerebral ischemia in rats. Stroke 1988; 19: 728-35.
33. Hirashima Y, Moto A, Endo S, Takaku A. Activities of enzymes metabolizing phospholipids in rat cerebral ischemia. Mol Chem Neuropathol 1989; 10: 87-100.
34. Horrocks LA, Dorman RV, Porcellati G. Fatty acids and phospholipids in brain during ischemia. In Bes A, Braquet P, Paoletti R, Siesjö BK, eds. Cerebral ischemia. Amsterdam: Elsevier Science Publishers; 1984. p. 211-22.
35. Nilsson BI. Pathophysiological and clinical problems in the treatment of acute stroke. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 287-97.
36. Rehcrona S, Siesjö BK, Smith DS. Reversible ischemia of the brain: biochemical factors influencing restitution. Acta Physiol Scand 1980; 492: 135-40.
37. Scheinberg P. The biologic basis for the treatment of acute stroke. Neurology 1991; 41: 1867-73.
38. Klein J. Membrane breakdown in acute and chronic neurodegeneration: focus on choline-containing phospholipids. J Neural Transm 2000; 107: 1027-63.
39. Pettegrew JW, Panchalingam K, Whiters G, McKeag D, Strychor S. Changes in brain energy and phospholipid metabolism during development and aging in the Fischer 344 rat. J Neuropathol Exp Neurol 1990; 49: 237-49.
40. Adibhatla RM, Hatcher JF. Role of lipids in brain injury and diseases. Future Lipidol 2007; 2: 403-22.
41. Adibhatla RM, Hatcher JF, Dempsey RJ. Lipids and lipidomics in brain injury and diseases. AAPS J 2006; 8: e314-21.
42. Adibhatla RM, Hatcher JF. Lipid oxidation and peroxidation in CNS health and disease: from molecular mechanisms to therapeutic opportunities. Antioxid Redox Signal 2010; 12: 125-69.
43. Reis DJ, Ross RA, Joh TH. Changes in the activity and amounts of enzymes synthesizing catecholamines and acetylcholine in brain, adrenal medulla, and sympathetic ganglia of aged rat and mouse. Brain Res. 1977; 136: 465-74.
44. Samorajski T, Rolsten C. Age and regional differences in the chemical composition of brains of mice, monkeys and humans. Prog Brain Res 1973; 40: 253-65.
45. Cohen BM, Renshaw PF, Stoll AL, Wurtman RJ, Yurgelun-Todd D, Babb SM. Decreased brain choline uptake in older adults. An in vivo proton magnetic resonance spectroscopy study. JAMA 1995; 274: 902-7.
46. Holbrock PG, Wurtman RJ. Calcium-dependent incorporation of choline into phosphatidylcholine (PC) by base-exchange in rat brain membranes occurs preferentially with phospholipid substrates containing docosahexaenoic acid (22: 6(n-3)). Biochim Biophys Acta 1990; 1046: 185-8.
47. Agut J. Metabolismo fosfolipídico en la fisiopatología de la enfermedad de Alzheimer. En Acarín N, Alom J, eds. Marcadores biológicos y perspectivas terapéuticas en la enfermedad de Alzheimer. Barcelona: MCR; 1989. p. 77-88.
48. Blusztajn JK, Wurtman RJ. Choline and cholinergic neurons. Science 1983; 221: 614-20.
49. Blusztajn JK, Liscovitch M, Richardson UI. Synthesis of acetylcholine from choline derived from phosphatidylcholine in a human neuronal cell line. Proc Natl Acad Sci U S A 1987; 84: 5475-7.
50. Ginsberg L, Atack JR, Rapoport SI, Gershfeld NL. Regional specificity of membrane instability in Alzheimer’s disease brain. Brain Res 1993; 615: 355-7.
51. Kalaria KN. The immunopathology of Alzheimer’s disease and some related disorders. Brain Pathol 1993; 3: 333-47.
52. Knusel B, Jenden DJ, Lauretz SD, Booth RA, Rice KM, Roch M, et al. Global in vivo replacement of choline by N-aminodeanol. Testing hypothesis about progressive degenerative dementia. I. Dynamics of choline replacement. Pharmacol Biochem Behav 1990; 37: 799-809.
53. Lee HC, Fellenz-Maloney MP, Liscovitch M, Blusztajn JK. Phospholipase D-catalyzed hydrolysis of phosphatidylcholine provides the choline precursor for acetylcholine synthesis in a human neuronal cell line. Proc Natl Acad Sci U S A 1993; 90: 10086-90.
54. Nitsch RM, Blusztajn JK, Pittas AG, Slack BE, Growdon JH, Wurtman RJ. Evidence for a membrane defect in Alzheimer disease brain. Proc Natl Acad Sci U S A 1992; 89: 1671-5.
55. Wurtman RJ, Coviella ILG. CDP-colina, neurotransmisores y metabolismo de fosfolípidos. Med Clin (Barc) 1986; 87 (Supl 1): 3-4.
56. Wurtman RJ, Blusztajn JK, Ulus IH, Coviella ILG, Buyukuysal RL, Growdon JH, et al. Choline metabolism in cholinergic neurons: implications for the pathogenesis of neurodegenerative diseases. Adv Neurol 1990; 51: 117-25.
57. Wurtman RJ. Choline metabolism as a basis for the selective vulnerability of cholinergic neurons. Trends Neurol Sci 1992; 15: 117-22.
58. Farber SA, Slack BE, DeMicheli E, Wurtman RJ. Choline metabolism, membrane phospholipids, and Alzheimer’s disease. In Giacobini E, Becker R, eds. Alzheimer disease: therapeutic strategies. Boston: Birkhäuser; 1994. p. 247-51.
59. Cansev M, Wurtman RJ, Sakamoto T, Ulus IH. Oral administration of circulating precursors for membrane phosphatides can promote the synthesis of new brain synapses. Alzheimers Dement 2008; 4 (Suppl 1): S153-68.
60. Giesing M, Gerken U, Kastrup H. Phospholipid-induced changes of γ-aminobutyric acid in cortex grey matter in culture. J Neurochem 1985; 44: 740-51.
61. Roufogalis BD, Thornton M, Wade DN. Nucleotide requirement of dopamine sensitive adenylate cyclase in synaptosomal membranes from the striatum of rat brain. J Neurochem 1976; 27: 1533-5.
62. Challis RAJ, Mistry R, Gray DW, Nahorski SR. Modulation of muscarinic cholinoceptor-stimulated inositol 1,4,5-trisphosphate accumulation by N-methyl-D-aspartate in neonatal rat cerebral cortex. Neuropharmacology 1994; 33: 15-25.
63. Lynch MA, Voss KL. Arachidonic acid increases inositol phospholipid metabolism and glutamate release in synaptosomes prepared from hippocampal tissue. J Neurochem 1990; 55: 215-21.
64. Albright CD, Liu R, Bethea TC, Da Costa KA, Salganik RI, Zeisel SH. Choline deficiency induces apoptosis in SV40-immortalized CWSV-1 rat hepatocytes in culture. FASEB J 1996; 10: 510-6.
65. Cui Z, Houweling M, Chen MH, Record M, Chap H, Vance DE, et al. A genetic defect in phosphatidylcholine biosynthesis triggers apoptosis in Chinese hamster ovary cells. J Biol Chem 1996; 271: 14668-71.
66. Baburina I, Jackowski S. Apoptosis triggered by 1-O-octadecyl-2-O-methyl-rac-glycero-3-phosphocholine is prevented by increased expression of CTP: phosphocholine cytidylyltransferase. J Biol Chem 1998; 273: 2169-73.
67. Anthony ML, Zhao M, Brindle KM. Inhibition of phosphatidylcholine biosynthesis following induction of apoptosis in HL-60 cells. J Biol Chem 1999; 274: 19686-92.
68. Howe AG, Remberg V, McMaster CR. Cessation of growth to prevent cell death due to inhibition of phosphatidylcholine synthesis is impaired at 37 degrees C in Saccharomyces cerevisiae. J Biol Chem 2002; 277: 44100-7.
69. Lagace TA, Ridgway ND. Induction of apoptosis by lipophilic activators of CTP: phosphocholine cytidylyltransferase (CCT)alpha. Biochem J 2005; 392: 449-56.
70. Joo JH, Jetten AM. Molecular mechanisms involved in farnesol-induced apoptosis. Cancer Lett 2010; 287: 123-35.
71. Morton CC, Aitchison AJ, Gehrig K, Ridgway ND. A mechanism for suppression of the CDP-choline pathway during apoptosis. J Lipid Res 2013; 54: 3373-84.
72. Cramer SC, Finkelstein SP. Reparative approaches: growth factors and other pharmacological treatments. In Miller LP, ed. Stroke therapy: basic, preclinical, and clinical directions. Hoboken: Wiley-Liss; 1999. p. 321-36.
73. Zweifler RM. Membrane stabilizer: citicoline. Curr Med Res Opin 2002; 18 (Suppl 2): S14-7.
74. McDaniel MA, Maier SF, Einstein GO. ‘Brain-specific’ nutrients: a memory cure? Nutrition 2003; 19: 957-75.
75. Mamoun CB, Prigge ST, Vial H. Targeting the lipid metabolic pathways for the treatment of malaria. Drug Dev Res 2010; 71: 44-55.
76. Candelario-Jalil E. Injury and repair mechanisms in ischemic stroke: considerations for the development of novel neurotherapeutics. Curr Opin Investig Drugs 2009; 10: 644-54.
77. Saver JL. Targeting the brain: neuroprotection and neurorestoration in ischemic stroke. Pharmacotherapy 2010; 30: 62S-9S.
78. Grieb P. Neuroprotective properties of citicoline: facts, doubts and unresolved issues. CNS Drugs 2014; 28: 185-93.
79. De la Morena E, Goldberg DM, Werner M. Citidíndifosfato de colina y biosíntesis de fosfolípidos. En De la Morena E, ed. Citicolina: bioquímica, neurofarmacología y clínica. Barcelona: Salvat; 1985. p. 25-38.
80. Chida N, Shimizu Y. Biosynthesis of myelin lipids of cultured nervous tissues. Incorporation of choline and CDPcholine into myelin phospholipids. Tohoku J Exp Med 1973; 111: 41-9.
81. Marggraf WD, Anderer FA. Alternative pathways in the biosynthesis of sphingomyelin and the role of phosphatidylcholine, CDPcholine and phosphorylcholine as precursors. Hoppe-Seyler’s Z Physiol Chem 1974; 355: 803-10.
82. Vance DE, Pelech SL. Cellular translocation of CTP: phosphocholine cytidylyltransferase regulates the synthesis of CDPcholine. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 15-24.
83. Goracci G, Francescangeli E, Mozzi R, Porcellati S, Porcellati G. Regulation of phospholipid metabolism by nucleotides in brain and transport of CDPcholine into brain In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 105-16.
84. George TP, Cook HW, Byers DM, Palmer FBSC, Spence MW. Channeling of intermediates in CDP-choline pathway of phosphatidylcholine biosynthesis in cultured glioma cells is dependent on intracellular Ca2+. J Biol Chem 1991; 266: 12419-23.
85. Murphy EJ, Horrocks LA. CDPcholine, CDPethanolamine, lipid metabolism and disorders of the central nervous system. In: Phospholipids and signal transmission. Massarelli R, Horrocks LA, Kanfer JN, Löffelholz K, eds. Berlin: Springer-Verlag; 1993. p. 353-72.
86. Tronchère H, Record M, Tercé F, Chap H. Phosphatidylcholine cycle and regulation of phosphatidylcholine biosynthesis by enzyme translocation. Biochim Biophys Acta 1994; 1212: 137-51.
87. Weiss GB. Metabolism and actions of CDP-choline as an endogenous compound and administered exogenously as citicoline. Life Sci 1995; 56: 637-60.
88. Jackowski S, Wang J, Baburina I. Activity of the phosphatidylcholine biosynthetic pathway modulates the distribution of fatty acids into glycerolipids in proliferating cells. Biochim Biophys Acta 2000; 1483: 301-15.
89. Dowd SR, Bier ME, Patton-Vogt JL. Turnover of phosphatidylcholine in Saccharomyces cerevisae. The role of the CDP-choline pathway. J Biol Chem 2001; 276: 3756-63.
90. Henneberry AL, Wright MM, McMaster CR. The major sites of cellular phospholipid synthesis and molecular determinants of fatty acid and lipid head group specificity. Mol Biol Cell. 2002; 13: 3148-61.
91. Hunt AN, Clark GT, Neale JR, Postle AD. A comparison of the molecular specificities of whole cell and endonuclear phosphatidylcholine synthesis. FEBS Lett. 2002; 530: 89-93.
92. Gibellini F, Smith TK. The Kennedy pathway–de novo synthesis of phosphatidylethanolamine and phosphatidylcholine. IUBMB Life 2010; 62: 414-28.
93. Kulinski A, Vance DE, Vance JE. A choline-deficient diet in mice inhibits neither the CDP-choline pathway for phosphatidylcholine synthesis in hepatocytes nor apolipoprotein B secretion. J Biol Chem. 2004; 279: 23916-24.
94. Li Z, Vance DE. Phosphatidylcholine and choline homeostasis. J Lipid Res 2008; 49: 1187-94.
95. Arienti G, Corazzi L, Mastrofini P, Montanini I, Trillini B, Porcellati G. Involvement of CDP-choline in phospholipid metabolism of brain tissue in vitro. Ital J Biochem 1979; 28: 39-45.
96. Jané F. Algunos aspectos de la farmacología de la citicolina. En De la Morena E, ed. Citicolina: bioquímica, neurofarmacología y clínica. Barcelona: Salvat; 1985. p. 49-62.
97. Clement JM, Kent C. CTP: phosphocholine cytidylyltransferase: insights into regulatory mechanisms and novel functions. Biochem Biophys Res Commun 1999; 257: 643-50.
98. Wong JT, Chan M, Lee D, Jiang JY, Skrzypczak M, Choy PC. Phosphatidylcholine metabolism in human endothelial cells: Modulation by phosphocholine. Mol Cell Biochem 2000; 207: 95-100.
99. Lykidis A, Jackson P, Jackowski S. Lipid activation of CTP: phosphocholine cytidylyltransferase α: characterization and identification of a second activation domain. Biochemistry 2001; 40: 494-503.
100. Fernández-Tome MC, Speziale EH, Sterin-Speziale NB. Phospholipase C inhibitors and prostaglandins differentially regulate phosphatidylcholine synthesis in rat renal papilla. Evidence of compartmental regulation of CTP: phosphocholine cytidylyltransferase and CDP-choline: 1,2-diacylglycerol cholinephosphotransferase. Biochim Biophys Acta 2002; 1583: 185-94.
101. Lagace TA, Ridgway ND. The rate-limiting enzyme in phosphatidylcholine synthesis regulates proliferation of the nucleoplasmic reticulum. Mol Biol Cell 2005; 16: 1120-30.
102. Satoh N, Harada A, Yokoyama K, Karasawa K, Inoue K, Setaka M. Regulation of activities of cytidine 5’-diphosphocholine: 1-O-alkyl-2-acetyl-sn-glycerol cholinephosphotransferase, an enzyme respondible for de novo synthesis of platelet-activating factor, by membrane phospholipids. J Health Sci 2003; 49: 13-21.
103. Richardson UI, Watkins CJ, Pierre C, Ulms IH, Wurtman RJ. Stimulation of CDP-choline synthesis by uridine or cytidine in PC12 rat pheochromocytoma cells. Brain Res 2003; 971: 161-7.
104. Zaccheo O, Dinsdale D, Meacock PA, Glynn P. Neuropathy target esterase and its yeast homologue degrade phosphatidylcholine to glycerophosphocholine in living cells. J Biol Chem 2004; 279: 24024-33.
105. Fagone P, Jackowski S. Phosphatidylcholine and the CDP-choline cycle. Biochim Biophys Acta 2013; 1831: 523-32.
106. Tayebati SK, Amenta F. Choline-containing phospholipids: relevance to brain functional pathways. Clin Chem Lab Med 2013; 51: 513-21.
107. Dobolyi A, Juhász G, Kovács Z, Kardos J. Uridine function in the central nervous system. Curr Top Med Chem 2011; 11: 1058-67.
108. Javaid S, Farooq T, Rehman Z, Afzal A, Ashraf W, Rasool MF, et al. Dynamics of choline-containing phospholipids in traumatic brain injury and associated comorbidities. Int J Mol Sci 2021; 22: 11313.
109. Horrocks LA, Dorman RV. Prevention by CDP-choline and CDP-ethanolamine of lipid changes during brain ischemia. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 205-15.
110. LePoncin-Lafitte M, Duterte D, Lageron A, Rapin JR. CDP-choline et accident cérébral expérimental día’origine vasculaire. Agressologie 1986; 27: 413-6.
111. Mykita S, Golly F, Dreyfus H, Freysz L, Massarelli R. Effect of CDP-choline on hypocapnic neurons in culture. J Neurochem 1986; 47: 223-31.
112. Yasuhara M, Naito H. Characteristic actions of CDP-choline on the central nervous system. Cur Ther Res 1974; 16: 346-74.
113. Yasuhara M, Naito H, Tachibana Y, Yasuhara A. An electrophysiological study on the effects of CDP-choline in the central nervous system. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 259-74.
114. Martí-Viaño JL, Selles J, Orts A, Marco J, Vega F, Esplugues J. Antagonismo del coma barbitúrico mediante productos alertizantes. Estudio experimental. Rev Esp Anest Rean 1978; 25: 21-8.
115. Ogashiwa M, Sano K, Manaka S, Kitamura K, Kagawa M, Takeuchi K. Effectiveness of CDP-choline on disturbance of consciousness (DOC): 1. An experimental study of concussive head injury in mice. 2. A controlled trial in patients with DOC. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 317-27.
116. Watanabe S, Kono S, Nakashima Y, Mitsunobu K, Otsuki S. Effects of various cerebral metabolic activators on glucose metabolism of brain. Folia Psychiat Neurol Jpn 1975; 29: 67-76.
117. Arrigoni E, Averet N, Cohadon F. Effects of CDP-choline on phospholipase A2 and cholinephosphotransferase activities following a cryogenic brain injury in the rabbit. Biochem Pharmacol 1987; 36: 3697-700.
118. Freysz L, Golly F, Mykita S, Avola R, Dreyfus H, Massarelli R. Metabolism of neuronal cell culture: modifications induced by CDP-choline. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 117-25.
119. Massarelli R, Mozzi R, Golly F, Hattori H, Dainous F, Kanfer JN, et al. Synthesis de novo of choline, production of choline from phospholipids, and effects of CDP-choline on nerve cell survival. Fidia Res Ser 1986; 4: 273-81.
120. Kitazaki T, Ohta Y, Tsuda M. Inhibition of membrane-associated phospholipase A2 by CDP-choline. Jpn Pharmacol Ther 1985; 13: 159-64.
121. Farooqui AA, Litsky ML, Farooqui T, Horrocks LA. Inhibitors of intracellular phospholipase A2 activity: their neurochemical effects and therapeutical importance for neurological disorders. Brain Res Bull 1999; 49: 139-53.
122. Algate DR, Beard DJ, Sacristán A, Ortiz AJ, Davies JE. Study on the effects of oral administration of CDP-choline on EEG changes and lethality induced by epidural compression in the anesthetised cat. Arzneimittelforschung 1983; 33: 1013-6.
123. Hayaishi O, Ozawa K, Araki C, Ishii S, Kondo Y. Biochemical studies of head injury and brain edema. Jpn J Med Prog 1961; 48: 519-39.
124. Kondo Y. Experimental study of the therapeutic use of cytidine nucleotids for brain injury. Arch Jpn Chir 1969; 32: 489-505.
125. Tsuchida T, Nagai M, Hoshino T, Kamano S, Miyake H. Treatment of head injuries with intermediate substances of metabolic cycle of brain. II. Basic study on metabolism of cytidine diphosphate choline. Brain Nerve 1967; 19: 1041-5.
126. Boismare F, LePoncin M, Le François J, Hacpille L, Marchand JC. Étude des effets de l’administration de cytidinediphosphocholine sur les consèquences hémodynamiques, fonctionelles et biochimiques du traumatisme crâniocervical chez le rat. Thérapie 1977; 32: 345-54.
127. Clendenon NR, Palayoor ST, Gordon WA. Influence of CDP-choline on ATPase activity in acute experimental spinal cord trauma. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 275-284.
128. Cohadon F, Richer E, Poletto B. Étude día’un précurseur des phospholipides dans le traitement des comas traumatiques graves. Neurochirurgie 1982; 28: 287-90.
129. Lafuente JV, Cervós-Navarro J. Estudio por microgavimetría del efecto de la CDP-colina en el edema cerebral experimental inducido por radiaciones ultravioletas. Med Clin (Barc) 1986; 87 (Supl 1): S5-8.
130. Cervós-Navarro J, Lafuente JV. Effect of cytidine diphosphate choline on ultraviolet-induced brain edema. Adv Neurol 1990; 52: 421-9.
131. Majem X, Bidón-Chanal A, Vilá-Badó J. Estudio de los efectos del tratamiento oral con CDP-colina sobre los cambios inducidos por el edema encefálico experimental en el electroencefalograma de la rata no anestesiada. Med Clin (Barc).1986; 87 (Supl 1): S23-5.
132. Roda JE. Répartition macro et microscopique día’un oedème cérébral vasogenique experimental. Symposium International: Souffrance cérébrale et précurseurs des phospholipids. Paris, 18.01.1980.
133. Schmidt K, Hernekamp JF, Doerr M, Zivkovic AR, Brenner T, Walther A, et al. Cytidine-5-diphosphocholine reduces microvascular permeability during experimental endotoxemia. BMC Anesthesiol 2015; 5: 114.
134. Hernekamp JF, Hu SX, Schmidt VJ, Vogelpohl J, Kneser U, Kremer T. Influence of Cdp-choline administration on early burn edema in rats. Ann Plast Surg 2015; 75: 388-92.
135. Farshad O, Keshavarz P, Heidari R, Farahmandnejad M, Azhdari S, Jamshidzadeh A. The potential neuroprotective role of citicoline in hepatic encephalopathy. J Exp Pharmacol 2020; 12: 517-27.
136. Dixon CE, Ma X, Marion DW. Effects of CDP-choline treatment on neurobehavioral deficits after TBI and on hippocampal and neocortical acetylcholine release. J Neurotrauma 1997; 14: 161-9.
137. Plataras C, Taskiris S, Angelogianni P. Effect of CDP-choline on brain acetylcholinesterase and Na+/K+-ATPase in adult rats. Clin Biochem 2000; 33: 351-7.
138. Baskaya MK, Dogan A, Rao AM, Dempsey RJ. Neuroprotective effects of citicoline on brain edema and blood-brain barrier breakdown after traumatic brain injury. J Neurosurg 2000; 92: 448-52.
139. Dempsey RJ, Rao VLR. Cytidinediphosphocholine treatment to decrease traumatic brain injury-induced hippocampal neuronal death, cortical contusion volume, and neurological dysfunction in rats. J Neurosurg 2003; 98: 867-73.
140. Menku A, Ogden M, Saraymen R. The protective effects of propofol and citicoline combination in experimental head injury in rats. Turk Neurosurg 2010; 20: 57-62.
141. Jacotte-Simancas A, Costa-Miserachs D, Coll-Andreu M, Torras-Garcia M, Borlongan C, Portell-Cortés I. Effects of voluntary physical exercise, citicoline, and combined treatment on object recognition memory, neurogenesis and neuroprotection after traumatic brain injury in rats. J Neurotrauma 2015; 32: 739-51.
142. Qian K, Gu Y, Zhao Y, Li Z, Sun M. Citicoline protects brain against closed head injury in rats through suppressing oxidative stress and calpain over-activation. Neurochem Res 2014; 39: 1206-18.
143. Gan D, Wu S, Chen B, Zhang J. Application of the zebrafish traumatic brain injury model in assessing cerebral inflammation. Zebrafish 2020; 17: 73-82.
144. Abdolmaleki A, Moghimi A, Ghayour MB, Rassouli MB. Evaluation of neuroprotective, anticonvulsant, sedative and anxiolytic activity of citicoline in rats. Eur J Pharmacol 2016; 789: 275-9.
145. Rasooli R, Pirsalami F, Moezi L. Posible involvement of nitric oxide in anticonvulsant effects of citicoline on pentylenetetrazole and electroshock induced seizures in mice. Heliyon 2020; 6: e03932.
146. Cakir E, Usul H, Peksoylu B, Sayin OC, Alver A, Topbas M, et al. Effects of citicoline on experimental spinal cord injury. J Clin Neurosci 2005; 12: 924-7.
147. Yucel N, Cayli SR, Ates O, Karadag N, Firat S, Turkoz Y. Evaluation of the neuroprotective effects of citicoline after experimental spinal cord injury: improved behavioral and neuroanatomical recovery. Neurochem Res 2006; 31: 767-75.
148. Coskun C, Avci B, Ocak N, Yalcin M, Dirican M, Savci V. Effect of repeatedly given CDP-choline on cardiovascular and tissue injury in spinal shock conditions: investigation of the acute phase. J Pharm Pharmacol 2010; 62: 497-506.
149. Turkkan A, Alkan T, Goren B, Kocaeli H, Akar E, Korfali E. Citicoline and postconditioning provides neuroprotection in a rat model of ischemic spinal cord injury. Acta Neurochir (Wien) 2010; 152: 1033-42.
150. Paulose CS, John PS, Chinthu R, Akhilraj PR, Anju TR. Spinal cord regeneration by modulating bone marrow with neurotransmitters and Citicholine: analysis at micromolecular level. Biomed J 2017; 40: 94-100.
151. Schuettauf F, Rejdak R, Thaler S, Bolz S, Lehaci C, Mankowska A, et al. Citicoline and lithium rescue retinal ganglion cells following partial optic nerve crush in the rat. Exp Eye Res. 2006; 83: 1128-34.
152. Kitamura Y, Bikbova G, Baba T, Yamamoto S, Oshitari T. In vivo effects of single or combined topical neuroprotective and regenerative agents on degeneration of retinal ganglion cells in rat optic nerve crush model. Sci Rep 2019; 9: 101.
153. Ozay R, Bekar A, Kocaeli H, Karli N, Filiz G, Ulus IH. Citicoline improves functional recovery, promotes nerve regeneration, and reduces postoperative scarring after peripheral nerve surgery in rats. Surg Neurol 2007; 68: 615-22.
154. Aslan E, Kocaeli H, Bekar A, Tolunay S, Ulus IH. CDP-choline and its endogenous metabolites, cytidine and choline, promote the nerve regeneration and improve the functional recovery of injured rat sciatic nerves. Neurol Res 2011; 33: 766-73.
155. Caner B, Kafa MI, Bekar A, Kurt MA, Karli N, Cansev M, et al. Intraperitoneal administration of CDP-choline or a combination of cytidine plus choline improves nerve regeneration and functional recovery in a rat model of sciatic nerve injury. Neurol Res 2012; 34: 238-45.
156. Kaplan T, Kafa IM, Cansev M, Bekar A, Karli N, Taskapilioglu MO, et al. Investigation of the dose-dependency of citicoline effects on nerve regeneration and functional recovery in a rat model of sciatic nerve injury. Turk Neurosurg 2014; 24: 54-62.
157. Gundogdu EB, Bekar A, Turkyilmaz M, Gumus A, Kafa IM, Cansev M. CDP-choline modulates matrix metalloproteinases in rat sciatic injury. J Surg Res 2016; 200: 655-63.
158. Samadian H, Ehterami A, Sarrafzadeh A, Khastar H, Nikbakht M, Rezaei A, et al. Sophisticated polycaprolactone/gelatin nanofibrous nerve guided conduit containing platelet-rich plasma and citicoline for peripheral nerve regeneration: in vitro and in vivo study. Int J Biol Macromol 2020; 150: 380-8.
159. Emril DR, Wibowo S, Meliala L, Susilowati R. Cytidine 5’-diphosphocholine administration prevents peripheral neuropathic pain after sciatic nerve crush injury in rats. J Pain Res 2016; 9: 287-91.
160. Ahlawat A, Sharma S. A new promising simultaneous approach for attenuating type II diabetes mellitus induced neuropathic pain in rats: iNOS inhibition and neuroregeneration. Eur J Pharmacol 2017 Nov 14; 818: 419-28.
161. Savran M, Bekar A, Cansev M, Tolunay S, Ulus IH, Taskapilioglu MO. Prevention of epidural fibrosis in rats by local or systemic administration of citicoline. Turk Neurosurg 2012; 22: 634-40.
162. Wang L, Rouleau DM, Beaumont E. Most effective adjuvant treatments after surgery in peripheral nerve laceration: systematic review of the literature on rodent models. Restor Neurol Neurosci 2013; 31: 253-62.
163. Galletti P, De Rosa M, Cotticelli MG, Morana A, Vaccaro R, Zappia V. Biochemical rationale for the use of CDPcholine in traumatic brain injury: pharmacokinetics of the orally administered drug. J Neurol Sci 1991; 103: 19-25.
164. Cohen MM. Biochemistry of cerebral anoxia, hypoxia and ischemia. Monograph in neural sciences. Vol. 1. Basilea: S. Karger; 1973.
165. Siesjö BK. Cell damage in the brain caused by ischemia. An overview. In Pharmacology of cerebral ischemia. J Krieglstein, ed. Amsterdam: Elsevier Science Publishers; 1986. p. 3-11.
166. Porcellati G, De Medio GE, Fini C, Floridi A, Goracci G, Horrocks LA, et al. Phospholipids and its metabolism in ischemia. Proc Eur Soc Neurochem 1978; 1: 285-302.
167. Boismare F, Le Poncin-Lafitte M, Rapin JR. Effets hémodynamiques, fonctionelles et biochimiques de l’hypoxie hypobare chez le rat traité par la cytidine diphosphocholine. C R Soc Biol 1978; 172: 651-8.
168. Boismare F, Le Poncin-Lafitte M. Influence día’un traitement par la citidoline sur les effets hémodynamiques de l’hypoxie normobare dans le chien. C R Soc Biol 1978; 172: 659-63.
169. Boismare F, Le Poncin M, Lefrançois J, Lecordier JC. Action of cytidine diphosphocholine on functional and hemodynamic effects of cerebral ischemia in cats. Pharmacology 1978; 17: 15-20.
170. Alberghina M, Viola M, Serra I, Mistretta A, Giuffrida AM. Effect of CDP-choline on the biosynthesis of phospholipids in brain regions during hypoxic treatment. J Neurosci Res 1981; 6: 421-33.
171. Serra I, Alberghina M, Viola M, Mistretta A, Giuffrida AM. Effects of CDP-choline on the biosynthesis of nucleic acids and proteins in brain regions during hypoxia. Neurochem Res 1981; 6: 607-18.
172. Horrocks LA, Dorman RV, Dabrowiecki Z, Goracci G, Porcellati G. CDPcholine and CDPethanolamine prevent the release of free fatty acids during brain ischemia. Prog Lipid Res 1981; 20: 531-4.
173. Trovarelli G, De Medio GE, Dorman RV, Piccinin GL, Horrocks LA, Porcellati G. Effect of cytidine diphosphate choline (CDP-choline) on ischemia-induced alterations of brain lipid in the gerbil. Neurochem Res 1981; 6: 821-33.
174. Trovarelli G, De Medio GE, Montanini I. The influence of CDP-choline on brain lipid metabolism during ischemia. Il Farmaco 1982; 37: 663-8.
175. Dorman RV, Dabrowiecki Z, Horrocks LA. Effects of CDPcholine and CDPethanolamine on the alterations in rat brain lipid metabolism induced by global ischemia. J Neurochem 1983; 40: 276-9.
176. Suno M, Nagaoka A. Effect of CDP-choline on cerebral lipid metabolism following complete ischemia in rats. Yakuri to Chiryo 1985; 13: 165-70.
177. Murphy EJ, Horrocks LA. Mechanism of action of CDPcholine and CDPethanolamine on fatty acid release during ischemia of brain. In Bazan NG, ed. New trends in lipid mediators research, vol. 4. Lipid mediators in ischemic brain damage and experimental epilepsy. Basilea: Karger; 1990. p. 67-84.
178. Agut J, Ortiz JA. Effect of oral cytidine-(5’)-diphosphocholine (CDP-choline) administration on the metabolism of phospholipids in rat brain during normobaric hypoxia. In Wurtman R, Corkin SH, Growdon JH eds. Alzheimer’s disease: advances in basic research and therapies. Cambridge: Center for Brain Sciences and Metabolism Charitable Trust; 1987. p. 327-32.
179. D’Orlando KJ, Sandage BW. Citicoline (CDP-choline): mechanisms of action and effects in ischemic brain injury. Neurol Res 1995; 17: 281-4.
180. López-Coviella I, Clark WM, Warach S, Sandage B, Agut J, Ortiz JA, et al. CDP-choline (citicoline): potential mechanism of action and preliminary results in human stroke. In Goldstein LB, ed. Restorative neurology: advances in pharmacotherapy. Armonk, NY: Futura Publishing Co; 1998. p. 195-212.
181. Abad-Santos F, Gallego-Sandín S, Novalbos J, Gálvez-Múgica MA. Estado actual de la citicolina en la isquemia cerebral. Rev Neurol 2000; 30: 663-70.
182. Rao AM, Hatcher JF, Dempsey RJ. CDP-choline: Neuroprotection in transient forebrain ischemia of gerbils. J Neurosci Res 1999; 58: 697-705.
183. Rao AM, Hatcher JF, Dempsey RJ. Lipid alterations in transient forebrain ischemia: Possible new mechanisms of CDP-choline neuroprotection. J Neurochem 2000; 75: 2528-35.
184. Adibhatla RM, Hatcher JF, Dempsey RJ. Citicoline: neuroprotective mechanisms in cerebral ischemia. J Neurochem 2002; 80: 12-23.
185. Adibhatla RM, Hatcher JF. Citicoline mechanisms and clinical efficacy in cerebral ischemia. J Neurosci Res 2002; 70: 133-9.
186. Adibhatla RM, Hatcher JF. Citicoline decreases phospholipase A2 stimulation and hydroxyl radical generation in transient cerebral ischemia. J Neurosci Res 2003; 73: 308-15.
187. Adibhatla RM, Hatcher JF, Dempsey RJ. Phospholipase A2, hydroxyl radicals, and lipid peroxidation in transient cerebral ischemia. Antoxid Redox Signal 2003; 5: 647-54.
188. Adibhatla RM, Hatcher JF. Cytidine 5’-diphosphocholine (CDP-choline) in stroke and other CNS disorders. Neurochem Res 2005; 30: 15-23.
189. Adibhatla RM, Hatcher JF, Dempsey RJ. Cytidine-5’-diphosphocholine affects CTP-phosphocholine cytidylyltransferase and lyso-phosphatidylcholine after transient brain ischemia. J Neurosci Res 2004; 76: 390-6.
190. Adibhatla RM, Hatcher JF, Larsen EC, Chen X, Sun D, Tsao FHC. CDP-choline significantly restores the phosphatidylcholine levels by differentially affecting phospholipase A2 and CTP-phosphocholine cytidyltransferase after stroke. J Biol Chem 2006; 281: 6718-25.
191. Adibhatla RM, Hatcher JF, Tureyen K. CDP-choline liposomes provide significant reduction in infarction over free CDP-choline in stroke. Brain Res 2005; 1058: 193-7.
192. Tornos ME, Sacristán A, Ortiz JA. Pharmacological study of CDP-choline. Protection against toxicity in a model of experimental hypoxia. Arzneimittelforschung. 1983; 33: 1022-4.
193. Benzi G, Pastoris O, Villa RF. Pharmacobiological interventions of CDP-choline in hypoxia and aging of the brain. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 239-49.
194. Villa RF, Curti D, Polgatti M, Benzi G. Synaptosomes and mitochondria from rat brain cerebral cortex: In vivo interference on some enzymatic activities by SAMe and CDP-choline. J Neurosci Res 1982; 7: 341-7.
195. Narumi S, Nagaoka A. Effects of CDP-choline on the metabolism of monoamines in the brain of rats with experimental cerebral ischemia. Jpn Pharmacol Ther 1985; 13: 171-8.
196. Nagai Y, Nagaoka A. Effect of CDP-choline on glucose uptake into various brain regions in the cerebral ischemic rats. Jpn Pharmacol Ther 1985; 13: 235-9.
197. Kim JH, Choi BY, Kho AR, Lee SH, Jeong JH, Hong DK, et al. Acetylcholine precursor, citicoline (cytidine 5’-diphosphocholine), reduces hypoglycemia-induced neuronal death in rats. J Neuroendocrinol 2018; 30: e12567.
198. Hurtado O, Moro MA, Cárdenas A, Sánchez V, Fernández-Tome P, Leza JC, et al. Neuroprotection afforded by prior citicoline administration in experimental brain ischemia: effects on glutamate transport. Neurobiol Dis 2005; 18: 336-45.
199. Hurtado O, Pradillo JM, Fernández-López D, Morales JR, Sobrino T, Castillo J, et al. Delayed post-ischemic administration of CDP-choline increases EAAT2 association to lipid rafts and affords neuroprotection in experimental stroke. Neurobiol Dis 2008; 29: 123-31.
200. Hurtado O, Cardenas A, Pradillo JM, Morales JR, Ortego F, Sobrino T, et al. A chronic treatment with CDP-choline improves functional recovery and increases neuronal plasticity after experimental stroke. Neurobiol Dis 2007; 26: 105-11.
201. Zhao JJ, Liu Y, Chen XL, Liu JX, Tian YF, Zhang PB, et al. Effect of citicoline on spatial learning and memory of rats after focal cerebral ischemia. J South Med Univ 2006; 26: 174-6.
202. Kakihana M, Kato J, Narumi S, Nagaoka A. CDP-choline: distribution of radioactive CDP-choline and effect on glucose metabolism in the cerebral cortex of rats with 30-min cerebral ischemia. Jpn Pharmacol Ther 1985; 13: 241-53.
203. Kakihana M, Fukuda N, Suno M, Nagaoka A. Effects of CDP-choline on neurologic deficits and cerebral glucose metabolism in a rat model of cerebral ischemia. Stroke 1988; 19: 217-22.
204. Fukuda N, Ikeda K, Saji Y. Effects of CDP-choline in the rats with experimental cerebral ischemia. Jpn Pharmacol Ther 1985; 13: 219-27.
205. Nagaoka A. Effects of CDP-choline on neurological deficits in stroke-prone spontaneously hypertensive rats with experimental cerebral ischemia. Jpn Pharmacol Ther 1985; 13: 229-34.
206. Saligaut C, Boismare F. Tratamiento oral crónico con citidín-(5’)-difosfocolina de los efectos sobre el comportamiento y bioquímicos de una hipoxia. Med Clin (Barc) 1986; 87 (Supl 1): S19-22.
207. Barrachina M, Domínguez I, Ambrosio S, Secades J, Lozano R, Ferrer I. Neuroprotective effect of citicoline in 6-hydroxydopamine-lesioned rats and in 6-hydroxydopamine-treated SH-SY5Y human neuroblastoma cells. J Neurol Sci 2003; 215: 105-10.
208. Araki H, Karasawa Y, Nojiri M, Aihara H. Effect of various classes of drugs on complete ischemia induced by decapitation and cyanide intoxication in mice. Methods Find Exp Clin Pharmacol 1988; 10: 349-56.
209. Aronowski J, Strong R, Grotta JC. Citicoline for treatment of experimental focal ischemia: histologic and behavioral outcome. Neurol Res 1996; 18: 570-4.
210. Schäbitz WR, Weber J, Takano K, Sandage BW, Locke KW, Fisher M. The effects of prolonged treatment with citicoline in temporary experimental focal ischemia. J Neurol Sci 1996; 138: 21-5.
211. Andersen M, Overgaard K, Meden P, Boysen G, Choi SC. Effects of citicoline combined with thrombolytic therapy in a rat embolic stroke model. Stroke 1999; 30: 1464-71.
212. Díez-Tejedor E, Gutierrez M, Carceller F, Roda JM, Alonso M. Treatment with reperfussion and neuroprotection with low and high dose of citicoline in an experimental model of focal cerebral ischemia. Which is the best? 5th WSC, Vancouver, Canada, 2004.
213. Alonso de Leciñana M, Gutierrez M, Roda JM, Carceller F, Diez-Tejedor E. Effect of combined therapy with thrombolysis and citicoline in a rat model of embolic stroke. J Neurol Sci 2006; 247: 121-9.
214. Gutiérrez-Fernández M, Leciñana MA, Rodríguez-Frutos B, Ramos-Cejudo J, Roda JM, Díez-Tejedor E. CDP-choline at high doses is as effective as i.v. thrombolysis in experimental animal stroke. Neurol Res 2012; 34: 649-56.
215. Shuaib A, Yang Y, Li Q. Evaluating the efficacy of citicoline in embolic ischemic stroke in rats: Neuroprotective effects when used alone or in combination with urokinase. Exp Neurol 2000; 161: 733-9.
216. Önal MZ, Li F, Tatlisumak T, Locke KW, Sandage BW, Fisher M. Synergistic effects of citicoline and MK-801 in temporary experimental focal ischemia in rats. Stroke 1997; 28: 1060-5.
217. Schäbitz WR, Li F, Irie K, Sandage BW, Locke KW, Fisher M. Synergistic effects of a combination of low-dose basic fibroblast growth factor and citicoline after temporary experimental focal ischemia. Stroke 1999; 30: 427-32.
218. Ataus SA, Onal MZ, Ozdem SS, Locke KW, Balkan S. The effects of citicoline and lamotrigine alone and in combination following permanent middle cerebral artery occlusion in rats. Int J Neurosci 2004; 114: 183-96.
219. Sobrado M, López MG, Carceller F, García AG, Roda, JM. Combined nimodipine and citicoline reduce infarct size, attenuate apoptosis and increase Bcl-2 expression after focal cerebral ischemia. Neuroscience 2003; 118: 107-13.
220. Qin HZ, Wang JL, Li LH, Bai WS, Zhao ZW, Gao GD. Neuroprotective effect of the combination of nimodipine and citicoline on focal cerebral ischemia-reperfusion rats. Chin J Cerebrovasc Dis 2009; 6: 29-32.
221. Pramila B, Kalaivani P, Barathidasan R, Saravana Babu C. Combination of Citicoline and L-NAME restores neurological functions, reverts biochemical alterations and reduces neuronal damage in transient focal cerebral ischemic rats. Indian J Sci Technol 2015; 8: 804-13.
222. Davinelli S, Chiosi F, Di Marco R, Costagliola C, Scapagnini G. Cytoprotective effects of citicoline and homotaurine against glutamate and high glucose neurotoxicity in primary cultured retinal cells. Oxid Med Cell Longev 2017; 2017: 2825703.
223. Nakazaki E, Yabuki Y, Izumi H, Shinoda Y, Watanabe F, Hishida Y, et al. Combined citicoline and docosahexaenoic acid treatment improves cognitive dysfunction following transient brain ischemia. J Pharmacol Sci 2019; 139: 319-324.
224. Gupta V, Bader ZE, Aakriti, Kumar A. Possible pharmacodynamic interaction of azelnidipine with citicoline against ischemic brain injury: behavioral, biochemical and histological alterations. Ann Neurosci 2020; 27: 9-17.
225. Ebrahimi S, Ashkani Esfahani S, Ebrahimi A. Comparison of the effects of citicoline and piracetam on hypoxic-ischemic brain damage in neonatal rabbits. Iran J Child Neurol 2022; 16: 77-84.
226. Sahin S, Alkan T, Temel SG, Tureyen K, Tolunay S, Korfali E. Effects of citicoline used alone and in combination with mild hypothermia on apoptosis induced by focal cerebral ischemia in rats. J Clin Neurosci 2010; 17: 227-31.
227. González-Pacheco H, Méndez-Domínguez A, Hernández S, López-Marure R, Vazquez-Mellado MJ, Aguilar C, et al. Pre-conditioning with CDP-choline attenuates oxidative stress-induced cardiac myocyte death in a hypoxia/reperfusion model. ScientificWorldJournal. 2014; 2014: 187071.
228. Zazueta C, Buelna-Chontal M, Macías-López A, Román-Anguiano NG, González-Pacheco H, Pavón N, et al. CDP-choline protects liver from ischemia/reperfusion injury preserving mitochondrial function and reducing oxidative stress. Liver Transpl 2018; 24: 1070-83.
229. Gutiérrez M, Rodríguez B, Álvarez J, Expósito M, Vallejo M, Merino J, et al. Effects of citicoline and mesenchymal stem cells in acute cerebral infarct. Experimental study in rats. European Stroke Conference, Barcelona (Spain), May 2010.
230. Gutiérrez-Fernández M, Rodríguez-Frutos B, Fuentes B, Vallejo-Cremades MT, Álvarez-Grech J, Expósito-Alcaide M, et al. CDP-choline treatment induces brain plasticity markers expression in experimental animal stroke. Neurochem Int 2011; 60: 310-7.
231. Diederich K, Frauenknecht K, Minnerup J, Schneider BK, Schmidt A, Altach E, et al. Citicoline enhances neuroregenerative processes after experimental stroke in rats. Stroke 2012; 43: 1931-40.
232. Krupinski J, Abudawood M, Matou-Nasri S, Al-Baradie R, Petcu E, Justicia C, et al. Citicoline induces angiogenesis improving survival of vascular/human brain microvessel endothelial cells through pathways involving ERK1/2 and insulin receptor substrate-1. Vasc Cell 2012; 4: 20.
233. Bramanti V, Tomassoni D, Grasso S, Bronzi D, Napoli M, Campisi A, et al. Cholinergic precursors modulate the expression of heme oxigenase-1, p21 during astroglial cell proliferation and differentiation in culture. Neurochem Res 2012; 37: 2795-804.
234. Fresta M, Puglisi G, Di Giacomo C, Russo A. Liposomes as in-vivo carriers for citicoline: effects on rat cerebral post-ischemic reperfusion. J Pharm Pharmacol 1994; 46: 974-81.
235. Fresta M, Puglisi G. Biological effects of CDP-choline loaded long circulating liposomes on rat cerebral post-ischemic reperfusion. Int J Pharmac 1996; 134: 89-97.
236. Fresta M, Puglisi G. Survival rate improvement in a rat ischemia model by long circulating liposomes containing cytidine-5’-diphosphate choline. Life Sci 1997; 61: 1227-35.
237. Fresta M, Puglisi G. Reduction of maturation phenomenon in cerebral ischemia with CDP-choline-loaded liposomes. Pharmaceut Res 1999; 16: 1843-9.
238. Ramos-Cabrer P, Agulla J, Argibay B, Pérez-Mato M, Castillo J. Serial MRI study of the enhanced therapeutic effects of liposome-encapsulated citicoline in cerebral ischemia. Int J Pharm 2011; 405: 228-33.
239. Ghosh S, Das N, Mandal AK, Dungdung SR, Sarkar S. Mannosylated liposomal cytidine 5’ diphosphocholine prevent age related global moderate cerebral ischemia reperfusion induced mitochondrial cytochrome c release in aged rat brain. Neuroscience 2010; 171: 1287-99.
240. Liu H, Jablonska A, Li Y, Cao S, Liu D, Chen H, et al. Label-free CEST MRI Detection of Citicoline-Liposome Drug Delivery in Ischemic Stroke. Theranostics 2016; 6: 1588-600.
241. Xu F, Hongbin Han, Yan J, Chen H, He Q, Xu W, et al. Greatly improved neuroprotective efficiency of citicoline by stereotactic delivery in treatment of ischemic injury. Drug Deliv 2011; 18: 461-7.
242. Pradhan D, Tambe V, Raval N, Gondalia P, Bhattacharya P, Kalia K, et al. Dendrimer grafted albumin nanoparticles for the treatment of post cerebral stroke damages: a proof of concept study. Colloids Surf B Biointerfaces 2019; 184: 110488.
243. Han H, Xia Z, Chen H, Hou C, Li W. Simple diffusion delivery via brain interstitial route for the treatment of cerebral ischemia. Sci China Life Sci 2011; 54: 235-9.
244. Park CH, Kim YS, Noh HS, Cheon EW, Yang YA, Yoo JM, et al. Neuroprotective effect of citicoline against KA-induced neurotoxicity in the rat retina. Exp Eye Res 2005; 81: 350-8.
245. Han YS, Chung IY, Park JM, Yu JM. Neuroprotective effect of citicoline on retinal cell damage induced by kainic acid in rats. Korean J Ophthalmol 2005; 19: 219-26.
246. Park CH, Kim YS, Cheon EW, Noh HS, Cho CH, Chung IY, et al. Action of citicoline on rat retinal expression of extracellular-signal-regulated kinase (ERK1/2). Brain Res 2006; 1081: 203-10.
247. Park CH, Kim YS, Lee HK, Kim YH, Choi MY, Jung DE, et al. Citicoline reduces upregulated clusterin following kainic acid injection in the rat retina. Curr Eye Res 2007; 32: 1055-63.
248. Matteucci A, Varano M, Gaddini L, Mallozzi C, Villa M, Pricci F, et al. Neuroprotective effects of citicoline in in vitro models of retinal neurodegeneration. Int J Mol Sci 2014; 15: 6286-97.
249. Komnatska KM, Khodakivska OV, Chereshniuk IL, Khodakivskyi OA. Experimental evaluation of melatonin, citicoline, corvitin and thiotriazoline effect on microcirculation in the vessels of the ciliary body of rabbits under eye contusion according to laser doppler flowmetry. Med Clin Chem 2017; 19: 88-94.
250. Bogdanov P, Sampedro J, Solà-Adell C, Simó-Servat O, Russo C, Varela-Sende L, et al. Effects of liposomal formulation of citicoline in experimental diabetes-induced retinal neurodegeneration. Int J Mol Sci 2018; 19: 2458.
251. Hamdorf G, Cervós-Navarro J. Study of the effects of oral administration of CDP-choline on open-field behaviour under conditions of chronic hypoxia. Arzneimittelforschung 1990; 40: 519-22.
252. Hamdorf G, Cervós-Navarro J. Therapeutic effect of orally applied cytidine diphosphate choline in mild and severe degrees of normobaric and normocapnic degrees of hypoxia of rats. Arzneimittelforschung 1991; 41: 1206-10.
253. Lee HJ, Kang JS, Kim YI. Citicoline protects against cognitive impairment in a rat model of chronic cerebral hypoperfusion. J Clin Neurol 2009; 5: 33-8.
254. Ma X, Zhang H, Pan Q, Zhao Y, Chen J, Zhao B, Chen Y. Hypoxia/aglycemia-induced endothelial barrier dysfunction and tight junction protein downregulation can be ameliorated by citicoline. PLoS One 2013; 8: e82604.
255. Hernández-Esquivel L, Pavón N, Buelna-Chontal M, González-Pacheco H, Belmont J, Chávez E. Citicoline (CDP-choline) protects myocardium from ischemia/reperfusion injury via inhibiting mitochondrial permeability transition. Life Sci 2014; 96: 53-8.
256. Hernández-Esquivel L, Pavón N, Buelna-Chontal M, González-Pacheco H, Belmont J, Chávez E. Cardioprotective properties of citicoline against hyperthyroidism-induced reperfusion damage in rat hearts. Biochem Cell Biol 2015; 93: 1-7.
257. Yildirim T, Eylen A, Lule S, Erdener SE, Vural A, Karatas H, et al. Poloxamer-188 and citicoline provide neuronal membrane integrity and protect membrane stability in cortical spreading depression. Int J Neurosci 2015; 125: 941-6.
258. Hurtado O, Hernández-Jiménez M, Zarruk JG, Cuartero MI, Ballesteros I, Camarero G, et al. Citicoline (CDP-choline) increases Sirtuin1 expression concomitant to neuroprotection in experimental stroke. J Neurochem 2013; 126: 819-26.
259. Masi I, Giani E, Galli C. Effects of CDP-choline on platelet aggregation and the antiaggregatory activity of arterial wall in the rat. Pharmacol Res Commun 1986; 18: 273-81.
260. Pinardi G, Pelissier T, Kramer V, Paeile C, Miranda HF. Effects of CDP-choline on acetylcholine-induced relaxation of the perfused carotid vascular beds of the rat. Gen Pharmacol 1994; 25: 635-8.
261. Clark W, Gunion-Rinker L, Lessov N, Hazel K. Citicoline treatment for experimental intracerebral hemorrhage in mice. Stroke 1998; 29: 2136-40.
262. Kermer P, Klocker N, Bahr M. Neuronal death after brain injury - Models, mechanisms, and therapeutic strategies in vivo. Cell Tissue Res 1999; 298: 383-95.
263. Banasiak KJ, Xia Y, Haddad GG. Mechanisms underlying hypoxia-induced neuronal apoptosis. Prog Neurobiol 2000; 62: 215-49.
264. Kuschinsky W, Gillardon F. Apoptosis and cerebral ischemia. Cerebrovasc Dis 2000; 110: 165-9.
265. Mattson MP, Culmsee C, Yu ZF. Apoptotic and antiapoptotic mechanisms in stroke. Cell Tissue Res 2000; 301: 173-87.
266. Harrison DC, Davis RP, Bond BC, Campbell CA, James MF, Parsons AA, et al. Caspase mRNA expression in a rat model of focal cerebral ischemia. Mol Brain Res 2001; 89: 133-46.
267. Love S, Barber R, Srinivasan A, Wilcock GK. Activation of caspase-3 in permanent and transient brain ischaemia in man. Neuroreport 2000; 11: 2495-9.
268. Love S, Barber R, Wilcock GK. Neuronal death in brain infarcts in man. Neuropathol Appl Neurobiol 2000; 26: 55-66.
269. Krupinski J, Ferrer I, Barrachina M, Secades JJ, Mercadal J, Lozano R. CDP-choline reduces pro-caspase and cleaved caspase-3 expression, nuclear DNA fragmentation, and specific PARP-cleaved products of caspase activation following middle cerebral artery occlusion in the rat. Neuropharmacology 2002; 42: 846-54.
270. Pramila B, Kalaivani P, Barathidasan R, Saravana Babu C. Preischemic administration of citicoline exerts better neuroprotection and restores neurochemical and motor functions in MCAO/R rats. Int J Pharm Bio Sci 2015; 6: 1462-76.
271. Krupinski J, Slevin M, Badimon L. Citicoline inhibits MAP kinase signalling pathways after focal cerebral ischaemia. Neurochem Res 2005; 30: 1067-73.
272. Mir C, Clotet J, Aledo R, Durany N, Argemí J, Lozano R, et al. CDP-choline prevents glutamate-mediated cell death in cerebellar granule neurons. J Mol Neurosci 2003; 20: 53-9.
273. Barrachina M, Secades J, Lozano R, Gómez-Santos C, Ambrosio S, Ferrer I. Citicoline increases glutathione redox ratio and reduces caspase-3 activation and cell death in staurosporine-treated SH-SY5Y human neuroblastoma cells. Brain Res 2002; 957: 84-90.
274. Oshitari T, Fujimoto N, Adachi-Usami E. Citicoline has a protective effect on damaged retinal ganglion cells in mouse culture retina. Neuroreport 2002; 13: 2109-11.
275. Matyja E, Taraszewska A, Naganska E, Grieb P, Rafalowska J. CDP-choline protects motor neurons against apoptotic changes in a model of chronic glutamate excitotoxicity in vitro. Folia Neuropathol 2008; 46: 139-48.
276. Oshitari T, Yoshida-Hata N, Yamamoto S. Effect of neurotrophic factors on neuronal apoptosis and neurite regeneration in cultured rat retinas exposed to high glucose. Brain Res 2010; 1346: 43-51.
277. Fiedorowicz M, Makarewicz D, Stanczak-Mrozek KI, Grieb P. CDP-choline (citicoline) attenuates brain damage in a rat model of birth asphyxia. Acta Neurobiol Exp (Wars) 2008; 68: 389-97.
278. Bustamante A, Giralt D, Garcia-Bonilla L, Campos M, Rosell A, Montaner J. Citicoline in pre-clinical animal models of stroke: a meta-analysis shows the optimal neuroprotective profile and the missing steps for jumping into a stroke clinical trial. J Neurochem 2012; 123: 217-25.
279. Giralt D, García-Bonilla L, Campos M, Sosti V, Rosell A, Montaner J. Selecting the optimal dose of citicoline treatment in animal models of focal cerebral ischemia through a meta-analysis. European Stroke Conference, Barcelona (Spain), May 2010.
280. Drago F, Valerio C, D’Agata V, Spadaro F, Astuto C, Lauria N, et al. Razionale farmacologico dell’impiego della CDP-colina nelle cerebrovasculopatie croniche. Ann Ital Med Int 1989; 4: 261-7.
281. Qureshi I, Endres JR. Citicoline: a novel therapeutic agent with neuroprotective, neuromodulatory, and neuroregenerative properties. Natural Medicine Journal 2010; 2: 11-25.
282. Saver JL. Target brain: neuroprotection and neurorestoration in ischemic stroke. Rev Neurol Dis 2010; 7 (Suppl 1): S14-21.
283. Alvarez-Sabin J, Roman GC. The role of citicoline in neuroprotection and neurorepair in ischemic stroke. Brain Sci 2013; 3: 1395-414.
284. Jambou R, El-Assaad F, Combes V, Grau GE. Citicoline (CDP-choline): what role in the treatment of complications of infectious diseases. Int J Biochem Cell Biol 2009; 41: 1467-70.
285. El-Assaad F, Combes V, Grau GE, Jambou R. Potential efficacy of citicoline as adjunct therapy in the treatment of cerebral malaria. Antimicrob Agents Chemother 2013; 58: 602-5.
286. Abdel-Aziz N, Moustafa EM, Saada HN. The impact of citicoline on brain injury in rats subjected to head irradiation. Environ Sci Pollut Res Int 2021; 28: 9742-9752.
287. Martinet M, Fonlupt P, Pacheco H. Effects of cytidine-5’ diphosphocholine on norepinephrine, dopamine and serotonin synthesis in various regions of the rat brain. Arch Int Pharmacodyn 1979; 239: 52-61.
288. Martinet M, Fonlupt P, Pacheco H. Interaction of CDP-choline with synaptosomal transport of biogenic amines and their precursors in vitro and in vivo in the rat corpus striatum. Experientia 1978; 34: 1197-9.
289. Martinet M, Fonlupt P, Pacheco H. Activation of soluble striatal tyrosine hydroxylase in the rat brain after CDPcholine administration. Biochem Pharmacol 1981; 30: 539-41.
290. Saligaut C, Daoust M, Moore N, Chretien P, Boismare F. Capture de dopamine striatale chez le rat: effets día’une hypoxie hypobare aigüe et/ou día’un traitement oral par la cytidine diphosphocholine. Circ Metab Cerv 1984; 2: 33-42.
291. Saligaut C, Daoust M, Chadelaud M, Moore N, Chretien P, Boismare F. Oxotremorine-induced cholinergic syndrome: modifications by levodopa and/or oral cytidine diphosphocholine. Methods Find Exp Clin Pharmacol 1985; 7: 5-8.
292. Saligaut C, Daoust M, Moore N, Boismare F. Effects of hypoxia and cytidine (5’) diphosphocholine on the concentration of dopamine, norepinephrine and metabolites in rat hypothalamus and striatum. Arch Int Pharmacodyn 1987; 285: 25-33.
293. Saligaut C, Daoust M, Moore N, Boismare F. Circling behaviour in rats with unilateral lesions of the nigrostriatum induced by 6-hydroxydopamine: changes induced by oral administration of cytidine-5’-diphosphocholine. Neuropharmacology 1987; 26: 1315-9.
294. Kashkin VA, Shekunova EV, Makarova MN, Makarov VG. [A study of combination treatment with nacom (levodopa + carbodope) and citicoline in the model of Parkinson disease in rats]. Zh Nevrol Psikhiatr Im S S Korsakova 2017; 117: 59-63.
295. Cansev M, Ilcol YO, Yilmaz MS, Hamurtekin E, Ulus IH. Peripheral administration of CDP-choline, phosphocholine or choline increases plasma adrenaline and noradrenaline concentrations. Auton Autacoid Pharmacol 2008; 28: 41-58.
296. Tayebati SK, Tomassoni D, Nwankwo IE, Di Stefano A, Sozio P, Cerasa LS, et al. Modulation of monoaminergic transporters by choline-containing phospholipids in rat brain. CNS Neurol Disord Drug Targets 2013; 12: 94-103.
297. Tayebati SK, Tomassoni D, Di Stefano A, Sozio P, Cerasa LS, Amenta F. Effect of choline-containing phospholipids on brain cholinergic transporters in the rat. J Neurol Sci 2011; 302: 49-57.
298. Agut J, López G-Coviella I, Wurtman RJ. Cytidine(5’)diphosphocholine enhances the ability of haloperidol to increase dopamine metabolites in the striatum of the rat and to diminish stereotyped behavior induced by apomorphine. Neuropharmacology 1984; 23: 1403-6.
299. Agut J, Font E, Saladrich JM, Sacristán A, Ortiz JA. Acción de la CDP-colina sobre los niveles de los ácidos homovanílico (HVA) y 3-4-dihidroxifenilacético (DOPAC) en estriado de rata. Med Clin (Barc) 1986; 87 (Supl 1): S9-10.
300. Agut J, Font E, Sacristán A, Ortiz JA. Acción de la CDP-colina sobre la hipotermia inducida por la apomorfina en ratas. Med Clin (Barc) 1986; 87 (Supl 1): S11-13.
301. Agut J, Font E, Saladrich JM, Sacristán A, Ortiz JA. Acción farmacológica de la CDP-colina oral en un modelo de discinesia tardía en rata. Med Clin (Barc) 1986; 87 (Supl 1): 14-8.
302. Agut J, Font E, Saladrich JM, Sacristán A, Ortiz JA. Effect of oral CDP-choline on acrylamide-induced lesion. Arzneimittelforschung 1983; 33: 1029-33.
303. Shibuya M, Kageyama N, Taniguchi T, Hidaka H, Fujiwara M. Effects of CDP-choline on striatal dopamine level and behavior in rats. Jpn J Pharmacol 1981; 31: 47-52.
304. Stanzani S. Morphological effects of cytidin-diphosphate-choline on rats with lesions of the substantia nigra: study using horse radish peroxidase method. Boll Soc It Biol Sper 1980; 57: 1830-4.
305. Porceddu ML, Concas A. Partial protection by CDP-choline against kainic acid-induced lesion in the rat caudate nucleus. Il Farmaco 1985; 40: 617-22.
306. Jiang XY, Jia XJ, Lu WT, Zhao HG, Wang ZC, Gong SL. Neuroprotective effects of citicoline on 6-hydroxydopamine-treated mesencephalic dopaminergic neurons in primary culture. J Jilin Univ (Med Ed) 2006; 32: 224-7.
307. Jia XJ, Gong SL, Jiang XY, Qu YQ, Wolf-Dieter R. Neuroprotective effect of citicoline on dopaminergic neuron injury induced by MPP+ in mouse mesencephalic dissociated culture. J Jilin University (Med Ed) 2008; 34: 53-6.
308. Radad K, Gille G, Xiaojing J, Durany N, Rausch WD. CDP-choline reduces dopaminergic cell loss induced by MPP(+) and glutamate in primary mesencephalic cell culture. Int J Neurosci 2007; 117: 985-98.
309. Miwa S, Taniguchi T, Fujiwara M, Kurahashi K, Fujiwara M. Pharmacological studies on CDP-choline with special reference to effects on striatal dopaminergic mechanisms. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 179-94.
310. Giménez R, Raïch J, Aguilar J. Changes in brain striatum dopamine and acethylcholine receptors induced by chronic CDP-choline treatment in aging mice. Br J Pharmacol 1991; 104: 575-8.
311. Petkov VD, Popova JS. Effects of the nootropic agents adafenoxate, meclofenoxate and the acetylcholine precursor citicholine on the brain muscarinic receptors (experiments on rats). Acta Physiol Pharmacol Bulg 1987; 13: 3-10.
312. Petkov VD, Stancheva SL, Tocuschieva L, Petkov VV. Changes in brain biogenic monoamines induced by the nootropic drugs adafenoxate and meclofenoxate and by citicholine (experiments on rats). Gen Pharmac 1990; 21: 71-5.
313. Rejdak R, Toczolowski J, Solski J, Duma D, Grieb P. Citicoline treatment increases retinal dopamine content in rabbits. Ophthalmic Res 2002; 34: 146-9.
314. Mao J, Liu S, Fu C. Citicoline retards myopia progression following form deprivation in guinea pigs. Exp Biol Med (Maywood) 2016; 241: 1258-1263.
315. López G-Coviella I, Agut J, Wurtman RJ. Effect of cytidine(5’)diphosphocholine (CDP-choline) on the total urinary excretion of 3-methoxy-4-hydroxyphenylglycol (MHPG) by rats and humans. J Neural Transm 1986; 66: 129-34.
316. Agut J, Watkins C, Maher T, Ortiz JA, Wurtman RJ. Oral CDP-choline administration to rats increases glutamate and decreases GABA cortical brain levels. 27th Annual Meeting of the Society of Neuroscience (Oct 25-30, New Orleans), 1997.
317. Cavun S, Savci V, Ulus IH. Centrally injected CDP-choline increases plasma vasopressin levels by central cholinergic activation. Fundam Clin Pharmacol 2004; 18: 71-7.
318. Cavun S, Savci V. CDP-choline increases plasma ACTH and potentiates the stimulated release of GH, TSH and LH: the cholinergic involvement. Fundam Clin Pharmacol 2004; 18: 513-23.
319. Eyigor O, Coskun C, Cavun S, Savci V. Intravenous CDP-choline activates neurons in supraoptic and paraventricular nuclei and induces hormone secretion. Brain Res Bull 2012; 87: 286-94.
320. Savci V, Cavun S, Goktalay G, Ulus IH. Cardiovascular effects of intracerebroventricularly injected CDP-choline in normotensive and hypotensive animals: the involvement of cholinergic system. Naunyn Schmiedebergs Arch Pharmacol 2002; 365: 388-98.
321. Savci V, Goktalay G, Cansev M, Cavun S, Yilmaz MS, Ulus IH. Intravenously injected CDP-choline increases blood pressure and reverses hypotension in haemorrhagic shock: effect is mediated by central cholinergic activation. Eur J Pharmacol 2003; 468: 129-39.
322. Yilmaz MS, Yalcin M, Savci V. Cytidine 5’-diphosphocholine restores blood flow of superior mesenteric and renal arteries and prolongs survival time in haemorrhaged anaesthetized rats. Clin Exp Pharmacol Physiol 2006; 33: 415-20.
323. Amin SN, Khashaba AS, Latif NSA, El Gazzar WB, Hussein UK. Citicoline improved cardiovascular function in animal model of dysautonomia. J Physiol Pharmacol 2021; 72: 69-80.
324. Jochem J, Savci V, Filiz N, Rybus-Kalinowska B, Fogel WA, Yalcin M. Involvement of the histaminergic system in cytidine 5’-diphosphocholine-induced reversal of critical heamorrhagic hypotension in rats. J Physiol Pharmacol 2010; 61: 37-43.
325. Cansev M, Yilmaz MS, Ilcol YO, Hamurtekin E, Ulus IH. Cardiovascular effects of CDP-choline and its metabolites: Involvement of peripheral autonomic nervous system. Eur J Pharmacol 2007; 577: 129-42.
326. Yilmaz MS, Coskun C, Yalcin M, Savci V. CDP-choline prevents cardiac arrhythmias and lethality induced by short-term myocardial ischemia-reperfusion injury in the rat: involvement of central muscarinic cholinergic mechanisms. Naunyn Schmiedebergs Arch Pharmacol 2008; 378: 293-301.
327. Isbil-Buyukcoskun N, Ilcol YO, Cansev M, Hamurtekin E, Ozluk K, Ulus IH. Central choline suppresses plasma renin response to graded haemorrhage in rats. Clin Exp Pharmacol Physiol 2008; 35: 1023-31.
328. Yu H, Qing H, Lei Z. Cytidine diphosphate choline improves the outcome of cardiac arrest vs epinephrine in rat model. Am J Emerg Med 2013; 31: 1022-8.
329. Ilcol YO, Cansev M, Yilmaz MS, Hamurtekin E, Ulus IH. Intraperitoneal administration of CDP-choline and its cholinergic and pyrimidinergic metabolites induce hyperglycemia in rats: involvement of the sympathoadrenal system. Arch Physiol Biochem 2007; 113: 186-201.
330. Ilcol YO, Cansev M, Yilmaz MS, Hamurtekin E, Ulus IH. Peripheral administration of CDP-choline and its cholinergic metabolites increases serum insulin: muscarinic and nicotinic acetylcholine receptors are both involved in their actions. Neurosci Lett 2008; 431: 71-6.
331. Cansev M, Ilcol YO, Yilmaz MS, Hamurtekin E, Ulus IH. Choline, CDP-choline or phosphocholine increases plasma glucagon in rats: involvement of the peripheral autonomic nervous system. Eur J Pharmacol 2008; 589: 315-22.
332. Kiyici S, Basaran NF, Cavun S, Savci V. Central injection of CDP-choline suppresses serum ghrelin levels while increasing serum leptin levels in rats. Eur J Pharmacol 2015; 764: 264-70.
333. Villa RF, Ferrari F, Gorini A. Effect of CDP-choline on age-dependent modifications of energy- and glutamate-linked enzyme activities in synaptic and non-synaptic mitochondria from rat cerebral cortex. Neurochem Int 2012; 61: 1424-32.
334. Sbardella D, Coletta A, Tundo GR, Ahmed IMM, Bellia F, Oddone F, et al. Structural and functional evidence for citicoline binding and modulation of 20S proteasome activity: novel insights into its pro-proteostatic effect. Biochem Pharmacol 2020; 177: 113977.
335. Ilcol YO, Yilmaz Z, Cansev M, Ulus IH. Choline or CDP-choline alters serum lipid responses to endotoxin in dogs and rats: involvement of the peripheral nicotinic acetylcholine receptors. Shock 2009; 32: 286-94.
336. Uslu G, Savci V, Buyukuysal LR, Goktalay G. CDP-choline attenuates scopolamine induced disruption of prepulse inhibition in rats: involvement of central nicotinic mechanism. Neurosci Lett 2014; 569: 153-7.
337. Yilmaz Z, Ozarda Y, Cansev M, Eralp O, Kocaturk M, Ulus IH. Choline or CDP-choline attenuates coagulation abnormalities and prevents the development of acute disseminated intravascular coagulation in dogs during endotoxemia. Blood Coagul Fibrinolysis 2010; 21: 339-48.
338. Kocaturk M, Yilmaz Z, Cansev M, Ozarda Y, Ceron JJ, Buturak A, et al. Choline or CDP-choline restores hypotension and improves myocardial and respiratory functions in dogs with experimentally - Induced endotoxic shock. Res Vet Sci 2021; 141: 116-28.
339. Doolittle LM, Binzel K, Nolan KE, Craig K, Rosas LE, Bernier MC, et al. Cytidine 5’-diphosphocholine corrects alveolar type ii cell mitochondrial dysfunction in influenza-infected mice. Am J Respir Cell Mol Biol 2022; 66: 682-693.
340. Roohi-Azizi M, Torkaman-Boutorabi A, Akhondzadeh S, Nejatisafa AA, Sadat-Shirazi MS, Zarrindast MR. Influence of citicoline on citalopram-induced antidepressant activity in depressive-like symptoms in male mice. Physiol Behav 2018; 195: 151-7.
341. Khakpai F, Ramezanikhah M, Valizadegan F, Zarrindast MR. Synergistic effect between imipramine and citicoline upon induction of analgesic and antidepressant effects in mice. Neurosci Lett 2021; 760: 136095.
342. Hamurtekin E, Sibel Gurun M. The antinociceptive effects of centrally administered CDP-choline on acute pain models in rats: The involvement of cholinergic system. Brain Res 2006; 1117: 92-100.
343. Gurun MS, Parker R, Eisenach JC, Vincler M. The effect of peripherally administered CDP-choline in an acute inflammatory pain model: the role of alpha7 nicotinic acetylcholine receptor. Anesth Analg 2009; 108: 1680-7.
344. Kanat O, Bagdas D, Ozboluk HY, Gurun MS. Preclinical evidence for the antihyperalgesic activity of CDP-choline in oxaliplatin-induced neuropathic pain. J BUON 2013; 18: 1012-28.
345. Hamurtekin E, Bagdas D, Gurun MS. Possible involvement of supraspinal opioid and GABA receptors in CDP-choline-induced antinociception in acute pain models in rats. Neurosci Lett 2007; 420: 116-21.
346. Bagdas D, Sonat FA, Hamurtekin E, Sonal S, Gurun MS. The antihyperalgesic effect of cytidine-5’-diphosphate-choline in neuropathic and inflammatory pain models. Behav Pharmacol 2011; 22: 589-98.
347. Bagdas D, Yucel-Ozboluk H, Orhan F, Kanat O, Isbil-Buyukcoskun N, Gurun MS. Role of central arginine vasopressin receptors in the analgesic effect of CDP-choline on acute and neuropathic pain. Neuroreport 2013; 24: 941-6.
348. Kamei J, Ohsawa M, Miyata S, Endo K, Hayakawa H. Effects of cytidine 5’-diphosphocholine (CDP-choline) on the thermal nociceptive threshold in streptozotocin-induced diabetic mice. Eur J Pharmacol 2008; 598: 32-6.
349. Ahmadi A, Mohitmafi S, Abarkar A. Effects of citicoline sodium on corneal reflex, anesthesia and analgesia duration after thiopental sodium injection in dogs- A preliminary report. J Paramed Sci 2014; 5: 7-11.
350. Ahmadi A, Mohitmafi S. Effects of citicholine on respiration rate, Spo2, heart rate and rectal temperature during thiopental intravenous anaesthesia in canine model. J Paramedical Sci 2013; 4: 87-91.
351. Hassan ES, Rasoul A, Khadim HA. Assessment of citicoline protection against seizure induced in the rabbits. QMJ 2010; 6: 81-93.
352. Karpova MN, Zin’kovskii KA, Kuznetsova LV, Klishina NV. Increase of the seizure threshold in C57BL/6 mice after citicoline administration. Bull Exp Biol Med 2015; 158: 315-7.
353. Karpova MN, Kuznetsova LV, Zin’kovskii KA, Klishina NV. Anticonvulsant effects of combined treatment with citicoline and valproate on the model of acute generalized convulsions induced by pentylenetetrazole in wistar rats. Bull Exp Biol Med 2016; 160: 429-31.
354. Kim JH, Lee DW, Choi BY, Sohn M, Lee SH, Choi HC, et al. Cytidine 5’-diphosphocholine (CDP-choline) adversely effects on pilocarpine seizure-induced hippocampal neuronal death. Brain Res 2015; 1595: 156-65.
355. Bekhet MA, Ali AA, Kharshoum RM, El-Ela FIA, Salem HF. Intranasal niosomal in situ gel as a novel strategy for improving citicoline efficacy and brain delivery in treatment of epilepsy: in vitro and ex vivo characterization and in vivo pharmacodynamics investigation. J Pharm Sci 2022; 111: 2258-69.
356. Nashine S, Kenney MC. Role of Citicoline in an in vitro AMD model. Aging (Albany NY) 2020; 12: 9031-40.
357. Giménez R, Aguilar J. Effects of CDP-choline administration on brain striatum platelet- activating factor in aging rats. Eur J Pharmacol 1998; 344: 149-52.
358. Giménez R, Aguilar J. Cytidine (5’) diphosphocholine-induced decrease in cerebral platelet activating factor is due to inactivation of its synthesizing enzyme cholinephosphotransferase in aged rats. Neursoci Lett 2001; 299: 209-12.
359. Guldali O, Savci V, Buyukafsar K. CDP-choline-induced contractions in the mouse gastric fundus through purinoceptors and Rho/Rho-kinase signalling. Life Sci 2011; 88: 473-9.
360. Topuz BB, Altinbas B, Yilmaz MS, Saha S, Batten TF, Savci V, et al. The effect of centrally injected CDP-choline on respiratory system; involvement of phospholipase to thromboxane signaling pathway. Respir Physiol Neurobiol 2014; 195: 50-8.
361. Topuz BB, Altinbas B, Ilhan T, Yilmaz MS, Erdost H, Saha S, et al. Centrally administered CDP-choline induced cardiovascular responses are mediated by activation of the central phospholipase-prostaglandin signaling cascade. Brain Res 2014; 1563: 61-71.
362. Cetinkaya M, Cansev M, Cekmez F, Tayman C, Canpolat FE, Kafa IM, et al. CDP-choline reduces severity of intestinal injury in a neonatal rat model of necrotizing enterocolitis. J Surg Res 2013; 183: 119-28.
363. Cetinkaya M, Cansev M, Kafa IM, Tayman C, Cekmez F, Canpolat FE, et al. Cytidine 5’-diphosphocholine ameliorates hyperoxic lung injury in a neonatal rat model. Pediatr Res 2013; 74: 26-33.
364. Ek RO, Serter M, Ergin K, Cecen S, Unsal C, Yildiz Y, et al. Protective effects of citicoline on TNBS-induced experimental colitis in rats. Int J Clin Exp Med 2014; 7: 989-97.
365. Liang S, Li X, Xu J, Lai P, Bao Y, Wang K, et al. Protective effects of citicoline in neonatal rats with necrotizing enterocolitis. Pediatr Dimensions 2018; 3: 1-5.
366. Mehranfard D, Hamurtekin E. CDP-choline effect on arthritis model in rat. Pharm Res 2019; 3: 000174.
367. Drago F, Mauceri F, Nardo L, Valerio C, Genazzani AA, Grass, M. Effects of cytidine-diphosphocholine on acetylcholine-mediated behaviors in the rat. Brain Res Bull 1993; 31: 485-9.
368. Petkov VD, Mosharrof AH, Petkov VV. Comparative studies on the effects of nootropic drugs adafenoxate, meclofenoxate and piracetamn and of citicholine on scopolamine-impaired memory, exploratory behavior and physical capabilities (experiments on rats and mice). Acta Physiol Pharmacol Bulg 1988; 14: 3-13.
369. Mosharrof AH, Petkov VD. Effects of citicholine and of the combination citicholine + piracetam on the memory (experiments on mice). Acta Physiol Pharmacol Bulg 1990; 16: 25-31.
370. Takasaki K, Mishima K, Morita M, Morishita K, Nogami A, Sakamoto Y, et al. Citidine-5’diphosphocholine ameliorates the impairment of spatial memory induced by scopolamine. J Health Sci 2011; 57: 432-5.
371. Petkov VD, Kehayov RA, Mosharrof AH, Petkov VV, Getova D, Lazarova MB, et al. Effects of cytidine diphosphate choline on rats with memory deficits. Arzneimittelforschung 1993; 43: 822-8.
372. Alvarez XA, Vecino B, Perea JE, Daniele D, Cacabelos R. Citicoline antagonizes bromazepam-induced amnesia in rats. Human Psychopharmacol 1997; 12: 547-56.
373. Bruhwyler J, Liegeois JF, Géczy J. Facilitatory effects of chronically administered citicoline on learning and memory processes in the dog. Prog Neuropsychopharmacol Biol Psychiatry 1998; 22: 115-28.
374. Teather LA, Wurtman RJ. Dietary cytidine (5’)-diphosphocholine supplementation protects against development of memory deficits in aging rats. Prog Neuropsychopharmacol Biol Psychiatry 2003; 27: 711-7.
375. Teather LA, Wurtman RJ. Dietary CDP-choline supplementation prevents memory impairment caused by impoverished environmental conditions in rats. Learn Mem 2005; 12: 39-43.
376. Teather LA, Wurtman RJ. Dietary CDP-choline supplementation prevents memory impairment caused by impoverished environmental conditions in rats. Learn Mem 2005; 12: 39-43.
377. Ahmad F, Nayak V, Malalur C, Mathew R, Tripathy A, Bairy KL. Relative efficacy of piracetam, modafinil and citicoline on cognitive function in an animal model. JCDR 2017; 11: FC01-3.
378. Abdel-Zaher AO, Hamdy MM, Abdel-Rahman MS, Abd El-Hamid DH. Protective effect of citicoline against aluminum-induced cognitive impairments in rats. Toxicol Ind Health 2017; 33: 308-17.
379. Hosseini-Sharifabad A, Rabbani M, Seyed-Yousefi Y, Safavi M. Magnesium increases the protective effect of citicoline on aluminum chloride-induced cognitive impairment. Clin Psychopharmacol Neurosci 2020; 18: 241-8.
380. Cakir A, Ocalan B, Koc C, Suyen GG, Cansev M, Kahveci N. Effects of CDP-choline administration on learning and memory in REM sleep-deprived rats. Physiol Behav 2020; 213: 112703.
381. Safavi M, Hosseini-Sharifabad A, Seyed-Yousefi Y, Rabbani M. Protective effects of citicoline and benfotiamine each alone and in combination on streptozotocin-induced memory impairment in mice. Clin Psychopharmacol Neurosci 2020; 18: 81-92.
382. De Bruin NM, Kiliaan AJ, De Wilde MC, Broersen LM Combined uridine and choline administration improves cognitive deficits in spontaneously hypertensive rats. Neurobiol Learn Mem 2003; 80: 63-79.
383. De Medio GE, Trovarelli G, Piccinin GL, Porcellati G. The effect of cytidine-diphosphate choline (CDP-choline) on brain lipid changes during aging. J Neurosci Res 1984; 11: 49-58.
384. López G-Coviella I, Agut J, Ortiz JA, Wurtman RJ. Effects of orally administered cytidine 5’-diphosphate choline on brain phospholipid content. J Nutr Biochem 1992 3: 313-5.
385. Wang CS, Lee RKK. Choline plus cytidine stimulate phospholipid production, and the expression and secretion of amyloid precursor protein in rat PC12 cells. Neurosci Lett 2000; 283: 25-8.
386. Plataras C, Angelogianni P, Tsakiris S. Effect of CDP-choline on hippocampal acetylcholinesterase and Na+,K+-ATPase in adult and aged rats. Z Naturforsch 2003; 58: 277-81.
387. Zhang LN, Sun YJ, Pan S, Li JX, Qu YE, Li Y et al. Na(+) -K(+) -ATPase, a potent neuroprotective modulator against Alzheimer disease. Fundam Clin Pharmacol 2013; 27: 96-103.
388. Giménez R, Soler S, Aguilar J. Cytidine diphosphate choline administration activates brain cytidine triphosphate: phosphocholine cytidyltransferase in aged rats. Neurosci Lett 1999; 273: 163-6.
389. Giménez R, Aguilar J. Effects of cytidine 5’-diphosphocholine on plasma homocysteine levels in rat. Comp Biochem Physiol B Biochem Mol Biol 2003; 134: 271-6.
390. Giuffrida Stella AM, Alberghina M, Avola R, Condorelli DF, Ragusa N, Turpeenoja L et al. Effetto della somministrazione cronica di CDP-colina sul metabolismo degli acidi nucleici e delle proteine in diverse aree cerebrali durante l’invecchiamento. G Gerontol. 1988; 36: 331-40.
391. Avola R, Villa R, Condorelli DF, Magri G, Ingrao F, Turpeenoja L, et al. Age-dependent changes on nucleic acid and protein metabolism in different brain regions: Effect of CDP-choline treatment. In Regulation of gene expression in the nervous system. Hoboken: Wiley-Liss; 1990. p. 399-401.
392. Villa RF, Ingrao F, Magri G, Gorini A, Reale S, Costa A, et al. Effect of CDP-choline treatment on mitochondrial and synaptosomal protein composition in different brain regions during aging. Int J Devl Neurosci 1993; 11: 83-93.
393. Deutsch SI, Rosse RB, Schwartz BL, Schooler NR, Gaskins BL, Long KD, et al. Effects of CDP-choline and the combination of CDP-choline and galantamine differ in an animal model of schizophrenia: development of a selective alpha(7) nicotinic acetylcholine receptor agonist strategy. Eur Neuropsychopharmacol 2008; 18: 147-51.
394. Petkov VD, Milanov S, Petkov VV. Effects of CDP-choline and the nootropic drug meclofenoxate on age-related changes in the blood levels of prolactin and growth hormone. C R Acad Bulg Sci 1993; 46: 137-9.
395. Crespo D, Verduga R, Fernández-Viadero C, Megías M. Structural changes induced by cytidine-5’-diphosphate choline (CDP- choline) chronic treatment in neurosecretory neurons of the supraoptic nucleus of aged CFW-mice. Mech Ageing Dev 1995 84: 183-93.
396. Crespo D, Megías M, Fernández-Viadero C, Verduga R. Chronic treatment with a precursor of cellular phosphatidylcholine ameliorates morphological and behavioral effects of aging in the rat hippocampus. Ann NY Acad Sci 2004; 1019: 41-3.
397. Miguel-Hidalgo JJ, Alvarez XA, Lagares R, Franco A, Fernández L, Cacabelos R. Brain neurotoxic lesions in rats: study of the neuroprotective effects of CDP-choline. XXth CINP Congress, June, Melbourne, 1995.
398. Miguel-Hidalgo JJ, Alvarez XA, Lagares R, Franco A, Fernández L, Cacabelos R. Protective effects of CDP-choline against neurotoxic lesions in rat brain. Xth World Congress of Psychiatry, Aug 23-28, Madrid, 1996.
399. Abdel-Zaher AO, Hamdy MM, Abdel-Rahman MS, Abd El-Hamid DH. Protective effect of citicoline against aluminum-induced cognitive impairments in rats. Toxicol Ind Health 2017: 33: 308-17.
400. Zhiliuk VI, Mamchur VI, Pavlov SV. [Role of functional state of neuronal mitochondria of cerebral cortex in mechanisms of nootropic activity of neuroprotectors in rats with alloxan hyperglycemia]. Eksp Klin Farmakol 2015; 78: 10-14.
401. Amol G, Loc BP, Ramya YS. A comparative study of the effect of supplementing citicoline with fluoxetine and amitriptyline on learning and memory in albino rats. Int J Basic Clin Pharmacol 2015; 4: 884-7.
402. Miguel-Hidalgo JJ, Alvarez A, Cacabelos R. Plasticity of Congo red staining displayed by subpopulations of neurons within the rat central nervous system. Cell Tissue Res 1998; 293: 75-86.
403. Kenarova B, Vladimirova R, Hadjiivanova C, Petkov VD. Immunomodulating effects of cytidine diphosphate choline. Biomed Lett 1994; 49: 119-25.
404. Alvarez XA, Sampedro C, Lozano R, Cacabelos R. Citicoline protects hippocampal neurons against apoptosis induced by brain beta-amyloid deposits plus cerebral hypoperfusion in rats. Methods Find Exp Clin Pharmacol 1999; 21: 535-40.
405. Takasaki K, Uchida K, Fujikawa R, Nogami A, Nakamura K, Kawasaki C, et al. Neuroprotective effects of citidine-5-diphosphocholine on impaired spatial memory in a rat model of cerebrovascular dementia. J Pharmacol Sci 2011; 116: 232-7.
406. Sahraiian V, Khazali H. Ghrelin is effective on passive avoidance memory by altering the expression of NMDAR and HTR1a genes in the hippocampus of male wistar rats. Rep Biochem Mol Biol 2021; 10: 380-6.
407. Mosharrof AH, Petkov VD, Petkov VV. Effects of meclofenoxate and citicholine on learning and memory in aged rats. Acta Physiol Pharmacol Bulg 1987; 13: 17-24.
408. Petkov VD, Mosharrof AH, Petkov VV, Kehayov RA. Age-related differences in memory and in the memory effects of nootropic drugs. Acta Physiol Pharmacol Bulg 1990; 16: 28-36.
409. Rema V, Bali KK, Ramachandra R, Chugh M, Darokhan Z, Chaudhary R. Cytidine-5-diphosphocholine supplement in early life induces stable increase in dendritic complexity of neurons in the somatosensory cortex of adult rats. Neursocience 2008; 155: 556-64.
410. Bramanti V, Campisi A, Tomassoni D, Li Volti G, Caccamo D, Cannavò G, et al. Effect of acetylcholine precursors on proliferation and differentiation of astroglial cells in primary cultures. Neurochem Res 2008; 33: 2601-8.
411. Mievis S, Levivier M, Vassart G, Brotchi J, Ledent C, Blum D. Citicoline is not protective in experimental models of Huntington’s disease. Neurobiol Aging 2007; 28: 1944-6.
412. Knippenberg S, Skripuletz T, Rath KJ, Thau N, Gudi V, Pul R, et al. CDP-choline is not protective in the SOD1-G93A mouse model of ALS. Amyotroph Lateral Scler Frontotemporal Degener 2013; 14: 284-90.
413. Gromova OA, Torshin IY, Grishina TR, Demidov VI, Bogacheva TE. Molecular and clinical aspects of the action of cytidine diphosphocholine on cognitive functions. Neurosci Behav Physi 2022; 52: 347-55.
414. Valdayo M. Tratamiento de las toxicomanías con citidín-difosfato de colina. Phronesis 1983; 5: 313-6.
415. Tornos ME, Sacristán A, Ortiz JA. Effect of oral CDP-choline on experimental withdrawal syndrome. Arzneimittelforschun 1983; 33: 1018-21.
416. Nejati S, Khakpai F, Zarrindast MR. Synergistic effect between citalopram and citicoline on anxiolytic effect in non-sensitized and morphine-sensitized mice: an isobologram analysis. Brain Res 2020; 1734: 146701.
417. Patt S, Cervós-Navarro J, Stoltenburg-Didinger, G, Schreiner, C. The effects of CDP-choline on newborn rat pups with experimental alcohol fetopathy. A Golgi study. Histol Histopathol 1989; 4: 429-34.
418. Wang G, Bieberich E. Prenatal alcohol exposure triggers ceramide-induced apoptosis in neural crest-derived tissues concurrent with defective cranial development. Cell Death Dis 2010; 1: e46.
419. Petkov VD, Konstantinova ER, Petkov VV, Vaglenova JV. Learning and memory in rats exposed pre- and postnatally to alcohol. An attempt at pharmacological control. Meth Find Exp Clin Pharmacol 1991; 13: 43-50.
420. Rosario P, Rubio I, De la Morena E. Effects of CDP-choline administration on in vivo release and biosynthesis of acetylcholine in hippocampus of ethanol-treated rats as studied by in vivo brain microdialysis. J Neural Trans 1996; 103: XLVI-XLVII.
421. Rosario P, De la Morena E. CDP-choline reverses opiate receptor-induced decreases in hippocampal acetylcholine release during chronic ethanol consumption and suppresses the withdrawal syndrome. A microdialysis study. 4th Congress of the European Society for Clinical Neuropharmacology, Israel, 1997.
422. Grau T, Romero A, Sacristán A, Ortiz JA. Study on the protection of CDP-choline against nicotine intoxication. Arzneimittelforschung 1983; 33: 1025-6.
423. Sugianto P, Aulanni’am, Widodo MA, Machfoed MH. Neuroprotective effect of citicholine in mercury intoxication. International Journal of Pharmaceutical Science Invention (IJPSI) 2013; 2: 38-44.
424. Buelna-Chontal M, Franco M, Hernández-Esquivel L, Pavón N, Rodríguez-Zavala JS, Correa F, et al. CDP-choline circumvents mercury-induced mitochondrial damage and renal dysfunction. Cell Biol Int 2017; 41: 1356-66.
425. Laksmita YA, Sidik M, Siregar NC, Nusanti S. Neuroprotective effects of citicoline on methanol-intoxicated retina model in rats. J Ocul Pharmacol Ther 2021; 37: 534-41.
426. Aminzadeh A, Salarinejad A. Citicoline protects against lead-induced oxidative injury in neuronal PC12 cells. Biochem Cell Biol 2019; 97: 715-21.
427. Gudi V, Schäfer N, Gingele S, Stangel M, Skripuletz T. Regenerative effects of cdp-choline: a dose-dependent study in the toxic cuprizone model of de- and remyelination. Pharmaceuticals (Basel) 2021; 14: 1156.
428. Shaffie N, Shabana ME. Role of citicoline as a protective agent on toluene-induced toxicity in rats. J Arab Soc Med Res 2019; 14: 14-24.
429. Masoud F, Habib-Asl B, Charkhpour M, Asadpour Y, Mahmudi J. Dexamethasone and citicoline mitigate cisplatin-induced peripheral neuropathy: a novel experimental study in mice. Turk J Pharm Sci 2022; 19: 505-12.
430. Zhong Z, Fu X, Li H, Chen J, Wang M, Gao S, et al. Citicoline protects auditory hair cells against neomycin-induced damage. Front Cell Dev Biol 2020; 8: 712.
431. Grau T, Romero A, Sacristán A, Ortiz JA. CDP-choline: acute toxicity study. Arzneimittelforschung 1983; 33: 1033-4.
432. Matsuda Y, Toda N, Takaori S. Toxicidad aguda, subaguda y crónica de la CDP-colina en ratas y conejos. Gendai no Rinsho 1967; 1: 99-107.
433. Kanabayashi T, Shiota K, Mizuno M, Isaka H, Hoshino H. Toxicological studies on citicoline. Acute and subacute toxicity study in mice and rats. Aso Yakuri 1980; 20: 109-26.
434. Agut J, Font E, Sacristán A, Ortiz JA. Dissimilar effects in acute toxicity studies of CDP-choline and choline. Arzneimittelforschung 1983; 33: 1016-8.
435. Ciaceri G. Toxicological studies on CDPcholine. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 159-67.
436. Schauss AG, Somfai-Relle S, Financsek I, Glavits R, Parent SC, Endres JR, et al. Single- and repeated-dose oral toxicity studies of citicoline free-base (choline cytidine 5’-pyrophosphate) in Sprague-Dawley rats. Int J Toxicol 2009; 28: 479-87.
437. Romero A, Grau T, Sacristán A, Ortiz JA. Study of subacute toxicity of CDP-choline after 30 days of oral administration to rats. Arzneimittelforschung 1983: 33: 1035-8.
438. Romero A, Grau T, Sacristán A, Ortiz JA. CDP-choline: 6-month study toxicity in dogs. Arzneimittelforschung 1983: 33: 1038-42.
439. Agut J, Font E, Sacristán A, Ortiz JA. Bioavailability of methyl-14C CDP-choline by oral route. Arzneimittelforschung 1983; 33: 1045-7.
440. López-Coviella I, Agut J, Von Borstel R, Wurtman RJ. Metabolism of cytidine (5’)-diphosphocholine (CDP-choline) following oral and intravenous administration to the human and the rat. Neurochem Int 1987; 11: 293-7.
441. López-Coviella I, Agut J, Savci V, Ortiz JA, Wurtman RJ. Evidence that 5’-cytidinediphosphocholine can affect brain phospholipid composition by increasing choline and cytidine plasma levels. J Neurochem 1995; 65: 889-94.
442. Wurtman RJ, Regan M, Ulus I, Yu L. Effect of oral CDP-choline on plasma choline and uridine levels in humans. Biochem Pharmacol 2000; 60: 989-92.
443. Galletti P, De Rosa M, Nappi MA, Pontoni G, Del Piano L, Salluzzo A, et al. Transport and metabolism of double-labelled CDPcholine in mammalian tissues. Biochem Pharmacol 1985; 34: 4121-30.
444. De Rosa M, Galletti P, Romeo G, Nappi A, Pontoni G, Arrigoni E, et al. Pharmacokinetics and metabolism of double-labelled CDPcholine. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 139-57.
445. Romero A, Serratosa J, Sacristán A, Ortiz JA. High-resolution autoradiography in mouse brain 24 h after radiolabelled CDP-choline administration. Arzneimittelforschung 1983; 33: 1056-8.
446. Romero A, Serratosa J, Sacristán A, Ortiz JA. High-resolution autoradiography in mouse brain and cerebellum 10 days after radiolabelled CDP-choline administration. Arzneimittelforschung 1983; 33: 1058-60.
447. Romero A, Serratosa J, Sacristán A, Ortiz JA. Low-resolution autoradiography in rat brain after administering labelled CDP-choline. Arzneimittelforschung 1983; 33: 1054-6.
448. Agut J, Font E, Sacristán A, Ortiz JA. Radioactivity incorporation into different cerebral phsopholipids after oral administration of 14C methyl CDP-choline. Arzneimittelforschung 1983; 33: 1048-50.
449. Aguilar J, Giménez R, Bachs O, Enrich C, Agut J. Cerebral subcellular distribution of CDP-choline and/or its metabolites after oral administration of methyl-14C CDP-choline. Arzneimittelforschung 1983; 33: 1051-3.
450. Savci V, Wurtman RJ. Effect of cytidine on membrane phospholipid synthesis in rat striatal slices. J Neurochem 1995; 64: 378-84.
451. Knapp S, Wurtman RJ. Enhancement of free fatty acid incorporation into phospholipids by choline plus cytidine. Brain Res 1999; 822: 52-9.
452. Dinsdale JRM, Griffiths GK, Rowlands C, Castelló J, Ortiz JA, Maddock J, et al. Pharmacokinetics of 14C CDP-choline. Arzneimittelforschung 1983; 33: 1066-70.
453. Moriyama M, Tsukumo T, Nakagawa Y. Effects of CDP-choline on head injury. Gendai no Rinsho 1967; 1: 114-20.
454. Ayuso JL, Saiz J. Efecto protector del citidín-5-difosfato de colina sobre el defecto mnésico post-electrochoque. Munch Med Wochenschr (ed. esp) 1977; 119: 53-9.
455. De la Herrán J, Cortina C, Salazar J, Fernández F. Utilización del citidín difosfato de colina en lesiones encefálicas graves. Actas Luso Esp Neurol Psiquiatr Ciencias Afines 1978; 6: 3-12.
456. Carcasonne M, LeTourneau JN. Étude en double insu du Réxort en neurotraumatologie infantile. Vie Médicale 1979; 12: 1007.
457. Espagno J, Trémoulet M, Gigaud M, Espagno C. Étude de l’action de la CDPcholine dans les troubles de la vigilance post-traumatique. Vie Médicale 1979; 3: 195-6.
458. Richer E, Cohadon F. Essai thérapeutique día’un précurseur des phospholipides sur le traitement des comas traumatiques. Symposium Internacional Souffrance Cérébrale et Précurseurs des Phospholipides, Paris, 18.01.1980.
459. Lecuire J, Duplay J. Sperimentazione in doppio cieco della citicolina versus meclofenossato in pazienti colpiti da trauma cranico. G Ital Ric Clin Ter 1982; 3: 51-5.
460. Lecuire J, Duplay J. Sperimentazione della citicolina in un camipone di 154 traumatizzati cranici. G Ital Ric Clin Ter 1982; 3: 61-7.
461. Lecuire J. Traumatismes crâniens: étude comparative piracetam-CDP-choline. C R Thér Pharmacol Clin 1985; 3: 3-7.
462. Cohadon F, Richer E. CDPcholine in severe traumatic coma: a double blind study. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 299-303.
463. Deleuze R, Huguenard P, Laborit G, Roujas F. Effets de la CDP-choline sur le rapport lactates/pyruvates dans le LCR en cas de souffrance cérébrale grave. C R Ther 1985; 4: 11-8.
464. Ogasiwa M, Takeuchi K, Hara M, Tanaka Y, Okada J. Studies on the intrathecal pharmacotherapy. Part I: CDP-choline. Int J Clin Pharmacol 1975; 12: 327-35.
465. Ogasiwa M, Takeuchi K. Intrathecal pharmacotherapy in coma. Acta Neurochir 1976; 34: 37-44.
466. De Blas A, Martínez-Cubells J, Hernando C. Valoración de la efectividad de la citicolina en el tratamiento de los traumatismos craneoencefálicos. Med Clin (Barc) 1986; 87 (Supl 1): S41-4.
467. Ragguenneau JL, Jarrige B. Enquête nationale sur les suites des traumatismes crâniens graves: analyse des 219 traumatismes traités par CDP-choline. Agressologie 1988; 29: 439-43.
468. Calatayud V, Calatayud JB, Aso J. Effects of CDP-choline on the recovery of patients with head injury. J Neurol Sci 1991; 103: S15-8.
469. Lozano R. CDP-choline in the treatment of cranio-encephalic traumata. J Neurol Sci 1991; 103 (Suppl): S43-7.
470. Levin HS. Treatment of postconcussional symptoms with CDP-choline. J Neurol Sci 1991; 103 (Suppl): S39-42.
471. Aniruddha TJ, Pillai S, Devi BI, Sampath S, Chandramouli BA. Role of citicoline in the management of mild head injury. Indian J Neurotrauma 2009; 6: 49-52.
472. Jotwani V, Harmon KG. Postconcussion syndrome in athletes. Curr Sports Med Rep 2010; 9: 21-6.
473. León-Carrión J, Domínguez-Roldán JM, Murillo-Cabeza F, Domínguez-Morales MR, Muñoz-Sánchez MA, Forastero P. Advances in the treatment of memory deficits after brain injury: the role of citicholine. 3rd World Congress on Brain Injury, Jun 12-17, Quebec, 1999.
474. León-Carrión J, Domínguez-Roldán JM, Murillo-Cabeza F, Domínguez-Morales MR, Muñoz-Sánchez MA. Normalization of memory-related cerebral blood flow in severe traumatic brain injury patients and improvements of memory induced by citicholine (CDP-choline): the role of a pro-cognitive drug. ICRAN’99, Taipei, Taiwan, November, 1999.
475. León-Carrión J, Domínguez-Roldán JM, Murillo-Cabeza F, Domínguez-Morales MR, Muñoz-Sánchez MA. The role of citicholine in neuropsychological training after traumatic brain injury. Neurorehabilitation 2000; 14: 33-40.
476. Wortzel HS, Arciniegas DB. Treatment of post-traumatic cognitive impairments. Curr Treat Options Neurol 2012; 14: 493-508.
477. Spiers PA, Hochanadel G. Citicoline for traumatic brain injury: report of two cases, including my own. J Int Neuropsychol Soc 1999; 5: 260-4.
478. Chinnock P, Pokkunuri V. CDP-choline for acute traumatic brain injury. Cochrane Database of Systematic Reviews 2005; 3: CD005402.
479. Krishna D, Chaurasia ID, Jethwani U. Role of citicoline in traumatic brain injury: a randomized controlled study. IJPMR 2012; 2: 1-5.
480. Zafonte R, Friedewald WT, Lee SM, Levin B, Diaz-Arrastia R, Ansel B, et al. The citicoline brain injury treatment (COBRIT) trial: design and methods. J Neurotrauma 2009; 26: 2207-16.
481. Zafonte RD, Bagiella E, Ansel BM, Novack TA, Friedewald WT, Hesdorffer DC, et al. Effect of citicoline on functional and cognitive status among patients with traumatic brain injury: Citicoline Brain Injury Treatment Trial (COBRIT). JAMA 2012; 308: 1993-2000.
482. Secades JJ. Citicoline for the treatment of head injury: a systematic review and meta-analysis of controlled clinical trials. J Trauma Treat 2014; 4: 227.
483. El Sayed I, Zaki A, Fayed AM, Shehata GM, Abdelmonem S. A meta-analysis of the effect of different neuroprotective drugs in management of patients with traumatic brain injury. Neurosurg Rev 2018; 41: 427-438.
484. Meshkini A, Meshkini M, Sadeghi-Bazargani H. Citicoline for traumatic brain injury: a systematic review & meta-analysis. J Inj Violence Res 2017; 9: 41-50.
485. Varadaraju DN, Ananthakishan. Effect of cerebroprotein hydrolysate with citicoline versus citicoline alone in the initial management of head injury and its clinical outcome ‘a prospective randomised comparative study’. J Evid Based Med Health 2017; 4: 2835-7.
486. Titov II, Voloshinsky OV, Martin AY, Vintonyak IV, Nestor II. Evaluation of neuroprotectoral therapy efficiency in TBI. Pain Anesth Intensive Care 2018; 3: 61-8.
487. Trimmel H, Majdan M, Wodak A, Herzer G, Csomor D, Brazinova A. Citicoline in severe traumatic brain injury: indications for improved outcome: a retrospective matched pair analysis from 14 Austrian trauma centers. Wien Klin Wochenschr 2018; 130: 37-44.
488. Ahmadi J, Hoseinzadeh-Chahkandak F, Roobiyat MY, Pourbagher-Shahri AM, Irankhah S, Rajabpour-Sanati A. Comparison of two different doses of citicoline in patients with traumatic brain injury. J Surg Trauma 2020; 8: 8-15.
489. El Reweny EM, Okasha A, Hafez A. The neuroprotective effect of citicholine (CDP choline) in patients with traumatic brain injury. 25th ESICM Annual Congress, Lisbon, Portugal, October 2012.
490. Salehpour F, Shokouhi G, Shakeri M, Shimia M, Maddkhah A, Baradaran A, et al. Neuroprotective effects of citicoline in diffuse axonal injuries. Adv Biosci Clin Med 2013; 1: 12-5.
491. Salehpour F, Aghazade J, Mirzaee F, Mahdkhah A. Citicoline in patients with traumatic brain injuries. EC Neurology 2015; 2: 87-93.
492. Shokouhi G, Haghjoo AG, Sattarnezhad N, Asghari M, Sattarnezhad A, Asghari A, et al. Effects of citicoline on level of consciousness, serum level of fetuin-A and matrix Gla-protein (MGP) in trauma patients with diffuse axonal injury (DAI) and GCS<=8. Ulus Travma Acil Cerrahi Derg 2014; 20: 410-6.
493. Agarwal S, Patel BM. Is aura around citicoline fading? A systemic review. Indian J Pharmacol 2017; 49: 4-9.
494. Janowitz T, Menon DK. Exploring new routes for neuroprotective drug development in traumatic brain injury. Sci Transl Med 2010; 2: 27rv1.
495. Yadla S, Campbell PG, Jallo J. Traumatic brain injury: current management, controversies, and clinical trials. Neurosurg Q 2011; 21: 168-79.
496. Secades JJ, Asanovna ZN. Role and evidence of citicoline in traumatic brain injury and its sequelae. Neurology Ontrack 2018; 1: 6-16.
497. Secades JJ. Role of citicoline in the management of traumatic brain injury. Pharmaceuticals (Basel) 2021; 14: 410.
498. Brouns R, De Deyn PP. The complexity of neurobiological processes in acute ischemic stroke. Clin Neurol Neurosurg 2009; 111: 483-95.
499. Rogalewski A, Schneider A, Ringelstein EB, Schabitz WR. Toward a multimodal neuroprotective treatment of stroke. Stroke 2006; 37: 1129-36.
500. Minnerup J, Schäbitz WR. Multifunctional actions of approved and candidate stroke drugs. Neurotherapeutics 2009; 6: 43-52.
501. Zaleska MM, Mercado ML, Chavez J, Feuerstein GZ, Pangalos MN, Wood A. The development of stroke therapeutics: promising mechanisms and translational challenges. Neuropharmacology 2009; 56: 329-41.
502. Chavez JC, Zaleska MM, Wang X, Wood A, Hurko O, Pangalos MN, et al. Multimodal magnetic resonance imaging for assessing evolution of ischemic penumbra: a key translational medicine strategy to manage the risk of developing novel therapies for acute ischemic stroke. J Cereb Blood Flow Metab 2009; 29: 217-9.
503. Ducruet AF, Grobelny BT, Zacharia BE, Hickman ZL, Yeh ML, Connolly ES. Pharmacotherapy of cerebral ischemia. Expert Opin Pharmacother 2009; 10: 1895-906.
504. Tuttolomondo A, Di Sciacca R, Di Raimondo D, Arnao V, Renda C, Pinto A, Licata G. Neuron protection as a therapeutic target in acute ischemic stroke. Curr Top Med Chem 2009; 9: 1317-34.
505. Kellner CP, Connolly ES Jr. Neuroprotective strategies for intracerebral hemorrhage: trials and translation. Stroke. 2010; 41 (Suppl1): S99-102.
506. Adeoye O, Broderick JP. Advances in the management of intracerebral hemorrhage. Nat Rev Neurol 2010; 6: 593-601.
507. Sahota P, Savitz SI. Investigational therapies for ischemic stroke: neuroprotection and neurorecovery. Neurotherapeutics 2011; 8: 434-51.
508. Goldstein LB. Poststroke pharmacotherapy: another ictus. Stroke 2012; 43: 3433-5.
509. Matsuoka K, Uozumi T, Kano M, Yoshikawa I, Karita M, Toda T. Clinical study of the effect of cytidine diphsophate choline on sequelas of cerebral circulation disorders. Gendai no Rinsho 1967; 1: 184-9.
510. Miyazaki M. Effects of CDP-choline on sequelas of cerebral apoplexy. Gendai no Rinsho 1967; 1: 169-71.
511. Hazama T, Hasegawa T, Ueda S, Sakuma A. Evaluation of the effect of CDP-choline on poststroke hemiplegia employing a double-blind controlled trial: assessed by a new rating scale for recovery in hemiplegia. Int J Neurosci 1980; 11: 211-25.
512. Goas JY, Bastard J, Missoune A. Bilan à 90 jours du traitement des accidents vasculaires cérébraux par la CDP-choline, à propos día’un essai en double insu. Symposium International: Souffrance Cérébrale et Précurseurs des Phospholipides. Paris, 18.01.1980.
513. Boudouresques P, Alonzo B, Michel B. Conduite therapeutique devant un accident vasculaire cerebral: place de la CDP-choline. Symposium International: Souffrance Cérébrale et Précurseurs des Phospholipides. Paris, 18.01.1980.
514. Corso EA, Arena M, Ventimiglia A, Bizzarro G, Campo G, Rodolico F. La CDPcolina nelle vasculopatie cerebrali: Valutazioni cliniche e di semiologia strumentale. Clin Ter 1982; 102: 379-86.
515. Tazaki Y, Sakai F, Otomo E, Kutsuzawa T, Kameyama M, Omae T, et al. Treatment of acute cerebral infarction with a choline precursor in a multicenter double-blind placebo-controlled study. Stroke 1988; 19: 211-6.
516. Schott B, Joyeux O. Valutazione dell’impiego della citicolina nella terapia di accidenti ischemici cerebrali. G Ital Ric Clin Ter 1982; 3: 56-60.
517. Centrone G, Ragno, G, Calicchio G. Uso della citicolina ad alti dosaggi nelle affezioni acute cerebro-vascolari. Min Med 1986; 77: 371-3.
518. Dereux JF, Gallois P. Résultats comparatifs ACTH/citicoline dans la phase initiale des infarctus cérébraux. Gazette Médicale 1987; 94: 82-5.
519. Franceschi M, Smirne S, Canal N. Treatment of clinical signs and EEG patterns in patients with ‘organic brain syndrome’. Effects of citidin-diphosphocholine, citicholine. Clin Trials J 1982; 19: 74-84.
520. Guillén F, Buendía C, Herrera JA. CDP-choline in the treatment of acute ischaemic stroke. 5th Meeting of the European Neurological Society, Munich, June 17-21, 1995.
521. Bruhwyler J, Van Dorpe J, Géczy J. Multicentric open-label study of the efficacy and tolerability of citicoline in the treatment of acute cerebral infarction. Curr Ther Res 1997; 58: 309-16.
522. Fridman EA, Ottaviano F, Fiol M, Javelier A, Perea JE, Ameriso SF. Neuroprotección en el ictus isquémico agudo. Factibilidad de un protocolo terapéutico. Rev Neurol 2001; 32: 818-21.
523. Alviarez E, Gonzalez M. Efectividad y tolerabilidad de la citicolina en el ictus isquémico agudo, estudio aleatorizado, doble ciego comparado con placebo. Archivos Venezolanos de Farmacologia y Terapéutica 2007; 26: 127-30.
524. León-Jiménez C, Chiquete E, Cantú C, Miramontes-Saldaña MJ, Andrade-Ramos MA, Ruiz-Sandoval JL. Citicoline for acute ischemic stroke in Mexican hospitals: a retrospective postmarketing analysis. Methods Find Exp Clin Pharmacol 2010; 32: 325-30.
525. Clark WM, Warach SJ, Pettigrew LC, Gammans RE, Sabounjian LA, for the Citicoline Study Group. A randomized dose-response trial of citicoline in acute ischemic stroke patients. Neurology 1997; 49: 671-8.
526. Clark W, Williams BJ, Selzer KA, Zweifler RM, Sabounjian LA, Gammans RE. A randomized efficacy trial of citicoline in patients with acute ischemic stroke. Stroke 1999; 30: 2592-7.
527. Clark WM, Wechsler LR, Sabounjian LA, Schwiderski UE. A phase III randomized efficacy trial of 2000 mg citicoline in acute ischemic stroke patients. Neurology 2001; 57: 1595-602.
528. Tilley BC, Marler J, Geller NL, Lu, M, Legler J, Brott T, et al. Use of a global test for multiple outcomes in stroke trials with application to the National Institute of Neurological Disorders and Stroke t-PA Stroke Trial. Stroke 1996; 27: 2136-42.
529. Warach S, Benfield A, Schlaug G, Siewert B, Edelman RR. Reduction of lesion volume in human stroke by citicoline detected by diffusion weighted magnetic resonance imaging: A pilot study. Ann Neurol 1996; 40: 527-8.
530. Warach S, Pettigrew LC, Dashe JF, Pullicino P, Lefkowitz DM, Sabounjian L, et al. Effect of citicoline on ischemic lesions as measured by diffusion-weighted magnetic resonance imaging. Ann Neurol 2000; 48: 713-22.
531. Warach SJ, Sabounjian LA. ECCO 2000 study of citicoline for treatment of acute ischemic stroke: effects on infarct volumes measured by MRI. 25th International Stroke Conference, New Orleans (USA), Feb 2000.
532. Martínez-Vila E, Sieira PI. Current status and perspectives of neuroprotection in ischemic stroke treatment. Cerebrovasc Dis 2001; 11(Suppl1): S60-70.
533. Dávalos A. Citicolina en el tratamiento del ictus isquémico agudo. Metaanálisis de los estudios clínicos y neuroimagen con citicolina en el ictus. Simposium Satélite, IX Curso en Español de la Academia Americana de Neurología, Miami (FL), USA, 2000.
534. Stewart LA, Clarke MJ. Practical methodology of meta-analyses (overviews) using updated individual patient data. Cochrane Working Group. Stat Med 1995; 14: 2057-79.
535. Committee for proprietary medicinal products. Points to consider on application with 1. Meta-analyses 2. One pivotal study. European Agency for the Evaluation of Medicinal Products, London, 31 May 2001.
536. Dávalos A, Castillo J, Álvarez-Sabín J, Secades JJ, Mercadal J, López S, et al. Oral citicoline in acute ischemic stroke: an individual patient data pooling analysis of clinical trials. Stroke 2002; 33: 2850-7.
537. Saver JL, Wilterdink J. Choline precursors in acute and subacute human stroke: a meta-analysis. Stroke 2002; 33: 353.
538. Warach S, Harnett K. Dose dependent reduction in infarct growth with citicoline treatment: evidence of neuroprotection in human stroke? Stroke 2002; 33: 354.
539. Casado A, Secades JJ, Ibarz R, Herdman M, Brosa M. Cost-effectiveness of citicoline versus conventional treatment in acute ischemic stroke. Expert Rev Pharmacoeconomics Outcomes Res 2008; 8: 151-7.
540. Vorobyed P, Bezmelnitsyna L, Borisenko O. Cost-effectiveness of citicoline in patients with acute ischemic stroke in Russia. Value in Health 2011; 14: A41.
541. Ryazhenov VV, Gorokhova SG. Pharmacoeconomic benefits of citicoline in the treatment of acute ischemic stroke in Russia. Value in Health 2013; 16: A519-20.
542. Sobrino T, Rodríguez-González R, Blanco M, Brea D, Pérez-Mato M, Rodríguez-Yáñez M, et al. CDP-choline treatment increases circulating endothelial progenitor cells in acute ischemic stroke. Neurol Res 2011; 33: 572-7.
543. Cho HJ, Kim YJ. Efficacy and safety of oral citicoline in acute ischemic stroke: drug surveillance study in 4191 cases. Methods Find Exp Clin Pharmacol 2009; 31: 171-6.
544. Secades JJ, Álvarez-Sabín J, Rubio F, Lozano R, Dávalos A, Castillo J. Citicoline in intracerebral haemorrhage, a double-blind, randomized, placebo-controlled, multi-centre pilot study. Cerebrovasc Dis 2006; 21: 380-5.
545. Eribal ME, Chua RH. Role of intravenous citicoline for supratentorial hemorrhage. International Stroke Conference 2007, San Francisco, USA.
546. Iranmanesh F, Vakilian A. Efficiency of citicoline in increasing muscular strength of patients with nontraumatic cerebral hemorrhage: a double-blind randomized clinical trial. J Stroke Cerebrovasc Dis 2008; 17: 153-5.
547. Secades JJ. Citicoline in the treatment of intracerebral hemorrhage. The 4th Western China International Neuroscience Forum, TengChong (China), August 2010.
548. Ali Mousavi S, Khorvash F, Hoseini T. The efficacy of citroline in the treatment of ischemic stroke and primary hypertensive intracerebral hemorrhage; a review article. ARYA Atheroscler 2010; 6: 122-5.
549. Toidze I, Aklasvilli N, Lobjanidze N, Tsikarishvili L, Bakradze L, Janelizde M, et al. Use of citicoline (ceraxone) in treatment of secondary ischemic damage of subarachnoid hemorrhage after aneurismal clipping. 8th World Stroke Conference. Brasilia (Brasil), 10-12 October 2012.
550. Zhu PH. The clinical efficacy of citicoline sodium and oxiracetam in patients with cerebral hemorrhage. Chin J New Clin Med 2017; 10: 996-8.
551. Saver JL. Citicoline: update on a promising and widely available agent for neuroprotection and neurorepair. Rev Neurol Dis 2008; 5: 167-77.
552. Lee M, Towfighi A, Saver JL. Choline precursors in acute and subacute ischemic and hemorrhagic stroke: An updated meta-analysis of randomized controlled trials. Stroke 2010; 41: e263.
553. Martynov MI, Boiko AN, Kamchatnov PR, Kabanov AA, Iasamanova AN, Shchukin IA, et al. [Neuroprotective treatment with citicoline (ceraxon) in patients with ischemic stroke]. Zh Nevrol Psikhiatr Im S S Korsakova 2012; 112: 21-6.
554. Galkin AS, Koval’chuk VV, Gusev AO. [Comparison of efficacy of different neurometabolic and vasoactive medicines in ischemic stroke patients’s rehabilitation]. Zh Nevrol Psikhiatr Im S S Korsakova 2011; 111: 47-50.
555. Piradov MA, Sergeev DV, Krotenkova MV. Citicoline (Ceraxon) in acute stroke: assessment of clinical efficacy and effects on cerebral perfusion. Ann Clin Exp Neurol 2012; 6: 31-6.
556. Mitta M, Goel D, Bansal KK, Puri P. Edaravone - citicoline comparative study in acute ischemic stroke (ECCS-AIS). J Assoc Physicians India 2012; 60: 36-8.
557. Vaizova OE, Zautner NA, Alifirova VM, Vengerovski AI. [Influence of neuroprotectors with choline-positive action on the level of brain-injury markers during acute ischemic stroke]. Eksp Klin Farmakol 2012; 75: 7-9.
558. Grewal N, Sharma G, Mohan G, Singh J. To study efficacy and safety of citicoline in acute ischemic stroke. IJBCP 2012; 1: 72-6.
559. Martinov MYu, Boiko AN, Kamchatnov PR, Kabanov AA, Yasamanova AN, Shchukin IA, et al. Neuroprotective therapy with citicoline (Ceraxon) in patients with ischemic stroke. Neurosci Behav Physiol 2013; 43: 706-11.
560. Pushkarev K, Tsoy R. Neuroprotective therapy for lacunar stroke - which is better Ceraxon or Cerebrolysin? Eur J Neurol 2015; 22 (Suppl 1): S484-828.
561. Ghosh S, Das SK, Nath T, Ghosh KC, Bhattacharyya R, Mondal GP. The effect of citicoline on stroke: a comparative study from the Eastern part of India. Neurol India 2015; 63: 697-701.
562. Belova YA, Kotov SV, Chuksina YY, Shevelev SV, Yazdovskyi VV. Ceraxon (citicoline): likely impact on the angiogenesis process in patients with ischemic stroke. Clin Gerontol 2015; 21: 38-40.
563. Umarova KhYa, Kazakov AYu, Chugunov AV, Makeeva MM. Cerebrovascular diseases: the possibilities and efficiency of metabolic therapy. Clinician 2013; 2: 88-92.
564. Shamalov NA, Stakhovskaia LV, Shetova IM, Efremova NM, Anisimov KV. [Efficacy and safety of the combined therapy with citicholine and actovegin in the acute period of ischemic stroke]. Zh Nevrol Psikhiatr Im S S Korsakova 2010; 110: 13-7.
565. Dávalos, A. Protocol 06PRT/3005: ICTUS study: International Citicoline Trial on acUte Stroke (NCT00331890) Oral citicoline in acute ischemic stroke. Lancet Protocol Reviews. 2007. URL: http: //www.thelancet.com/journals/lancet/misc/protocol/protocolreviews. Fecha última consulta: 17.09.22.
566. ICTUS Study: International Citicoline Trial on Acute Stroke. URL: http: //clinicaltrials.gov/ct2/show/NCT00331890?term=ictus&rank=1.Fecha última consulta: 17.09.22.
567. Bolland K, Whitehead J, Cobo E, Secades JJ. Evaluation of a sequential global test of improved recovery following stroke as applied to the ICTUS trial of citicoline. Pharm Stat 2008; 8: 136-49.
568. Dávalos A, Alvarez-Sabín J, Castillo J, Díez-Tejedor E, Ferro J, Martínez-Vila E, et al. Citicoline in the treatment of acute ischaemic stroke: an international, randomised, multicentre, placebo-controlled study (ICTUS trial). Lancet 2012; 380: 349-57.
569. Hankey GJ. How effective is citicoline for acute ischaemic stroke? Lancet 2012; 380: 318-9.
570. Secades JJ, Alvarez-Sabín J, Castillo J, Díez-Tejedor E, Martínez-Vila E, Ríos J, et al. Citicoline for acute ischemic stroke: a systematic review and formal meta-analysis of randomized, double-blind, and placebo-controlled trials. J Stroke Cerebrovasc Dis 2016; 25: 1984-96.
571. Yu C, Zelterman D. A Parametric meta-analysis. Stat Med 2019; 38: 4013-25.
572. Sanossian N, Saver JL. Neuroprotection for acute brain ischaemia. In Saver JL, Hankey GJ, eds. Stroke prevention and treatment: an evidence-based approach. 2 ed. Cambridge: Cambridge University Press; 2020. p. 214-38.
573. Shi PY, Zhou XC, Yin XX, Xu LL, Zhang XM, Bai HY. Early application of citicoline in the treatment of acute stroke: a meta-analysis of randomized controlled trials. J Huazhong Univ Sci Technolog Med Sci 2016; 36: 270-7.
574. Pinzon RT, Sanyasi RLR. Is there any benefit of citicoline for acute ischemic stroke? Systematic review of current evidences. J Crit Rev 2018; 5: 11-4.
575. Martí-Carvajal AJ, Valli C, Martí-Amarista CE, Solà I, Martí-Fàbregas J, Bonfill Cosp X. Citicoline for treating people with acute ischemic stroke. Cochrane Database Syst Rev 2020; 8: CD013066.
576. Touré K, Coulibaly D, Landry O, Sow A, Basse A, Sarr MM, et al. Efficacy and tolerance of Citicoline in the management of stroke at the Clinic of Neurology, Fann University Hospital, Dakar Senegal. RAFMI 2016; 3: 24-9.
577. Charan S, Singh IP, Singh H, Sehgal R, Singh G, Neki NS. A Comparative study of citicoline vs cerebroprotein hydrolysate in ischemic and haemorrhagic stroke. Int J Curr Res Med Sci 2017; 3: 1-6.
578. Kobets SF. Results of open-label, randomized, controlled, parallel-group clinical trial on the efficacy and tolerability of neurocitin in patients with acute ischemic stroke. Int Neurol J 2016; 5: 118-23.
579. Sergeev DV, Domashenko MA, Piradov MA. Pharmacological neuroprotection in stroke in clinical practice. Zh Nevrol Psikhiatr Im S S Korsakova 2017; 117: 86-91.
580. Seifaddini R, Moghadam AH, Iranmanesh F, Arvan H, Naghibzadeh -Tahami A. The effects of citicoline on cerebrovascular hemodynamic status in ischemic stroke patients. JKMU 2017; 24: 480-6.
581. Mehta A, Mahale R, Buddaraju K, Javali M, Acharya P, Srinivasa R. Efficacy of neuroprotective drugs in acute ischemic stroke: is it helpful? J Neurosci Rural Pract 2019; 10: 576-81.
582. Diana DMI, Irfana L, Levani Y, Marlina U. The effect of citicolin in motoric improvement of acute ischemic stroke patients in Siti Khodijah Sepanjang Hospital. Medical and Health Science Journal 2020; 4: 76.
583. Kuryata OV, Kushnir YS, Nedzvetsky VS, Korsa VV, Tykhomyrov AA. Serum levels of the biomarkers associated with astrocytosis, neurodegeneration, and demyelination: neurological benefits of citicoline treatment of patients with ischemic stroke and atrial fibrillation. Neurophysiology 2021; 53: 2-12.
584. Mazaheri Sh, Darvish M, Pooroalajal J, Fariadras M. A Comparative study on the effect of citicoline on acute ischemic and hemorrhagic stroke. Avicenna J Clin Med 2018; 25: 20-7.
585. Agarwal A, Vishnu VY, Sharma J, Bhatia R, Garg A, Dwivedi S, et al. Citicoline in acute ischemic stroke: a randomized controlled trial. PLoS One 2022; 17: e0269224.
586. Premi E, Cantoni V, Benussi A, Gilberti N, Vergani V, Delrio I, et al. Citicoline treatment in acute ischemic stroke: a randomized, single-blind TMS Study. Front Neurol 2022; 13: 915362.
587. Abou Zaki SD, Lokin J. Efficacy and safety of citicoline, cerebrolysin, mlc601 (neuroaid) and edaravone in recoveryof patients with acute ischemic strokes: a meta-analysis and systemic review. Int J Stroke 2021; 16: 118.
588. Ueda S, Hasegawa T, Ando K, Okawa T, Chino N, Ogata H, et al. Evaluation of the pharmacological effect of CDP-choline injection in post-stroke hemiplegia. Double-blind comparative study using the Hemiplegia Function Test (12-grade evaluation method). Strides of Medicine 1994; 170: 297-314.
589. Galkin AS, Barantcevich ER, Gusev AO, Minnullin TI, Kovalchuck VV, Samus NL, et al. [The possibilities of increase of efficacy of rehabilitation of stroke patients with neglect syndrome]. Zh Nevrol Psikhiatr Im S S Korsakova 2014; 114: 30-4.
590. Secades JJ. Posible papel de la citicolina en la rehabilitacion tras un ictus: revision de la bibliografia [Probably role of citicoline in stroke rehabilitation: review of the literature]. Rev Neurol 2012; 54: 173-9.
591. Krupinski J, Secades JJ, Shiraliyeva RK. Towards Effective Neurorehabilitation for Stroke Patients. Int J Phys Med Rehabil. 2014; 2: 2.
592. Mushba AV, Ivanova DS, Vinogradov OI. Assessing the impact of citicoline on the efficiency of rehabilitation measures in patients with ischemic stroke. Zhurnal Nevrologii i Psikhiatrii Imeni SS Korsakova 2016; 106: 71-5.
593. Kostenko EV, Petrova LV. Drug support in a complex of rehabilitation measures for patients with post-motor impairment: the role of neurocytoprotectors. Med Advice 2018; 9: 88-97.
594. Szelenberger R, Kostka J, Saluk-Bijak J, Miller E. Pharmacological interventions and rehabilitation approach for enhancing brain self-repair and stroke recovery. Curr Neuropharmacol 2020; 18: 51-64.
595. Singh M, Khan MI, Giri R, Kumar L. Role of citicoline in improvement of cognition, memory and post stroke disability in stroke patients. Int J Adv Med 2019; 6: 429-34.
596. Alizadeh M, Khatoonabadi SAR, Mazaheri S, Montazeri M, Amiri F. the effect of pharmacotherapy combined with speech therapy on functional recovery from aphasia. Austin J Clin Neurol 2017; 4: 1125.
597. Shulginova AA, Konoplya AI, Bystrova NA. Disorders of the immune status in patients with chronic cerebral ischemia; differentiated pharmacological correction. Research Results in Pharmacology 2018; 4: 105-23.
598. Corallo F, Scarfì C, Arcadi FA, Formica C, Di Cara M, Palmeri R, et al. Role of functional pharmacological therapy in post-stroke depression: a narrative review. J Int Med Res 2020; 48: 300060520950557.
599. Arcadi FA, Corallo F, Torrisi M, Scarfì C, Lo Buono V, Formica C, et al. Role of citicoline and choline in the treatment of post-stroke depression: an exploratory study. J Int Med Res 2021; 49: 3000605211055036.
600. Tykhomyrov AA et al. Citicoline affects serum angiostatin and neurospecific protein levels in patients with atrial fibrillation and ischemic stroke. Ukr Biochem J 2019; 91: 34-45.
601. Ovbiagele B, Kidwell CS, Starkman S, Saver JL. Potential role of neuroprotective agents in the treatment of patients with acute ischemic stroke. Curr Treat Options Neurol 2003; 5: 367-75.
602. Labiche LA, Grotta JC. Clinical trials for cytoprotection in stroke. NeuroRx 2004; 1: 46-70.
603. Alonso de Leciñana M, Egido JA, Casado I, Ribó M, Dávalos A, Masjuan J, et al. Guidelines for the treatment of acute ischaemic stroke. Neurologia 2014; 29: 102-22.
604. Muñoz Collazos M. Avances en la terapéutica del ACV. Revista de la Facultad de Ciencias de la Salud de la Universidad del Cauca. 2008; 6: 35-9.
605. Davis S, Lees K, Donnan G. Treating the acute stroke patient as an emergency: current practices and future opportunities. Int J Clin Pract 2006; 60: 399-407.
606. Segura T, Calleja S, Jordan J. Recommendations and treatment strategies for the management of acute ischemic stroke. Expert Opin Pharmacother 2008; 9: 1071-85.
607. Jeyaseelan K, Lim KY, Armugam A. Neuroprotectants in stroke therapy. Expert Opin Pharmacother 2008; 9: 887-900.
608. Gupta SK, Gupta A, Gondhotra D, Gupta A, Gupta S. Role of citicoline is ischaemic stroke. JK Science 2008; 10: 160-2.
609. Schäbitz WR. CDP-cholin zur behandlung des schlaganfalls. Psychopharmakotherapie 2009; 16: 101-5.
610. Clark WM. Efficacy of citicoline as an acute stroke treatment. Expert Opin Pharmacother 2009; 10: 839-46.
611. Arenth PM, Russell KC, Ricker JH, Zafonte RD. CDP-choline as a biological supplement during neurorecovery: a focused review. PM R. 2011; 3 (6 Suppl 1): S123-31.
612. Nuñez-Coronado Y, Barrientos-Imán D. La era de la neuroprotección: citicolina en el infarto cerebral. Rev Per Neurol 2012; 13: 36-40.
613. Overgaard K. The Effects of citicoline on acute ischemic stroke: a review. J Stroke Cerebrovasc Dis 2014; 23: 1764-9.
614. Martynov MY, Gusev EI. Current knowledge on the neuroprotective and neuroregenerative properties of citicoline in acute ischemic stroke. J Exp Pharmacol 2015; 7: 17-28.
615. Qureshi SS, Gupta JK, Mishra P. Citicoline: a potential breakthrough in cerebrovascular disorder. Austin J Pharmacol Ther 2016; 4: 1077.
616. Ministerio de Sanidad y Consumo. Estrategia en Ictus del Sistema Nacional de Salud. Madrid: Ministerio de Sanidad y Consumo. Gobierno de España; 2008.
617. Scottish Intercollegiate Guidelines Network. Management of patients with stroke or TIA: assessment, investigation, immediate management and secondary prevention. A national clinical guideline. Scottish Intercollegiate Guidelines Network; 2008.
618. Seethalakshmi, R. Neurotransmitters and their impact on mental illness. IJSR 2017; 6: 1512-8.
619. Wang J, Zhang HY, Tang XC. Cholinergic deficiency involved in vascular dementia: possible mechanism and strategy of treatment. Acta Pharmacol Sin 2009; 30: 879-88.
620. Fotuhi M, Hachinski V, Whitehouse PJ. Changing perspectives regarding late-life dementia. Nat Rev Neurol 2009; 5: 649-58.
621. Levine DA, Langa KM. Vascular cognitive impairment: disease mechanisms and therapeutic implications. Neurotherapeutics 2011; 8: 361-73.
622. Skrobot OA, Attems J, Esiri M, Hortobágyi T, Ironside JW, Kalaria RN, et al. Vascular cognitive impairment neuropathology guidelines (VCING): the contribution of cerebrovascular pathology to cognitive impairment. Brain 2016; 139: 2957-69.
623. García-Cobos R, Frank-García A, Gutiérrez-Fernández M, Díez-Tejedor E. Citicoline, use in cognitive decline: Vascular and degenerative. J Neurol Sci 2010; 299: 188-92.
624. Babb SM, Appelmans KE, Renshaw PF, Wurtman RJ, Cohen BM. Differential effect of CDP-choline on brain cytosolic choline levels in younger and older subjects as measured by proton magnetic resonance spectroscopy. Psychopharmacology.1996; 127: 88-94.
625. Wald LL, Babb SM, Yurgelun-Todd DA, Cohen BM, Renshaw RF. CDP-choline decreases brain phosphomonoesters in normal elderly subjects. 6th Annual Meeting of the International Society for Magnetic Resonance in Medicine, Sydney (Australia), April 1998.
626. Babb SM, Wald LL, Cohen BM, Villafuerte RA, Gruber SA, Yurgelun-Todd DA, et al. Chronic citicoline increases phosphodiesters in the brains of healthy older subjects: an in vivo phosphorus magnetic resonance spectroscopy study. Psychopharmacology (Berl) 2002; 161: 248-54.
627. Agarwal N, Sung YH, Jensen JE, da Cunha G, Harper D, Olson D, et al. Short-term administration of uridine increases brain membrane phospholipid precursors in healthy adults: a 31-phosphorus magnetic resonance spectroscopy study at 4T. Bipolar Disord 2010; 12: 825-33.
628. Silveri MM, Dikan J, Ross AJ, Jensen JE, Kamiya T, Kawada Y, et al. Citicoline enhances frontal lobe bioenergetics as measured by phosphorus magnetic resonance spectroscopy. NMR Biomed 2008; 21: 1066-75.
629. Renshaw PF, Babb SM, Yurgelun-Todd DA, Wald LL, Villafuerte RA, Cohen BM. Chronic citicholine (CDP-choline) administration alters brain phospholipid metabolites and improves cognitive performance in healthy, older adults. 37th ACNP Annual Meeting, December 14-18, Puerto Rico, 1998.
630. Spiers PA, Myers D, Hochanadel GS, Lieberman HR, Wurtman RJ. Citicoline improves verbal memory in aging. Arch Neurol 1996; 53: 441-8.
631. Alvarez XA, Laredo M, Corzo D, Fernández-Novoa L, Mouzo R, Perea JE, et al. Citicoline improves memory performance in elderly subjects. Methods Find Exp Clin Pharmacol 1997; 19: 201-10.
632. Sánchez S, Garcia ME, Carrizalez Y, Chaves L, Rodríguez U, Cardenas J, et al. Efectividad y tolerabilidad de la citicolina (somazina) en el tratamiento de pacientes con deterioro cognitivo tipo demencia. Archivos Venezolanos de Farmacologia y Terapéutica 2006; 25: 101-3
633. Bettini R, Gorini M. I tempi di reazione in corso di trattamento con citicolina [Reaction times during citicoline treatment]. Clin Ter 2002; 153: 247-50.
634. McGlade E, Locatelli A, Hardy J, Kamiya T, Morita M. Morishita K, et al. Improved attentional performance following citicoline administration in healthy adult women. Food and Nutrition Sciences 2012; 3: 769-73.
635. McGlade E, Agoston AM, DiMuzio J, Kizaki M, Nakazaki E, Kamiya T, et al. The effect of citicoline supplementation on motor speed and attention in adolescent males. J Atten Disord 2019 Jan; 23: 121-34.
636. Bruce SE, Werner KB, Preston BF, Baker LM. Improvements in concentration, working memory and sustained attention following consumption of a natural citicoline-caffeine beverage. Int J Food Sci Nutr 2014; 65: 1003-7.
637. Knott V, de la Salle S, Choueiry J, Impey D, Smith D, Smith M, et al. Neurocognitive effects of acute choline supplementation in low, medium and high performer healthy volunteers. Pharmacol Biochem Behav 2015; 131: 119-29.
638. Bruce SE. Improvements in quantitative EEG following consumption of a natural citicoline-enhanced beverage. Int J Food Sci Nutr 2012; 63: 421-5.
639. Knott V, Smith D, de la Salle S, Impey D, Choueiry J, Beaudry E, et al. CDP-choline: effects of the procholine supplement on sensory gating and executive function in healthy volunteers stratified for low, medium and high P50 suppression. J Psychopharmacol 2014; 28: 1095-108.
640. Knott V, Salle S, Smith D, Choueiry J, Impey D, Smith M, et al. Effects of acute CDP-choline treatment on resting state brain oscillations in healthy volunteers. Neurosci Lett 2015; 591: 121-5.
641. Knott V, Impey D, Choueiry J, Smith D, de la Salle S, Saghir S, et al. An acute dose, randomized trial of the effects of CDP-choline on mismatch negativity (MMN) in healthy volunteers stratified by deviance detection level. Neuropsychiatric Electrophysiology 2015; 1: 1.
642. Gareri P, Castagna A. Citicoline in vascular cognitive impairment: some latest evidences. Ann Alzheimers Dement Care 2017; 2: 18-9.
643. Gareri P, Cotroneo AM, Manfredi VGL. From neuroinflammation to neuroprotection: focus on potential new therapeutic targets in cognitive impairment. Neurol Neurobiol 2020; 2020: 1-4.
644. Baumel BS, Doraiswamy PM, Sabbagh M, Wurtman R. Potential neuroregenerative and neuroprotective effects of uridine/choline-enriched multinutrient dietary intervention for mild cognitive impairment: a narrative review. Neurol Ther 2021; 10: 43-60.
645. Farooq MU, Min J, Goshgarian C, Gorelick PB. Pharmacotherapy for vascular cognitive impairment. CNS Drugs 2017; 31: 739-56.
646. Lewis JE, Poles J, Shaw DP, Karhu E, Khan SA, Lyons AE, et al. The effects of twenty-one nutrients and phytonutrients on cognitive function: a narrative review. J Clin Transl Res 2021; 7: 575-620.
647. Madariaga LM, Espina JM, Pascual A, Ortiz LG, Castro JM. Estudio doble ciego sobre un grupo de enfermas seniles tratadas con CDP-colina. Rev Psiquiat Psicol Med 1978; 13: 331-42.
648. Fassio B, Fassio M, Pavesi G, Piantato E. La citicolina in psicogeriatria. Clin Europ 1982; 21: 635-46.
649. Lingetti M, Ciarimboli M, Rumiano C, Lingetti E, De Rosa A, Resciniti C, et al. Cerebropatie involutive senili gravi: Trattamento con citicolina ad alto dosaggio. Rass Int Clin Ter 1982; 62: 704-14.
650. Stramba-Badiale M, Scillieri E. Attività della citicolina nel decadimento mentale senile. Min Med 1983; 74: 819-21.
651. Bonavita E, Chioma V, Dall’Oca P, Fini C, Michelini M, Ruggi MR, et al. Studio in doppio cieco sull’azione della citicolina nel cervello senile. Min Psich 1983; 24: 53-62.
652. Lozano R, Fernández MV, Balagué A. Alteraciones neuropsíquicas del anciano: evolución tras la administración de CDP-colina (citicolina). Med Clin (Barc) 1986; 87 (Supl 1): 30-3.
653. Palleschi M, Capobianco G. Invecchiamento cerebrale patologico. Osservazioni personali con l’impiego della citicolina. Clin Ter 1988; 125: 121-8.
654. Schergna E, Lupo L. La citicolina nella medicina di base: esperienza clinica multicentrica nell’area Veneto-Trentino Alto Adige-Friuli Venezia Giulia. Giorn Geront 1988; 36: 341-50.
655. Suryani LK, Adnjana TAK, Jensen GD. Citicoline treatment of memory deficits in elderly people. Int J Geriatr Psychiatr 1988; 3: 235-6.
656. Serra F, Diaspri GP, Gasbarrini A, Giancane S, Rimondi A, Tamè MR, et al. Effetto della CDP-colina sul decadimento mentale senile. Esperienza policentrica su 237 casi. Min Med 1990; 81: 465-70.
657. Lingetti M, Carimboli M, Porfido FA, De Paola P, Barlattani MP. Effetti della CDP-colina su alcuni parametri neuropsicologici in pazienti con involuzione cerebrale senile. Riforma Med 1990; 105: 11-6.
658. Di Trapani G, Fioravanti M. La citicolina nell trattamento dei disturbi cognitivi e comportamentali del decadimento senile patologico. Clin Ter 1991; 137: 403-13.
659. Matsuoka T, Kawanaka M, Nagai K. Effect of cytidine diphosphate choline on growth hormone and prolactin secretion in man. Endocrinol Jpn 1978; 25: 55-7.
660. Ceruso D, D’Andrea Petrelli L, Ciraolo O, Corica F, Petrelli RM. Effect of cytocholine on pituitary function in the elderly. Acta Ther 1983; 9: 41-4.
661. Ceda GP, Ceresini G, Magnani D, Marchini L, Valenti G, Hoffman AR. Effects of cytidine 5’-diphosphocholine administration on basal and growth hormone-releasing hormone-induced growth hormone secretion in elderly people. Acta Endocrinol 1991; 124: 516-20.
662. Fioravanti M, Buckley AE, Agnoli A, Nappi G, Arrigo A, Gerstenbrand F. Citicoline in CCVD patients: preliminary results of a multicenter study. International Multidisciplinar Seminar on Cerebral Pathology in Old Age: Neuroradiological and Neurophysiological Correlations, September 27-28, Pavia, 1982.
663. Falchi Delitalia G, Falchi Delitalia N, Casali R, Crescenzi GS, Attorri L, Lombardi R, et al. Studio a medio termine, in doppio cieco versus placebo, con CDP-colina nella insufficenza cerebrale senili. Aspetti psichici, endocrinologici, emoreologici e biochimico ematologici. Gazz Med It 1984; 143: 789-810.
664. Moglia A, Arrigo A, Bono G, Sinforiani E, Calabro’ G, Cinanni G, et al. Citicoline in patients with chronic cerebrovascular diseases (CCVD): quantitative EEG study. Curr Ther Res 1984; 36: 309-13.
665. Merchan C, Berchicci R, Cuzzoni G, Pecorini M. CDP-colina e insufficenza cerebrovascolare nell’anziano. Studio clinico di 40 pazienti in corso di trattamento prolungato. Min Cardioang 1985; 33: 145-8.
666. Agnoli A, Fioravanti M, Lechner H. Efficacy of CDPcholine in chronic cerebral vascular diseases (CCV). In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 305-15.
667. Sinforiani E, Trucco M, Pacchetti C, Gualtieri S. Valutazione degli effetti della citicolina nella malattia cerebro-vascolare cronica. Min Med 1986; 77: 51-7.
668. Motta L, Fichera G, Tiralosi G, Di Stefano A. La citicolina nel trattamento delle cerebrovasculopatie croniche. Giorn Geront 1986; 34: 149-58.
669. Rossi M, Zanardi M. Studio in aperto sull’efficacia clinica della citicolina in pazienti affetti da cerebrovasculopatia cronica. Clin Ter 1993; 142: 141-4.
670. Fioravanti M. La cerebropatie vascolari croniche: la terapia con CDP-colina. Ann Ital Med Int 1989; 4: 268-73.
671. Raji A, Winkler G. Treatment of cognitive impairment in small vessel stroke and white matter disease with CDP-choline. European Stroke Conference, Barcelona (Spain), May 2010.
672. Zapadnyuk BV, Kopchak OO. Features drug correction of vascular cognitive disorders in patients with discirculatory encephalopathy and metabolic syndrome. ProNeuro 2010; 4: 77-82.
673. Kopchak OO. Efficay of citicoline in the treatment of patients with vascular cognitive impairment. European Neurological Society Meeting, Berlin (Germany), June 2010.
674. Kal’bus O, Shkolnyk V. Citicoline in correction of cognitive decline in patients with arterial hypertension (pilot study). 22nd European Meeting on Hypertension and Cardiovascular Protection, London, April 2012.
675. Gavrilova SI, Fedorova IaB, Gantman, Kalyn IaB, Kolykhalov IV. [Ceraxon (citicoline) in the treatment of the mild cognitive impairment syndrome]. Zh Nevrol Psikhiatr Im S S Korsakova 2011; 111: 16-20.
676. Eberhardt R, Dehrr I. Eficacia y tolerancia de CDP-colina en pacientes geriátricos con insuficiencia cerebral senil. Estudio doble ciego cruzado. Rev Esp Geriatr Gerontol 1989; 24 (Supl1): S73-81.
677. Chandra B. Treatment of multi-infarct dementia with citicholine. J Stroke Cerebrovasc Dis 1992; 2: 232-3.
678. Piccoli F, Battistini N, Carbonin P, Dossi BC, Fiori L, La Bella V, et al. CDP-choline in the treatment of chronic cerebrovasculopathies. Arch Gerontol Geriatry 1994; 18: 161-8.
679. Capurso A, Capurso S, Panza F, Solfrizzi V, Mastroianni F, Giaquinto S, et al. Efficacy of cytidine diphosphate choline in patients affected by chronic cerebrovascular disease. Clin Drug Invest 1996; 12: 26-38.
680. Cohen RA, Browndyke JN, Moser DJ, Paul RH, Gordon N, Sweet L. Long-term citicoline (cytidine diphosphate choline) use in patients with vascular dementia: neuroimaging and neuropsychological outcomes. Cerebrovasc Dis 2003; 16: 199-204.
681. Tanaka Y, Minematsu K, Hirano T, Hayashida K, Yamaguchi T. Effects of CDP-choline on dynamic changes in LCBF and cognitive function in demented subjects--an H215O-PET study. Rinsho Shinkeigaku 1994; 34: 877-81.
682. Lozano R. Estudio de la evolución del deterioro psicoorgánico en el anciano. Tratamiento con CDP-colina. Rev Esp Geriatr Gerontol 1989; 24 (Supl 1): S65-72.
683. Corona GI, Santagostino G, Frattini P, Cucchi ML, Zerbi F, Tosca P, et al. Preliminary data on monoamine metabolite levels in cerebrospinal fluid and in urine during therapy in dementia. IRCS Med Sci 1983; 11: 923-4.
684. Cacabelos R, Álvarez XA, Franco A, Fernández-Novoa L, Caamaño J, Del Valle-Inclán F. Therapeutic effects of CDP-choline in Alzheimer’s disease and multi-infarct dementia: psychometric assessment and immune function. Ann Psychiatr 1992; 3: 233-45.
685. Caamaño J, Gómez MJ, Franco A, Cacabelos R. Effects of CDP-choline on cognition and cerebral hemodynamics in patients with Alzheimer’s disease. Meth Find Exp Clin Pharmacol 1994; 16: 211-8.
686. Fernández-Novoa L, Álvarez XA, Franco-Maside A, Caamaño J, Cacabelos R. CDP-choline-induced blood histamine changes in Alzheimer’s disease. Meth Find Exp Clin Pharmacol 1994; 16: 279-84.
687. Cacabelos R, Caamaño J, Gómez MJ, Fernández-Novoa L, Franco-Maside A, Alvarez XA. Therapeutic effects of CDP-choline in Alzheimer’s disease. Cognition, brain mapping, cerebrovascular hemodynamics, and immune factors. Ann NY Acad Sci 1996; 777: 399-403.
688. Alvarez XA, Mouzo R, Pichel V, Pérez P, Laredo M, Fernández-Novoa L, et al. Double-blind placebo-controlled study with citicoline in APOE genotyped Alzheimer’s disease patients. Effects on cognitive performance, brain bioelectrical activity and cerebral perfusion. Methods Find Exp Clin Pharmacol 1999; 21: 633-44.
689. Soto A, Ruiz A, Medina C, Lonso, A, Viaña JL. An evolutive study of the global impairment in patients diagnosed of senil and presenil pimary degenerative dementia of the Alzheimer type (D.T.A.) and undergoing to medical treatment with citicoline; calcium antagonist and piracetam. In Beregi E, Gergely IA, Rajczi K, eds. Recent advances in aging science. Bologna: Monduzzi Editore; 1993. p. 723-9.
690. Cacabelos R, Alvarez A, Fernández-Novoa L, Lombardi VRM. A pharmacogenomic approach to Alzheimer’s disease. Acta Neurol Scand 2000; 176: 12-9.
691. Zhuravin IA, Nalivaeva NN, Kozlova DI, Kochkina EG, Fedorova YaB, Gavrilova SI. The activity of blood serum cholinesterases and neprilysin as potential biomarkers of mild-cognitive impairment and Alzheimer’s disease. Zh Nevrol Psikhiatr 2015; 11: 77-85.
692. Fioravanti M, Yanagi M. Cytidinediphosphocholine (CDP-choline) for cognitive and behavioural disturbances associated with chronic cerebral disorders in the elderly. Cochrane Database of Systematic 2005; 2. CD000269.
693. Deutsch SI, Schwartz BL, Schooler NR, Rosse RB, Mastropaolo J, Gaskins B. First administration of cytidine diphosphocholine and galantamine in schizophrenia: a sustained alpha7 nicotinic agonist strategy. Clin Neuropharmacol 2008; 31: 34-9.
694. Deutsch SI, Schwartz BL, Schooler NR, Brown CH, Rosse RB, Rosse SM. Targeting alpha-7 nicotinic neurotransmission in schizophrenia: a novel agonist strategy. Schizophr Res 2013; 148: 138-44.
695. Ovezov AM, Lobov MA, And’kina ED, Myatchin PS, Panteleeva MV, Knyazev AV. Citicoline in the prevention of postoperative cognitive dysfunction during total intravenous anesthesia. Ann Clin Exp Neurol 2013; 7: 27-34.
696. Shmelev VV, Neimark MI. The dynamics of the state of higher mental functions after surgical reconstruction of stenosed carotid arteries using different types of anesthesia. Zhurnal Nevrologii i Psihiatrii meni S.S. Korsakova 2013; 13: 30-4.
697. Shestakova MV, Alekhin DI, Kokorishvili MA, Sinitskiy AI, Evseeva YuD. Citicoline treatment in reconstructive operations of carotid arteries for prevention of reperfusion complications and cognitive disturbances in patients at risk. Nevrologicheskii Zhurnal 2014; 2: 47-53.
698. Dubivska S, Kudinova O, Grigorov Y, Bitchuk N. [Tactics of choosing cognitive dysfunction therapy in the postoperative period]. Georgian Med News 2017; 273: 61-4.
699. Li Z, Wang P, Yu Z, Sun H, Zhang J, Zhang J, et al. Effect of citicoline adjuvant therapy on mild cognitive impairment in Parkinson’s disease. J Clin Exp Med 2016; 9: 4593-8.
700. Putignano S, Gareri P, Castagna A, Cerqua G, Cervera P, Cotroneo AM, et al. Retrospective and observational study to assess the efficacy of citicoline in elderly patients suffering from stupor related to complex geriatric syndrome. Clin Interv Aging 2012; 7: 113-8.
701. Cotroneo AM, Castagna A, Putignano S, Lacava R, Fantò F, Monteleone F, et al. Effectiveness and safety of citicoline in mild vascular cognitive impairment: the IDEALE study. Clin Interv Aging 2013; 8: 131-7.
702. Castagna A, Cotroneo AM, Ruotolo G, Gareri P. The CITIRIVAD study: CITIcoline plus RIVAstigmine in Elderly Patients Affected with Dementia Study. Clin Drug Investig 2016; 36: 1059-65.
703. Gareri P, Castagna A, Cotroneo AM, Putignano D, Conforti R, Santamaria F, et al. The citicholinage study: citicoline plus cholinesterase inhibitors in aged patients affected with Alzheimer’s disease study. J Alzheimers Dis 2017; 56: 557-565.
704. Gareri P, Castagna A. Citicoline as add-on treatment in Alzheimer’s disease: tips from the citicholinage study. J Alzheimers Dis Parkinsonism 2017; 7: 4.
705. Gareri P, Cotroneo AM, Orsitto G, Putignano S. The CITIMEM Study: a pilot study. Optimizing pharmacological treatment in dementia. Arch Gerontol Geriatr 2020; 89: 104073.
706. Gareri P, Cotroneo AM, Orsitto G, Putignano S. The importance of citicoline in combined treatment in dementia: what did the CITIMEM study teach us? Rev Recent Clin Trials 2021; 16: 126-30.
707. Castagna A, Fabbo A, Manzo C, Lacava R, Ruberto C, Ruotolo G. A retrospective study on the benefits of combined citicoline, memantine, and acetylcholinesterase inhibitor treatments in older patients affected with Alzheimer’s disease. J Alzheimers Dis 2021; 79: 1509-15.
708. Castagna A, Manzo C, Fabbo A, Lacava R, Ruberto C, Ruotolo G. The CITIMERIVA Study: CITIcoline plus MEmantina plus RIVAstigmine in Older Patients Affected with Alzheimer’s Disease. Clin Drug Investig 2021 Feb; 41: 177-82.
709. Gareri P, Cotroneo AM, Orsitto G, Veronese N, Putignano S. The CITIDEMAGE study: combined treatment with a cholinergic precursor in dementia patients. OBM Geriatrics 2022; 6: 193.
710. Gareri P, Veronese N, Cotroneo AM. An Overview of combination treatment with citicoline in dementia. Rev Recent Clin Trials 2022; 17: 4-8.
711. Piamonte BLC, Espiritu AI, Anlacan VMM. Effects of citicoline as an adjunct treatment for Alzheimer’s disease: a systematic review. J Alzheimers Dis 2020; 76: 725-32.
712. Lees R, Fearon P, Harrison JK, Broomfield NM, Quinn TJ. Cognitive and mood assessment in stroke research: focused review of contemporary studies. Stroke 2012; 43: 1678-80.
713. Jaillard A, Grand S, François Le Bas J, Hommel M. Predicting cognitive disfunctioning in nondemented patients early after stroke. Cerebrovasc Dis 2010; 29: 415-23.
714. Alvarez-Sabín J, Ortega G, Jacas C, Santamarina E, Maisterra O, Ribo M, et al. Long-term treatment with citicoline may improve poststroke vascular cognitive impairment. Cerebrovasc Dis 2013; 35: 146-54.
715. Alvarez-Sabin J, Santamarina E, Maisterra O, Jacas C, Molina C, Quintana M. Long-term treatment with citicoline prevents cognitive decline and predicts a better quality of life after a first ischemic stroke. Int J Mol Sci 2016; 17: 390.
716. Lobjanidze N, Dzagnidze A, Jeiranashvili A, Kukava M, Beridze M, Khachiashvili M, et al. Long-term effects of the use of citicoline (ceraxone) in the post-stroke cognitive-mood impairment. Cerebrovasc Dis 2010; 29 (Suppl 2).
717. Maslarov DB. Effects of citicoline on neuropsychological status after stroke. 18th World Congress of Psychobiology 2016.
718. Feng L, Jiang H, Li Y, Teng F, He Y. Effects of citicoline therapy on the network connectivity of the corpus callosum in patients with leukoaraiosis. Medicine (Baltimore) 2017; 96: e5931.
719. Kovalenko OYe, Lytvyn OV. Features of brain electrogenesis in patients with hypertensive dyscirculatory encephalopathy and concomitant hypothyroidism in the application of citicoline. Int Neurol J 2017; 3: 101-4.
720. Mashin VV, Belova LA, Bakhtogarimov IR, Bergelson TM, Sharafutdinova RR. [Multicenter observational program for evaluation of the effectiveness of the recognan (citicoline) in the correction of cognitive impairment in patients with chronic cerebrovascular pathology]. Zh Nevrol Psikhiatr Im S S Korsakova 2017; 117: 39-43.
721. Chutko LS, Surushkina SY, Yakovenko EA, Anisimova TI, Karpovskaya EB, Vasilenko VV, et al. Impairments to cognitive control in patients with somatoform disorders and their treatment. Neurosci Behav Physi 2020; 50: 162-7.
722. Qureshi SS, Gupta JK, Goyal A, Narayan Yadav H. A novel approach in the management of hyperhomocysteinemia. Med Hypotheses 2019; 129: 109245.
723. Turana Y, Nathaniel M, Shen R, Ali S, Aparasu RR. Citicoline and COVID-19-Related Cognitive and Other Neurologic Complications. Brain Sci 2021; 12: 59.
724. Choueiry J, Blais CM, Shah D, Smith D, Fisher D, Illivitsky V, et al. Combining CDP-choline and galantamine: Effects of a selective a7 nicotinic acetylcholine receptor agonist strategy on P50 sensory gating of speech sounds in healthy volunteers. J Psychopharmacol 2019; 33: 688-99.
725. Nemkova SA, Semenov DV, Petrova EA, Savchenko DV, Zavadenko NN, Vozvyshaeva MY, et al. [Cognitive and emotional disorders in university students and teachers: the possibility of treatment with recognan (citicoline)]. Zh Nevrol Psikhiatr Im S S Korsakova 2018; 118: 11-8.
726. Nakazaki E, Mah E, Citrolo D, Watanabe F. Effect of citicoline on memory function in healthy order adults: a randomized, double-blind, placebo-controlled clinical trial. Current Developments in Nutrition 2020; 4 (Suppl 2): S1227.
727. Nakazaki E, Mah E, Sanoshy K, Citrolo D, Watanabe F. Citicoline and memory function in healthy older adults: a randomized, double-blind, placebo-controlled clinical trial. J Nutr 2021; 151: 2153-60.
728. Abad-Santos F, Novalbos-Reina J, Gallego-Sandín S, García AG. Tratamiento del deterioro cognitivo leve: utilidad de la Citicolina. Rev Neurol 2002; 35: 675-82.
729. Fioravanti M, Buckley AE. Citicoline (cognizin) in the treatment of cognitive impairment. Clin Interv Aging 2006; 1: 247-51.
730. Grieb P. Citicoline: a food that may improve memory. Med Sci Rev 2015; 2: 67-72.
731. Parnetti L, Mignini F, Tomassoni D, Traini E, Amenta F. Cholinergic precursors in the treatment of cognitive impairment of vascular origin: Ineffective approaches or need for re-evaluation? J Neurol Sci 2007; 257: 264-9.
732. Amenta F, Di Tullio MA, Tomassoni D. The cholinergic approach for the treatment of vascular dementia: evidence from pre-clinical and clinical studies. Clin Exp Hypertens 2002; 24: 697-713.
733. Gareri P, Castagna A, Cotroneo AM, Putignano S, De Sarro G, Bruni AC. The role of citicoline in cognitive impairment: pharmacological characteristics, possible advantages, and doubts for an old drug with new perspectives. Clin Interv Aging 2015; 10: 1421-9.
734. Secades JJ. Citicoline in the treatment of cognitive impairment. Neurol Exp Neurosci 2019; 5: 14-26.
735. Shimamoto K, Hirano T, Aramaki Y. Therapeutic mechanism of cytidine diphosphate choline (CDP-choline) in parkinsonism. J Takeda Res Lab 1975; 34: 440-8.
736. Ruggieri S, Zamponi A, Casacchia M, Agnoli A. Effetti terapeutici della citicolina (citidin-difosfo-colina) nella sindrome parkinsoniana. Cl Terap 1976; 78: 515-25.
737. Agnoli A, Ruggieri S, Denaro A, Bruno G. New strategies in the management of Parkinson’s disease: a biological approach using a phospholipid precursor (CDP-choline). Neuropsychobiology 1982; 8: 289-96.
738. Agnoli A, Ruggieri S, Baldassarre M, Stocchi F, Del Roscio S, Gallucci M, et al. Current concept in the treatment of Parkinson disease: use of citicoline. In Yahr MD, ed. Current concepts of Parkinson disease and related disorders. Amsterdam: Excerpta Medica; 1983. p. 124-40.
739. Eberhardt R, Gerstenbrand F, Klingler D, Birbamer G, Ransmayr G. Estudio sobre la eficacia de la combinación de CDP-colina y levodopa más un inhibidor de la decarboxilasa en pacientes con enfermedad de Parkinson. Med Clin (Barc) 1986; 87 (Supl 1): S34-40.
740. Poewe W, Gerstenbrand F. New trends in the therapy of Parkinson’s disease. In Agnoli A, Bertolani G, eds. Atti della 8 Riunione della Lega Italiana per la Lotta Contro il Morbo di Parkinson e le Malattie Extrapiramidali. Roma: D. Guanella; 1982. p. 171-88.
741. Eberhardt R, Birbamer G, Gerstenbrand F, Rainer E, Traegner H. Citicoline in the treatment of Parkinson’s disease. Clin Ther 1990; 12: 489-95.
742. Birbamer G, Gerstenbrand F, Rainer E, Eberhardt R. CDP-choline in the treatment of Parkinson syndrome. New Trends Clin Neuropharmacol 1990; 4: 29-34.
743. Loeb C, Albano C, Caraceni T, Caraffa T, Coppi R, Di Perri R, et al. CDP-choline in the treatment of Parkinson’s disease: a multicenter controlled trial. In Zappia V, Kennedy EP, Nilsson BI, Galletti P, eds. Novel biochemical, pharmacological and clinical aspects of cytidinediphosphocholine. Amsterdam: Elsevier Science Publishing; 1985. p. 339-46.
744. Acosta J, Nombela M, Palao A, Pastor M, Recuero J. Multicentre trial: treatment of Parkinson’s disease with CDP-choline (citicholine). In Bartko D, Turcáni P, Stern G, eds. New trends in clinical neuropharmacology: calcium antagonists, acute neurology, headache and movement disorders. London: John Libbey; 1988. p. 289-96.
745. Cubells JM, Hernando C. Clinical trial on the use of cytidine diphosphate choline in Parkinson’s disease. Clin Ther 1988; 10: 664-71.
746. Martí-Massó JF, Urtasun M. Citicoline in the treatment of Parkinson’s disease. Clin Ther 1991; 13: 239-42.
747. García-Más A, Rossiñol A, Roca M, Lozano R, Rosselló J, Llinás J. Efectos de la citicolina en la demencia subcortical asociada a la enfermedad de Parkinson valorada mediante electroencefalografía cuantificada. Clin Ther 1992; 14: 718-29.
748. Mubaidin A, Al-Dwairi AR, Nofal R, Wreikat A. Citicoline in the treatment of essential tremor. JRMS 2011; 18: 20-5.
749. Que DS, Jamora RDG. Citicoline as adjuvant therapy in parkinson’s disease: a systematic review. Clin Ther 2021; 43: e19-31.
750. Chinchilla A López-Ibor JJ, Vega M, Camarero M. CDP-colina en la evolución de las funciones mentales en el síndrome de abstinencia alcohólica. Psiquiat Biol 1995; 2: 171-5.
751. Brown ES, Van Enkevort E, Kulikova A, Escalante C, Nakamura A, Ivleva EI, et al. A randomized, double-blind, placebo-controlled trial of citicoline in patients with alcohol use disorder. Alcohol Clin Exp Res 2019 Feb; 43: 317-23.
752. Kang S, Choi DS. Possible benefit and validity of supplements for alcohol use disorder. Alcohol Clin Exp Res 2019; 43: 780-2.
753. Shen WW. Anticraving therapy for alcohol use disorder: a clinical review. Neuropsychopharmacol Rep 2018; 38: 105-16.
754. Renshaw PF, Daniels S, Lundahl LH, Rogers V, Lukas SE. Short-term treatment with citicoline (CDP-choline) attenuates some measures of craving in cocaine-dependent subjects: a preliminary report. Psychopharmacology 1999; 142: 132-8.
755. Lukas SE, Kouri EM, Rhee C, Madrid A, McNeil J, Renshaw PF. Citicoline treatment for cocaine abuse: effects of acute cocaine challenge on subjective mood and cardiovascular responses in adult male and female volunteers. Drug and Alcohol Dependence 2001; 63 (Suppl 1): S94.
756. Lukas SE, Kouri EM, Rhee C, Madrid A, Renshaw PF. Effects of short-term citicoline treatment on acute cocaine intoxication and cardiovascular effects. Psychopharmacology 2001; 157: 163-7.
757. Bracken BK, Penetar DM, Rodolico J, Ryan ET, Lukas SE. Eight weeks of citicoline treatment does not perturb sleep/wake cycles in cocaine-dependent adults. Pharmacol Biochem Behav 2011; 98: 518-24.
758. Salloum IM, Brown ES. Management of comorbid bipolar disorder and substance use disorders. Am J Drug Alcohol Abuse 2017; 43: 366-76.
759. Licata SC, Penetar DM, Ravichandran C, Rodolico J, Palmer C, Berko J, et al. Effects of daily treatment with citicoline: a double-blind, placebo-controlled study in cocaine-dependent volunteers. J Addict Med 2011; 5: 57-64.
760. Brown ES, Gorman AR, Hynan LS. A randomized, placebo-controlled trial of citicoline add-on therapy in outpatients with bipolar disorder and cocaine dependence. J Clin Psychopharmacol 2007; 27: 498-502.
761. Brown ES, Todd JP, Hu LT, Schmitz JM, Carmody TJ, Nakamura A, et al. A randomized, double-blind, placebo-controlled trial of citicoline for cocaine dependence in bipolar disorder. Am J Psychiatry 2015; 172: 1014-21.
762. Brown ES, Gabrielson B. A randomized, double-blind, placebo-controlled trial of citicoline for bipolar and unipolar depression and methamphetamine dependence. J Affect Disord 2012; 143: 257-60.
763. Gruber SA, Sagar KA, Dahlgren MK, Gonenç A, Conn N, Winer JP, et al. Citicoline treatment improves measures of impulsivity and task performance in chronic marijuana smokers: a pilot BOLD fMRI study. Int J Neurol Neurother 2015; 2: 032.
764. Ross BM, Moszczynska A, Peretti FJ, Adams V, Schmunk GA, Kalasinsky KS, et al. Decreased activity of brain phospholipid metabolic enzymes in human users of cocaine and methamphetamine. Drug Alcohol Depend 2002; 67: 73-9.
765. Yoon SJ, Lyoo IK, Kim HJ, Kim TS, Sung YH, Kim N, et al. Neurochemical alterations in methamphetamine-dependent patients treated with cytidine-5’-diphosphate choline: a longitudinal proton magnetic resonance spectroscopy study. Neuropsychopharmacology 2010; 35: 1165-73.
766. Lukas SE. New perspectives on using brain imaging to study CNS stimulants. Neuropharmacology 2014; 87: 104-14.
767. Jeong H, Yoon S, Sung YH, Kim J, Lyoo IK, Yurgelun-Todd DA, et al. Effects of cytidine-5’-diphosphate choline on gray matter volumes in methamphetamine-dependent patients: a randomized, double-blind, placebo-controlled study. J Psychiatr Res 2021; 143: 215-21.
768. Killgore WD, Ross AJ, Kamiya T, Kawada Y, Renshaw PF, Yurgelun-Todd DA. Citicoline affects appetite and cortico-limbic responses to images of high-calorie foods. Int J Eat Disord 2010; 43: 6-13.
769. Preuss UW, Schaefer M, Born C, Grunze H. Bipolar disorder and comorbid use of illicit substances. Medicina (Kaunas) 2021; 57: 1256.
770. Wignall ND, Brown ES. Citicoline in addictive disorders: a review of the literature. Am J Drug Alcohol Abuse 2014; 40: 262-8.
771. Campos EC, Schiavi C, Benedetti P, Bolzani R, Porciatti V. Effect of citicoline on visual acuity in amblyopia: preliminary results. Graefes Arch Clin Exp Ophthalmol 1995; 233: 307-12.
772. Campos EC, Bolzani R, Schiavi C, Baldi A, Porciatti V. Cytidin-5’-diphosphocholine enhances the effect of part-time occlusion in amblyopia. Doc Ophthalmol. 1997; 93: 247-63.
773. Campos EC. Future directions in the treatment of amblyopia. Lancet 1997; 349: 1190.
774. Porciatti V, Schiavi C, Benedetti P, Baldi A, Campos EC. Cytidine-5’-diphosphocholine improves visual acuity, contrast sensitivity and visually-evoked potentials of amblyopic subjects. Curr Eye Res 1998; 17: 141-8.
775. Simons K. Amblyopia characterization, treatment, and prophylaxis. Surv Ophthalmol 2005; 50: 123-66.
776. Campos EC, Fresina M. Medical treatment of amblyopia: present state and perspectives. Strabismus 2006; 14: 71-3.
777. Fresina M, Dickmann A, Salerni A, De Gregorio F, Campos EC. Effect of oral CDP-choline on visual function in young amblyopic patients. Graefes Arch Clin Exp Ophthalmol 2008; 246: 143-50.
778. Roberti G, Tanga L, Michelessi M, Quaranta L, Parisi V, Manni G, et al. Cytidine 5’-diphosphocholine (citicoline) in glaucoma: rationale of its use, current evidence and future perspectives. Int J Mol Sci 2015; 16: 28401-17.
779. Pawar PV, Mumbare SS, Patil MS, Ramakrishnan S. Effectiveness of the addition of citicoline to patching in the treatment of amblyopia around visual maturity: a randomized controlled trial. Indian J Ophthalmol 2014; 62: 124-9.
780. Furtado de Mendonça RH, Ferreira EL. Visual evoked potentials (VEP) and visual acuity improvement after cytidine 5’-diphosphocholine (CDP-Choline) therapy in amblyopic patient. Rev Bra Oftalmol 2012; 71: 328-30.
781. Gore C, Wu C. Medical therapies of amblyopia: translational research to expand our treatment armamentarium. Semin Ophthalmol 2016; 31: 155-8.
782. Sabetti L, Masedu F, Tresca C, Bianchi F, Valenti M. The use of choline in association with the Bangerter filters for the treatment of amblyopia. Int J Ophthalmol 2017; 10: 1777-8.
783. Narula A, Kumar R, Singh S, Yadav M. Efficacy of citicolline in treatment of amblyopia as an adjunct to patching. JOJ Ophthal 2018; 7: JOJO.MS.ID.555706.
784. Gopal SKS, Kelkar J, Kelkar A, Pandit A. Simplified updates on the pathophysiology and recent developments in the treatment of amblyopia: A review. Indian J Ophthalmol 2019; 67: 1392-9.
785. Vagge A, Ferro Desideri L, Traverso CE. An update on pharmacological treatment options for amblyopia. Int Ophthalmol 2020; 40: 3591-3597.
786. Nambudiri S, Geetha Kumari PV, Sudha V, Sinumol S. Amblyopia – An update. Kerala Journal of Ophthalmology 2021; 33: 14-21.
787. Parisi V, Manni G, Colacino G, Bucci MG. Cytidine-5’-diphosphocholine (citicoline) improves retinal and cortical responses in patients with glaucoma. Ophthalmology. 1999; 106: 1126-34.
788. Parisi V. Electrophysiological assessment of glaucomatous visual dysfunction during treatment with cytidine-5’-diphosphocholine (citicoline): a study of 8 years of follow-up. Doc Ophthalmol 2005; 110: 91-102.
789. Virno M, Pecori-Giraldi J, Liguori A, De Gregorio F. The protective effect of citicoline on the progression of the perimetric defects in glaucomatous patients (perimetric study with a 10-year follow-up). Acta Ophthalmol Scand 2000; 78: 56-7.
790. Grieb P, Rejdak R Pharmacodynamics of citicoline relevant to the treatment of glaucoma. J Neurosci Res 2002; 67: 143-8.
791. Rejdak R, Toczolowski J, Kurkowski J, Kaminski ML, Rejdak K, Stelmasiak Z, et al. Oral citicoline treatment improves visual pathway function in glaucoma. Med Sci Monit 2003; 9: PI24-8.
792. Parisi V, Coppola G, Centofanti M, Oddone F, Angrisani AM, Ziccardi L, et al. Evidence of the neuroprotective role of citicoline in glaucoma patients. Prog Brain Res 2008; 173: 541-54.
793. Bagnis A, Papadia M, Scotto R, Traverso CE. Current and emerging medical therapies in the treatment of glaucoma. Expert Opin Emerg Drugs 2011; 16: 293-307.
794. Slepova OS, Frolov MA, Morozova NS, Frolov AM, Lovpache DN. [Markers of Fas-mediated apoptosis in primary open-angle glaucoma and opportunities of their pharmacological correction]. Vestn Oftalmol 2012; 128: 27-31.
795. Ottobelli L, Manni GL, Centofanti M, Iester M, Allevena F, Rossetti L. Citicoline oral solution in glaucoma: is there a role in slowing disease progression? Ophthalmologica 2013; 229: 219-26.
796. Roberti G, Tanga L, Parisi V, Sampalmieri M, Centofanti M, Manni G. A preliminary study of the neuroprotective role of citicoline eye drops in glaucomatous optic neuropathy. Indian J Ophthalmol 2014; 62: 549-53.
797. Roberti G, Tanga L, Michelessi M, Quaranta L, Parisi V, Manni G, et al. Cytidine 5’-diphosphocholine (citicoline) in glaucoma: rationale of its use, current evidence and future perspectives. Int J Mol Sci 2015; 16: 28401-17.
798. Grieb P, Jünemann A, Rekas M, Rejdak R. Citicoline: A food beneficial for patients suffering from or threated with glaucoma. Front Aging Neurosci 2016; 8: 73.
799. Miratalievna TD. Use of citicoline for the complex therapy of patients suffering from the primary open-angle glaucoma. Eur Sci Revc 2016; 11-12: 92-5.
800. Parisi V, Oddone F, Ziccardi L, Roberti G, Coppola G, Manni G. Citicoline and Retinal ganglion cells: effects on morphology and function. Curr Neuropharmacol 2017; 15: 1-14.
801. Iulia C, Ruxandra T, Costin LB, Liliana-Mary V. Citicoline - a neuroprotector with proven effects on glaucomatous disease. Rom J Ophthalmol 2017; 61: 152-8.
802. Faiq MA, Wollstein G, Schuman JS, Chan KC. Cholinergic nervous system and glaucoma: from basic science to clinical applications. Prog Retin Eye Res 2019; 72: 100767.
803. Lanza M, Gironi Carnevale UA, Mele L, Bifani Sconocchia M, Bartollino S, et al. Morphological and Functional Evaluation of Oral Citicoline Therapy in Chronic Open-Angle Glaucoma Patients: A Pilot Study With a 2-Year Follow-Up. Front Pharmacol 2019; 10: 1117.
804. Chitu I, Voinea LM, Istrate S, Vrapciu A, Ciuluvica RC, Tudosescu R. The neuroprotective role of citicoline treatment in glaucoma - 6 months results of a prospective therapeutic trial. Rom J Ophthalmol 2019; 63: 222-30.
805. Erb C. [Secondary Neuroprotection in Glaucoma Through the Concepts of Complementary Drug Therapy]. Klin Monbl Augenheilkd 2020; 237: 163-74.
806. Verdina T, Passarelli N, Carlini A, Chemello F, Mastropasqua R, Cavallini GM. Association of ultrapure citicoline, homotaurine and vitamin e in the management of normotensive glaucoma: a case report. Case Rep Ophthalmol 2020; 11: 222-8.
807. Marino PF, Rossi GCM, Campagna G, Capobianco D, Costagliola C, on behalf of Qualicos Study Group. Effects of citicoline, homotaurine, and vitamin E on contrast sensitivity and visual-related quality of life in patients with primary open-angle glaucoma: a preliminary study. Molecules 2020; 25: 5614.
808. Arrico L, Compagno S, Pacella F, Bianchini D, Borrazzo C, Turchetti P, et al. Effects of oral citicoline in perimetric glaucoma defects. Senses Sci 2021: 7: 1131-44.
809. Jünemann AGM, Grieb P, Rejdak R. Bedeutung von Citicolin bei der Glaukomerkrankung [The role of citicoline in glaucoma]. Ophthalmologe.2021; 118: 439-48.
810. van der Merwe Y, Murphy MC, Sims JR, Faiq MA, Yang XL, Ho LC, et al. Citicoline modulates glaucomatous neurodegeneration through intraocular pressure-independent control. Neurotherapeutics 2021; 18: 1339-59.
811. Skopinski P, Radomska-Lesniewska DM, Izdebska J, Kaminska A, Kupis M, Kubiak AJ, et al. New perspectives of immunomodulation and neuroprotection in glaucoma. Cent Eur J Immunol 2021; 46: 105-10.
812. Putri VC, Asrory VDO. Comparison of the effect of 1000 mg and 500 mg oral citicoline on visual field and ganglion cell layer thickness in primary open angle glaucoma. Open Access Journal of Ophthalmology 2022; 7: 000234.
813. Sahin AK, Kapti HB, Uzun A. Effect of oral citicoline therapy on retinal nerve fiber layer and ganglion cell-inner plexiform layer in patients with primary open angle glaucoma. Int J Ophthalmol 2022; 15: 483-8.
814. Rossi GCM, Rolle T, De Silvestri A, Sisto D, Mavilio A, Mirabile AV, et al. Multicenter, prospective, randomized, single blind, cross-over study on the effect of a fixed combination of citicoline 500 mg plus homotaurine 50 mg on pattern electroretinogram (perg) in patients with open angle glaucoma on well controlled intraocular pressure. Front Med (Lausanne) 2022; 9: 882335.
815. Parisi V, Coppola G, Ziccardi L, Gallinaro G, Falsini B. Cytidine-5’-diphosphocholine (Citicoline): a pilot study in patients with non-arteritic ischaemic optic neuropathy. Eur J Neurol 2008; 15: 465-74.
816. Parisi V, Barbano L, Di Renzo A, Coppola G, Ziccardi L. Neuroenhancement and neuroprotection by oral solution citicoline in non-arteritic ischemic optic neuropathy as a model of neurodegeneration: A randomized pilot study. PLoS One 2019; 14: e0220435.
817. Fragiotta S, Pinazo-Durán MD, Scuderi G. Understanding neurodegeneration from a clinical and therapeutic perspective in early diabetic retinopathy. Nutrients 2022; 14: 792.
818. Parisi V, Oddone F, Roberti G, Tanga L, Carnevale C, Ziccardi L, et al. Enhancement of retinal function and of neural conduction along the visual pathway induced by treatment with citicoline eye drops in liposomal formulation in open angle glaucoma: a pilot electrofunctional study. Adv Ther 2019; 36: 987-96.
819. Rossetti L, Iester M, Tranchina L, Ottobelli L, Coco G, Calcatelli E, et al. Can treatment with citicoline eyedrops reduce progression in glaucoma? The results of a randomized placebo-controlled clinical trial. J Glaucoma 2020; 29: 513-20.
820. Novak LP, Tumanova OV. Citicoline in ophthalmologic practice: neuroprotection in ischemic optic neuropathy, diabetic retinopathy and amblyopia. Archive of Ukrainian Ophthalmology 2021; 9: 28-33.
821. Carnevale C, Manni G, Roberti G, Micera A, Bruno L, Cacciamani A, et al. Human vitreous concentrations of citicoline following topical application of citicoline 2% ophthalmic solution. PLoS One 2019; 14: e0224982.
822. Tokuc EO, Yuksel N, Rencber SF, Ozturk A, Duruksu G, Yazir Y, et al. Protective effects of citicoline-containing eye drops against UVB-Induced corneal oxidative damage in a rat model. Exp Eye Res 2021; 208: 108612.
823. Parisi V, Ziccardi L, Barbano L, Giorno P, Varano M, Parravano M. Citicoline and vitamin B12 eye drops in type 1 diabetes: results of a 36-month pilot study evaluating macular electrophysiological changes. Adv Ther 2021; 38: 3924-36.
824. Fogagnolo P, Melardi E, Tranchina L, Rossetti L. Topical citicoline and vitamin B12 versus placebo in the treatment of diabetes-related corneal nerve damage: a randomized double-blind controlled trial. BMC Ophthalmol 2020; 20: 315.
825. Cinar E, Yuce B, Aslan F, Erbakan G. Neuroprotective effect of citicoline eye drops on corneal sensitivity after LASIK. J Refract Surg 2019; 35: 764-70.
826. Cinar E, Yuce B, Aslan F, Erbakan G. Effect of neuroprotective citicoline eye drops on macular microcirculation. Int Ophthalmol 2020; 40: 2237-46.
827. Oddone F, Rossetti L, Parravano M, Sbardella D, Coletta M, Ziccardi L, et al. Citicoline in ophthalmological neurodegenerative disease: a comprehensive review. Pharmaceuticals (Basel) 2021; 14: 281.
828. Yao W, Li TM. Clinical observation on citicoline sodium tablets treating facial neuritis. Med J West China 2010; 22: 1053-4.
829. Carrascosa-Romero MC, Suela J, Alfaro-Ponce B, Cepillo-Boluda AJ. Ictiosis ligada al cromosoma X asociada a epilepsia, hiperactividad, autismo y retraso mental, port microdeleccion Xp22.31 [X-chromosome-linked ichthyosis associated to epilepsy, hyperactivity, autism and mental retardation, due to the Xp22.31 microdeletion]. Rev Neurol 2012; 54: 241-8.
830. Lay-Son Rivas L, Trujillo-Godoy O, Alvarado-Pastenes M. Encefalopatía tardía por monóxido de carbono de curso reversible en un paciente tratado con citicolina [Delayed-onset encephalopathy caused by carbon monoxide poisoning: Resolution in a patient treated with citicoline]. Neurologia 2015; 30: 453-5.
831. Zinkovsky ÀÊ, Musina LO, Zinkovsky KA, Moroseeva EA. Dynamics of change of infrared spectrum of blood serum of women with varying degrees of progression of epilepsy before and after ceraxon treatment. Modern Problems of Science and Education 2012; 2: 1-7.
832. Petrova D, Maslarov D, Angelov I, Zekin D. Analysis of therapeutic efficacy of citicoline in patients with vertigo of central origin and vascular aetiology. Am J Neuroprotec Neuroregen 2012; 4: 1-8.
833. Roohi-Azizi M, Arabzadeh S, Amidfar M, Salimi S, Zarindast MR, Talaei A, et al. Citicoline Combination therapy for major depressive disorder: a randomized, double-blind, placebo-controlled trial. Clin Neuropharmacol 2017; 40: 1-5.
834. Kalyn Y, Gavrilova S, Safarova T, Shipilova E. Comparative efficacy and safety of antidepressive mono- and multimodal therapy with citicoline in elderly patients with depression in psychogeriatric unit. 24th European Congress of Psychiatry, 2016.
835. Aidelbaum R, Labelle A, Baddeley A, Knott V. Assessing the acute effects of CDP-choline on sensory gating in schizophrenia: a pilot study. J Psychopharmacol 2018; 32: 541-51.
836. Ghajar A, Gholamian F, Tabatabei-Motlagh M, Afarideh M, Rezaei F, Ghazizadeh-Hashemi M, et al. Citicoline (CDP-choline) add-on therapy to risperidone for treatment of negative symptoms in patients with stable schizophrenia: a double-blind, randomized placebo-controlled trial. Hum Psychopharmacol 2018; 33: e2662.
837. Aidelbaum R, Labelle A, Choueiry J, Knott V. The acute dose and baseline amplitude-dependent effects of CDP-choline on deviance detection (MMN) in chronic schizophrenia: a pilot study. Exp Clin Psychopharmacol 2022; 30: 235-48.
838. Hall DA, Robertson EE, Leehey M, McAsey A, Ouyang B, Berry-Kravis E, et al. Open-label pilot clinical trial of citicoline for fragile X-associated tremor/ataxia syndrome (FXTAS). PLoS One 2020; 15: e0225191.
839. Elzupir AO. Molecular docking and dynamics investigations for identifying potential inhibitors of the 3-chymotrypsin-like protease of SARS-CoV-2: repurposing of approved pyrimidonic pharmaceuticals for COVID-19 treatment. Molecules 2021; 26: 7458.
840. Skripuletz T, Manzel A, Gropengießer K, Schäfer N, Gudi V, Singh V, et al. Pivotal role of choline metabolites in remyelination. Brain 2015; 138: 398-413.
841. Grieb P. Beneficial effects of exogenous CDP-choline (citicoline) in EAE. Brain 2015; 138: e388.
842. Skripuletz T, Gudi V, Baumgärtner W, Linker RA, Stangel M. Reply: beneficial effects of exogenous CDP-choline (citicoline) in EAE. Brain 2015; 138: e389.
843. Skripuletz T, Linker RA, Stangel M. The choline pathway as a strategy to promote central nervous system (CNS) remyelination. Neural Regen Res 2015; 10: 1369-70.
844. Grieb P, Swiatkiewicz M, Kaminska A, Jünemann A, Rejdak R, Rejdak K. Citicoline: a candidate for adjunct treatment of multiple sclerosis. Pharmaceuticals (Basel) 2021; 14: 326.
845. Nasiri J, Kargar M. Combination of citicoline and physiotherapy in children with cerebral palsy. Int J Prev Med 2014; 5: 1308-13.
846. Yevtushenko SK, Yanovskaya NV, Yevtushenko OS, Lisovsky YV. [Ceraxon as effective neuroprotector in treatment of children of the first year of the life with organic threatens of CNS]. Int J Neurol 2007; 3: 21-5.
847. Warsiki E. CDP choline therapy on some cases of children with organic brain syndrome. Folia Medica Indonesiana 2004; 40: 43-7.
848. Issayevaa R, Pushkarev K. CDP-choline (ceraxon) treatment with hypoxia in the newborn infant. J Neurol Sci 2013; 333: e537-8.
849. Wang XL, Yu SL, Yu T, Li JH, Guo P, Liang HT. Treatment of neonatal hypoxic-ischaemic encephalopathy (HIE) with compound salvia miltiorrhizae and citicoline: a comparative study in China. Singapore Pediatr J 1997; 39: 120-3.
850. Zhang JN. Effect of NGF combined with citicoline + cerebroprotein hydrolysate on neurobehavioral development and serum indexes in neonatal hypoxic ischemic encephalopathy. Journal of Hainan Medical University 2016; 22: 1-4.
851. Liang SP, Chen Q, Cheng YB, Xue YY, Wang HJ. Comparative effects of monosialoganglioside versus citicoline on apoptotic factor, neurological function and oxidative stress in newborns with hypoxic-ischemic encephalopathy. J Coll Physicians Surg Pak 2019; 29: 324-7.
852. Khushdil A, Ahmed Z, Ehsan A. Role of citicoline in treatment of moderate to severe birth asphyxia: a pilot project. J Coll Physicians Surg Pak 2021; 31: 1511-2.
853. Siddiqui AP, Lennerstrand G, Pansell T, Rydberg A. Citicoline treatment of children with visual impairment; a pilot study. Pak J Ophthalmol 2012; 28: 172-8.
854. Loebis R, Zulkarnain BS, Siswanto FA. Effectiveness of citicoline in pediatric patients with refractive amblyopia in Surabaya, East Java, Indonesia. J Basic Clin Physiol Pharmacol 2021; 32: 657-661.
855. Díaz-Atienza J, Compám F, Blázquez P, Sánchez F. Neurophysiologic abnormalities in developmental dysphasias and response to CDP-choline. Adv Ther 1998; 15: 8-13.
856. Castro-Gago M, Dacruz D, Gomez-Lado C, Eiris-Punal J. Tratamiento de la deficiencia en colinacinasa beta con citicolina. Rev Neurol 2018; 67: 40.
857. Salamah A, Mehrez M, Faheem A, El Amrousy D. Efficacy of citicoline as a neuroprotector in children with post cardiac arrest: a randomized controlled clinical trial. Eur J Pediatr 2020; 180: 1249-55.
858. Ley R. Ensayo clínico con CDP-colina en neuropsiquiatría infantil. Rev Esp Pediatr 1980; 36: 3-6.
859. Espadaler JM. Ensayo clínico en el tratamiento de los trastornos del aprendizaje del niño. Med Clin (Barc) 1978; 71: 357-61.
860. Al Mosawi AJ, the use of cerebrolysin and citicoline in autism and Asperger syndrome. J Bio Innov 2019; 8: 99-108.
861. Al Mosawi AJ. The use of citicoline in pediatric neurology and pediatric psychiatry. Austin Pediatr 2019; 6: 1071.
862. Dinsdale JRM, Griffths GK, Castelló J, Maddock J, Ortiz JA, Aylward M. CDP-choline: repeated oral dose tolerance studies in adult healthy volunteers. Arzneimittelforschung. 1983; 33: 1061-5.
863. Lozano R. Efficay and safety of oral CDP-choline. Drug surveillance study in 2817 cases. Arzneimittelforschung 1983; 33: 1073-80.
864. Tardner P. Can Citicoline Cause Depression?: a review of the clinical literature. IJEST 2020.
865. Synoradzki K, Grieb P. Citicoline: a superior form of choline? Nutrients 2019; 11: 1569.
866. Milani M. Citicoline as coadiuvant treatment of cognitive impairment in chronic degenerative central nervous system diseases and in ischemic stroke: a review of available data. Online Journal of Medicine and Medical Science Research 2013; 2: 13-8.
867. Rajguru M, Agrawal A, Sampath Kumar NS, Anil Kumar T. An overview of clinical and therapeutic implications of citicoline. Narayana Med J 2014; 3: 54-60.
868. Putilina MV. [A personalized selection of choline precursors in evidence - based medicine]. Zh Nevrol Psikhiatr Im S S Korsakova 2020; 120: 144-51.
869. Jasielski P, Piedel F, Piwek M, Rocka A, Petit V, Rejdak K. Application of citicoline in neurological disorders: a systematic review. Nutrients 2020; 12: 3113.
870. Piotrowska J, Kryczyk-Poprawa A, Muszyska B, Pilc A, Opoka W. Application of citicoline in supporting therapy of selected diseases. Acta Poloniae Pharmaceutica - Drug Research 2021; 78: 591-8.
871. Kopka M, Sochacki R. 10 reasons why to use citicoline. Medycyne Faktow 2022; 15: 54.
Citicoline: pharmacological and clinical review, 2022 update
Summary. This review is based on the previous one published in 2016 (Secades JJ. Citicoline: pharmacological and clinical review, 2016 update. Rev Neurol 2016; 63 (Supl 3): S1-S73), incorporating 176 new references, having all the information available in the same document to facilitate the access to the information in one document. This review is focused on the main indications of the drug, as acute stroke and its sequelae, including the cognitive impairment, and traumatic brain injury and its sequelae. There are retrieved the most important experimental and clinical data in both indications.
Key words. Alcoholism. Alzheimer disease. Amblyopia. Apoptosis. CDP-choline. Cerebral edema. Cerebral ischemia. Citicoline. Cognitive disorder. Drug addiction. Glaucoma. Head injury. Memory. Neuronal membrane. Neuroplasticity. Neuroprotection. Neurorepair. Neurotransmission. Parkinson disease. Phosphatidylcholine. Phospholipase. Remyelination. Senile dementia. Stroke. Structural phospholipids. Traumatic brain injury.
|
© 2022 Revista de Neurología
 Castellano
Castellano
 English
English






























