Long-term follow-up on the effects of sodium oxybate on daytime sleepiness and sleep architecture in patients with narcolepsy type 1
Introduction. Sodium oxybate (SXB) was administered for the first time in 1979 in 16 patients with narcolepsy with cataplexy (NT1) that improved up to 20 months.
Aims. To evaluate the effect of SXB on daytime sleepiness and sleep architecture by video-polysomnography in a sample of 23 NT1 adult patients (13 men, 10 females) treated up to three years. Additional goal was to study the presence of sleep comorbidities.
Patients and methods. NT1 patients were diagnosed according to International Classification of Sleep Disorders, third edition. We conducted a longitudinal observational study and a video-polysomnography comparing the sleep parameters of patients treated with an initial nocturnal dose of 4.5 g of SXB after six months (FU-1), one year (FU-2) and three years (FU-3) of uninterrupted treatment. Video-polysomnography parameters were analyzed including apnea-hypopnea and periodic leg movements indexes.
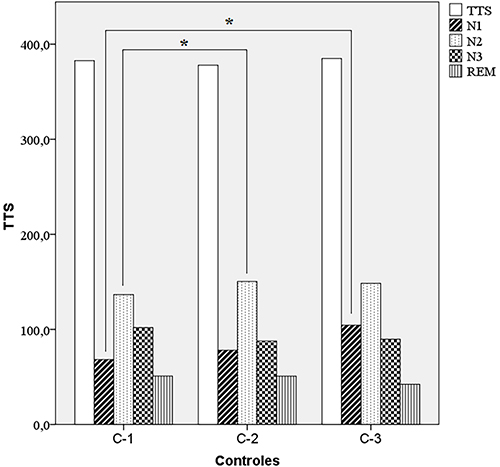
Results. Patients were HLA-DQB1*06:02 positive except a familial case. Thirteen patients (56%) discontinued SXB treatment over the three-year of the study. The two-nightly doses has been one of the reason for discontinuing treatment as well as insufficient compliance, mild or severe side effects, comorbidities and pregnancy. We found significant differences at FU-2 in sleep structure with an increased in stage N2 (p < 0.03) and a higher periodic leg movements index (p < 0.01). At FU-3 we found significant differences in sleep structure with an increase in stage N1 (p = 0.03) and in comorbidities (periodic leg movements an apnea-hypopnea indexes). There was not significant change on daytime sleepiness during the study.
Conclusions. SXB was administered in low-medium doses. Two-nightly doses and sleep fragmentation linked to sleep comorbidities at long-term lead to drug withdrawal.
Key words. Narcolepsy with cataplexy. Nocturnal disturbed sleep. Sleep fragmentation. Side effects. Sodium oxybate. Video-polysomnography.
|
 Castellano
Castellano
 English
English