Tabla I. Características sociodemográficas y clínicas de los grupos a estudio.
|
|
Quirúrgicos (n = 28)
|
TAVI (n = 18)
|
Valor de p
|
Edad (rango)
|
74,61 (63-87)
|
81,22 (70-88)
|
0b
|
Sexo (mujeres, %)
|
19 (68)
|
9 (50)
|
0,226
|
Nivel educativo (% 0, 1, 2, 3)a
|
4, 57, 25, 14
|
17, 78, 6, 0
|
0,007b
|
Hipertensión arterial (%)
|
17 (60)
|
9 (50)
|
0,474
|
Diabetes mellitus (%)
|
5 (18)
|
8 (44)
|
0,051
|
Audífono (%)
|
4 (14)
|
5 (28)
|
0,284
|
Capacidad intelectual previa (CI, rango)
|
95 (77-112)
|
88 (62-108)
|
0,07
|
CI: cociente intelectual; TAVI: implantación de prótesis transcatéter. a 0: sin estudios; 1: educación primaria; 2: educación secundaria; 3: estudios superiores; b p < 0,01 en las pruebas de χ2 o Fisher.
|
El análisis transversal prequirúrgico reflejó diferencias significativas entre los grupos a estudio en las pruebas de fluidez verbal, memoria libre verbal y visual, velocidad de procesamiento, funciones ejecutivas y capacidad visuoespacial (
p < 0,05) (Tabla II). Estas diferencias son compatibles con un rendimiento inferior del grupo TAVI en los dominios asociados a la corteza prefrontal, las vías frontosubcorticales y la región parietal posterior derecha, y vienen parcialmente determinadas por el nivel intelectual previo (Pearson cociente intelectual previo-medias escalares en los test: 0,665;
p < 0,001). Los resultados sugieren de nuevo una influencia alta de las variables de selección (edad, nivel educativo y cociente intelectual verbal previo) en el rendimiento neurocognitivo basal.
Tabla II. Rendimiento cognitivo basal.
|
| |
Test
|
Quirúrgicos
(n = 28)
|
TAVI
(n = 18)
|
Valor de p
|
Lenguaje
|
Denominación-BNT
|
9,5 (2,52)
|
8,5 (2,83)
|
0,232
|
FV semántica
|
16,97 (6,24)
|
13,35 (3,53)
|
0,033b
|
FV fonológica
|
11,53 (5,17)
|
7,53 (2,96)
|
0,004b
|
Velocidad de procesamiento
|
TMT-Aa
|
65,73 (28,43)
|
99,78 (57,57)
|
0,038b
|
Stroop P
|
85,81 (17,11)
|
65,87 (20,59)
|
0,001b
|
Stroop C
|
52,27 (11,34)
|
42,75 (11,03)
|
0,022b
|
Memoria de trabajo
|
Dígitos directos
|
7,18 (1,63)
|
6,67 (1,41)
|
0,281
|
Dígitos inversos
|
4,64 (1,68)
|
3,83 (1,79)
|
0,127
|
Localización directa
|
7,03 (2,1)
|
6 (1,28)
|
0,062
|
Localización inversa
|
4,96 (2,08)
|
4,22 (1,52)
|
0,388
|
Memoria verbal
|
FCSRT, recuerdo libre
|
12,43 (4,49)
|
9,02 (3,86)
|
0,008b
|
FCSRT, recuerdo facilitado
|
22,96 (6,36)
|
19,91 (7,49)
|
0,159
|
Memoria visual
|
Paisajes
|
42,32 (5,61)
|
38,28 (5,55)
|
0,018b
|
Funciones ejecutivas
|
TMT-Ba
|
199,04 (115,63)
|
332,78 (135,35)
|
0,002b
|
Stroop INT
|
22,58 (8,62)
|
15,13 (6,5)
|
0,005b
|
DEX-Spa
|
12,65 (10,71)
|
18,07 (9,69)
|
0,076
|
Praxias
|
TRO
|
8,14 (1,78)
|
6,65 (2,18)
|
0,017b
|
Pentágonos
|
0,6 (0,5)
|
0,65 (0,49)
|
0,791
|
BNT: test de vocabulario de Boston abreviado; DEX-Sp: cuestionario disejecutivo; FCSRT: test de recuerdo libre y selectivamente facilitado; FV: fluencia verbal; TAVI: implantación de prótesis transcatéter; TMT: Trail Making Test; TRO: test del reloj a la orden. a Puntuaciones superiores indican peor rendimiento obtenido; b p < 0,05 en las pruebas t de Student o U de Mann-Whitney.
|
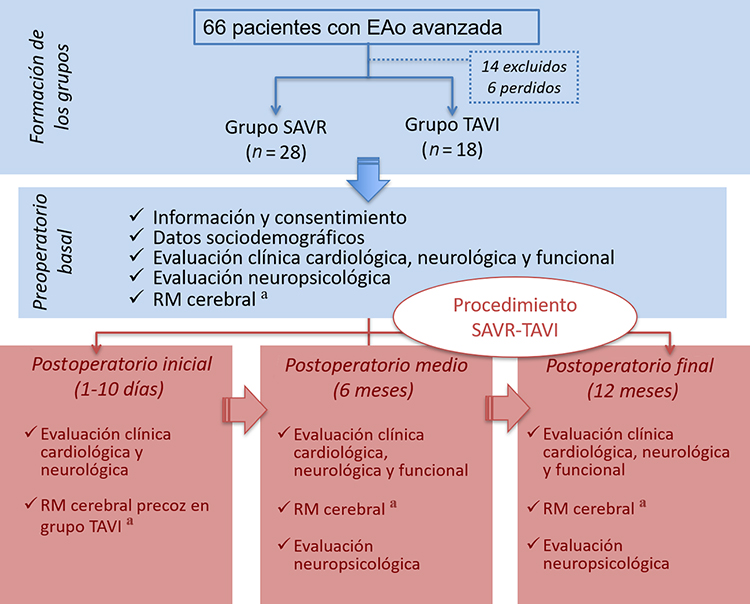
La media de puntuaciones en los tres momentos de medición indica una caída del rendimiento en funciones ejecutivas a los seis meses, que se recupera a los 12 meses (Tabla III y tendencia gráfica en la Fig. 2). En memoria se producen incrementos sostenidos del rendimiento en ambos momentos, a los seis y a los 12 meses (Fig. 3). Estas tendencias son similares en los dos grupos. La función visuoespacial y la denominación por confrontación visual muestran, por el contrario, retrocesos en ambos grupos a los seis meses, sin recuperación posterior de los niveles basales (Fig. 4). El índice de pacientes que presentan deterioro cognitivo es mayor en el grupo TAVI en todos los momentos de medición, y se mantiene sin cambios de consideración en el tiempo: oscila entre el 14 y el 21% en el grupo SAVR, y entre el 39 y el 44% en el TAVI.
Tabla III. Media de las puntuaciones en los tres grandes dominios neurocognitivos.
|
| |
Grupo
|
Basal
|
6 meses
|
12 meses
|
Funciones ejecutivasa
|
SAVR
|
9,96
|
9,67
|
9,88
|
|
TAVI
|
8,63
|
8,31
|
8,64
|
Memoriab
|
SAVR
|
9,44
|
10,18
|
10,57
|
|
TAVI
|
8,57
|
8,86
|
9,07
|
Visuoespacial y denominaciónc
|
SAVR
|
0,77
|
0,7
|
0,64
|
|
TAVI
|
0,56
|
0,45
|
0,46
|
SAVR: cirugía abierta de sustitución valvular; TAVI: implantación de prótesis transcatéter. a Media de puntuaciones escalares (media: 10; desviación estándar: 3) en las siguientes áreas de estudio: lenguaje, atención/velocidad de procesamiento, memoria de trabajo y funciones ejecutivas; b Media de puntuaciones escalares (media: 10; desviación estándar: 3) en el área de memoria verbal; c Media de puntuaciones dicotómicas (0: afectado; 1: preservado).
|
Figura 2. Tendencias gráficas de cada grupo en el dominio funciones ejecutivas (eje vertical: media de puntuaciones escalares). Para cada uno de los gráficos (funciones ejecutivas, memoria, visuoespacial y denominación) se recogen los tres momentos de evaluación en el eje horizontal: 1) datos agregados de la evaluación inicial o prequirúrgica; 2) datos agregados de la evaluación a los seis meses; y 3) datos agregados de la evaluación a los 12 meses.
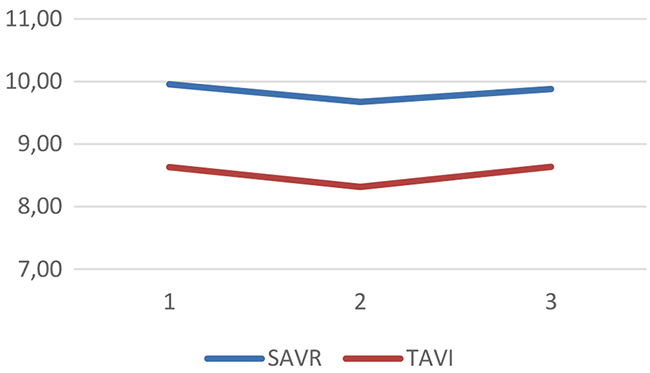
Figura 3. Tendencias gráficas de cada grupo en el dominio memoria (eje vertical: media de puntuaciones escalares).
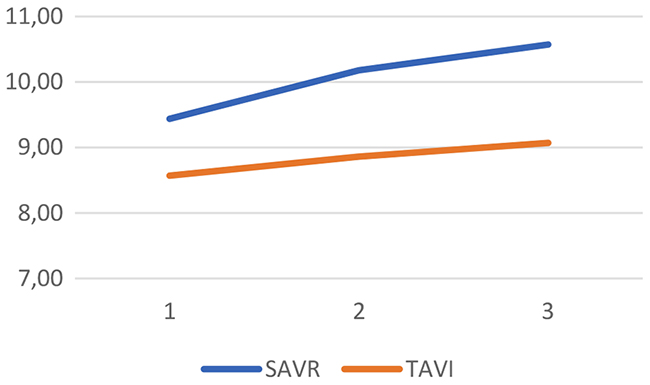
Figura 4. Tendencias gráficas de cada grupo en el dominio visuoespacial y denominación (eje vertical: media de puntuaciones dicotomizadas).
Atendiendo a la evolución posquirúrgica a medio y largo plazo, y centrándonos en primer lugar en la significación estadística de los test, encontramos que la función más afectada es el comportamiento ejecutivo y el control conductual que informan los familiares (test heteroinformado del cuestionario disejecutivo) (Tabla IV). El empeoramiento funcional ocurre en ambos grupos y en los dos momentos de medición (seis y 12 meses), con algunas diferencias: es más acusado en el grupo TAVI y a los 12 meses. En lo que respecta al resto de funciones, el grupo SAVR presenta una velocidad de procesamiento menor a los seis meses, que es capaz de recuperar a los 12. En memoria de trabajo espacial, por el contrario, los sujetos quirúrgicos no revierten sus resultados y éstos resultan significativamente más bajos a los 12 meses. En los TAVI, destaca, además, la instauración de anomia progresiva reflejada en la prueba de denominación por confrontación, que es significativamente más baja a los seis y a los 12 meses. En cuanto a las mejorías relativas en la ejecución postintervención, éstas son más destacadas en el grupo SAVR y en las pruebas de memoria libre y facilitada. La función mnésica también se recupera parcialmente en los TAVI a los seis meses, cuando se produce una mejora en el recuerdo libre. Las pruebas a 12 meses indican cierta mejoría en el recuerdo libre, no así en el recuerdo facilitado con claves.
Tablas IV. Evolución a los seis y 12 meses en cada subtest y área cognitiva a estudio (grupo SAVR, grupo TAVI).
|
Grupo quirúrgico
|
Área de estudio
|
Test
|
Basal
|
6 meses
|
Puntuaciones Z
(basal a 6 meses)
|
Valor de p
|
12 meses
|
Puntuaciones Z
(basal a 12 meses)
|
Valor de p
|
Valor de p
(basal, 6 y 12 meses)
|
Lenguaje
|
Denominación-BNT
|
9,5
|
9,29
|
–0,09
|
0,357
|
9,54
|
0,01
|
0,828
|
0,714
|
FV semántica
|
16,96
|
16,29
|
–0,11
|
0,611
|
16,68
|
–0,05
|
0,923
|
0,775
|
FV fonológica
|
11,54
|
10,36
|
–0,23
|
0,095
|
12,25
|
0,14
|
0,499
|
0,027c
|
Velocidad de
procesamiento
|
TMT-Aa
|
65,73
|
69
|
–0,11
|
0,78
|
66,82
|
–0,04
|
0,577
|
0,756
|
Stroop P
|
85,81
|
82,5
|
–0,19
|
0,109
|
83,61
|
–0,13
|
0,221
|
0,114
|
Stroop C
|
52,27
|
52,07
|
–0,01
|
0,819
|
55,75
|
0,26
|
0,02b
|
0,076
|
Memoria
de trabajo
|
Dígitos directos
|
7,18
|
7,64
|
0,28
|
0,374
|
7,18
|
0
|
0,921
|
0,347
|
Dígitos inversos
|
4,64
|
4,68
|
0,02
|
0,591
|
4,46
|
–0,11
|
0,481
|
0,406
|
Localización directa
|
7,04
|
6,54
|
–0,24
|
0,093
|
6,25
|
–0,37
|
0,048b
|
0,358
|
Localización inversa
|
4,96
|
4,82
|
–0,07
|
0,618
|
4,64
|
–0,15
|
0,201
|
0,639
|
Memoria verbal
|
FCSRT, recuerdo libre
|
12,43
|
13,52
|
0,23
|
0,238
|
14,14
|
0,43
|
0,026b
|
0,004c
|
FCSRT, recuerdo facilitado
|
22,96
|
24,52
|
0,21
|
0,155
|
24,34
|
0,22
|
0,044b
|
0,217
|
Memoria visual
|
Paisajes
|
42,32
|
41,93
|
–0,07
|
0,535
|
40,71
|
–0,29
|
0,148
|
0,1
|
Funciones
ejecutivas
|
TMT-Ba
|
199,04
|
230,74
|
–0,27
|
0,123
|
223,14
|
–0,21
|
0,989
|
0,376
|
Stroop INT
|
22,58
|
21,78
|
–0,09
|
0,466
|
24,11
|
0,18
|
0,676
|
0,364
|
DEX-Spa
|
12,65
|
13,81
|
–0,11
|
0,003b
|
17,81
|
–0,48
|
0,002b
|
0c
|
Praxias
|
TRO
|
8,14
|
7,5
|
–0,36
|
0,146
|
7,71
|
–0,24
|
0,431
|
0,308
|
Pentágonos
|
0,61
|
0,5
|
–0,22
|
0,366
|
0,5
|
–0,22
|
0,317
|
0,5
|
Grupo TAVI
|
Lenguaje
|
Denominación-BNT
|
8,5
|
6,89
|
–0,57
|
0,011b
|
7,17
|
–0,47
|
0,035b
|
0,016c
|
FV semántica
|
13,35
|
12,06
|
–0,36
|
0,133
|
12,22
|
–0,32
|
0,243
|
0,098
|
FV fonológica
|
7,53
|
8,5
|
0,33
|
0,358
|
8,17
|
0,22
|
0,308
|
0,861
|
Velocidad de procesamiento
|
TMT-Aa
|
99,78
|
92,33
|
0,13
|
0,556
|
96,72
|
0,05
|
0,811
|
0,678
|
Stroop P
|
65,88
|
61,44
|
–0,22
|
0,118
|
70,25
|
0,21
|
0,485
|
0,085
|
Stroop C
|
42,75
|
40,63
|
–0,19
|
0,333
|
43,25
|
0,05
|
0,641
|
0,155
|
Memoria de trabajo
|
Dígitos directos
|
6,67
|
6,22
|
–0,31
|
0,097
|
6,11
|
–0,39
|
0,066
|
0,058
|
Dígitos inversa
|
3,83
|
3,61
|
–0,12
|
0,305
|
3,78
|
–0,03
|
0,936
|
0,794
|
Localización directa
|
6
|
5,61
|
–0,3
|
0,368
|
5,39
|
–0,48
|
0,054
|
0,353
|
Localización inversa
|
4,22
|
3,94
|
–0,18
|
0,42
|
3,78
|
–0,29
|
0,34
|
0,601
|
Memoria verbal
|
FCSRT, recuerdo libre
|
9,02
|
10,25
|
0,26
|
0,049b
|
10,31
|
0,3
|
0,313
|
0,353
|
FCSRT, recuerdo facilitado
|
19,91
|
19,5
|
–0,12
|
0,124
|
19,4
|
–0,08
|
0,525
|
0,569
|
Memoria visual
|
Paisajes
|
38,28
|
37,5
|
–0,14
|
0,305
|
36,67
|
–0,29
|
0,414
|
0,554
|
Funciones ejecutivas
|
TMT-Ba
|
332,78
|
318,33
|
0,11
|
0,41
|
296,17
|
0,27
|
0,308
|
0,657
|
Stroop INT
|
15,13
|
15,11
|
0
|
0,505
|
16,00
|
0,13
|
0,569
|
0,982
|
DEX-Spa
|
18,07
|
21,47
|
–0,35
|
0,008b
|
24,53
|
–0,67
|
0,004b
|
0,002c
|
Praxias
|
TRO
|
6,65
|
6,28
|
–0,17
|
0,28
|
6,67
|
0,01
|
0,975
|
0,767
|
Pentágonos
|
0,65
|
0,39
|
–0,52
|
0,059
|
0,5
|
–0,3
|
0,18
|
0,121
|
BNT: test de vocabulario de Boston abreviado; DEX-Sp: cuestionario disejecutivo; FCSRT: test de recuerdo libre y selectivamente facilitado FV: fluencia verbal; TAVI: implantación de prótesis transcatéter; TMT: Trail Making Test; TRO: test del reloj a la orden. a Puntuaciones Z (media: 0; desviación estándar: 1) con signo invertido; b p < 0,05 prueba de rangos con signo de Wilcoxon; c p < 0,05 test de Friedman.
|