Introducción
La enfermedad de Parkinson idiopática (EP) y la esquizofrenia generalmente afectan a grupos de distinta edad, aunque pueden llegar a coexistir [1]. Los neurólogos y los psiquiatras nos hemos centrado en buscar la mejor combinación entre la dosis apropiada de levodopa y el antipsicótico más efectivo [2].
Caso clínico
Presentamos el caso de un varón de 51 años que empezó con pensamientos paranoides, alucinaciones auditivas y comportamiento adictivo a los 20. Se le diagnosticó esquizofrenia paranoide y se trató con antipsicóticos de primera generación. En los años sucesivos, el paciente tuvo varios ingresos hospitalarios y en instituciones psiquiátricas. Desde 2005, su evolución había sido parcialmente satisfactoria. Mantenía una relativa independencia y hacía terapia ocupacional, con gran apoyo familiar.
A finales de 2014, el paciente desarrolló un síndrome rígido acinético. Su tratamiento era clozapina (200 mg al día) y aripiprazol (15 mg al día), además de trihexifenidilo (5 mg tres veces al día), loracepam y trazodona. Se intentó que la interferencia dopaminérgica fuese la mínima posible. Se realizó un DaTscan® que resultó patológico (Fig. 1). Se probaron dosis mínimas de levodopa, pero los síntomas psicóticos se recrudecieron. Con tan solo 150 mg de levodopa al día, el paciente desarrollaba de nuevo ideas de daño y persecución, y alucinaciones, e incluso necesitó ingreso hospitalario. Se decidió entonces emplear una solución de levodopa pediátrica (5 mg/mL), aunque el paciente no toleró dosis superiores a 4 mL, que sólo lograban un alivio mínimo.
Figura 1. DaTscan® que muestra una captación reducida y asimétrica del trazado en ambos putámenes y el caudado derecho.

La enfermedad progresó notablemente. En 2019 tenía una marcada rigidez y acinesia bilateral, y era incapaz de erguirse o caminar unos pocos pasos sin ayuda. Tenía, además, disfagia y sialorrea. Perdió mucho peso y, debido a su pobre movilidad, desarrolló una marcada atrofia muscular (Vídeo 1).
Vídeo 1. El vídeo se grabó el primer día tras la intervención, con el sistema aún desconectado. Se puede observar el grave parkinsonismo y sus secuelas físicas. (Clique sobre la imagen para iniciar el vídeo.)
https://youtube.com/shorts/_WPzAVxD7OI
En esta situación, se evaluó al paciente para una estimulación cerebral profunda subtalámica (ECP-NST) por vía compasiva, como la única manera de poder lograr una mejoría motora en su caso. No se hizo prueba de levodopa debido a sus antecedentes, y también fue incapaz de completar la evaluación neuropsicológica prequirúrgica. Finalmente, se intervino al paciente en febrero de 2020 con anestesia general, sin complicaciones.
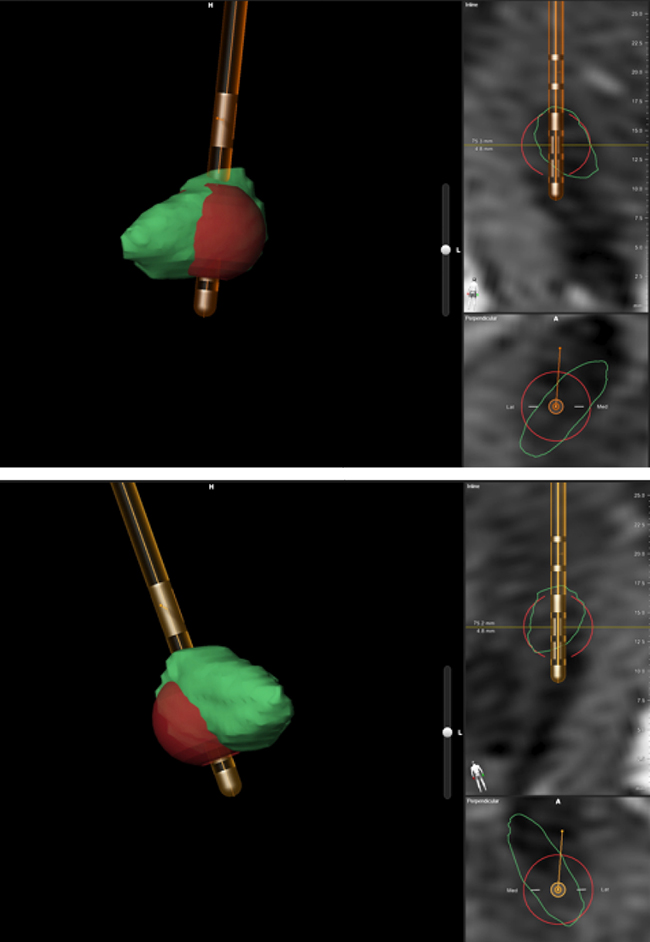
Seis meses después de la ECP-NST (Fig. 2), la mejoría era ya muy evidente. El paciente era capaz de erguirse solo sin ayuda y la marcha mejoró notablemente. Tenía moderada acinesia bilateral, predominante en las extremidades izquierdas. Además, la gravedad de la disfagia y la sialorrea disminuyó apreciablemente (Vídeo 2). Se suspendió el tratamiento con levodopa, mientras que el tratamiento antipsicótico no se modificó en ningún momento. No hemos identificado un empeoramiento en sus síntomas psiquiátricos. La escala de síntomas positivos y negativos es un cuestionario con 30 preguntas con un rango de siete respuestas posibles, en la que puntuaciones más altas reflejan un peor estado. Un año después de la intervención, se observó una leve mejoría en la puntuación de la escala, sobre todo en lo que a síntomas negativos se refiere. Estos síntomas mejoraron paralelamente a la mejoría en su calidad de vida. La familia confirmó su mayor habilidad para comunicarse, su mayor espontaneidad y su mayor velocidad de razonamiento. Su estado cognitivo global, valorado por la escala de demencia de Mattis, no se modificó tras la intervención. La evaluación neuropsicológica se detalla al completo en la tabla.
Figura 2. Simulación realizada en GuideXT® con los parámetros de estimulación actuales –electrodo izquierdo: C(+), 3(–), 2 mA, 87 µs, 186 Hz; electrodo derecho: C(+), 3(–), 2 mA, 87 µs, 186 Hz–.
Vídeo 2. Grabación seis meses después de la intervención. El paciente presentó una gran mejoría motora, e incluso para la comunicación, el razonamiento y la deglución.

https://youtube.com/shorts/2s2_wUzxNaM
Tabla. Evaluación neuropsicológica antes y un año después de la ECP-NST. Entre paréntesis, la desviación típica (Z) de cada puntuación ajustada por edad y/o nivel académico, excepto para la PANSS, que refleja el percentil.
|
| |
Basal
|
ECP-NST (1 año)
|
MDRS
Atención
Perseveración
Construcción
Conceptualización
Memoria
|
129 (–1,33)
34 (–0,67)
28 (–2)
5 (–1)
38 (0,33)
24 (0)
|
128 (–1,33)
35 (0)
25 (–2,33)
6 (0)
38 (0,33)
24 (0)
|
FAB
|
–
|
11 (–5,3)
|
Span de dígitos
Hacia delante
Hacia atrás
|
–
–
|
6 (0,33)
3 (–0,33)
|
Fluencia verbal
Fonética
Semántica
|
–
–
|
10 (–1)
8 (–2,67)
|
PANSS
Positivos
Negativos
Compuesto
Psicopatología global
|
19 (15-20)
25 (45)
–6 (35)
41 (35)
|
12 (5)
17 (20)
–5 (35-40)
33 (10-15)
|
ECP-NST: estimulación cerebral profunda subtalámica bilateral; FAB: batería de evaluación del lóbulo frontal; MDRS: escala de demencia de Mattis; PANSS: escala de síntomas positivos y negativos.
|
Discusión
La esquizofrenia es una enfermedad devastadora que precisa medicación antidopaminérgica. El parkinsonismo medicamentoso es una complicación frecuente en estos pacientes. Ocasionalmente, en la edad adulta, la EP puede coexistir con la esquizofrenia, lo que complica notablemente su manejo. Recientemente se ha observado que la esquizofrenia puede aumentar el riesgo de padecer EP en edades adultas [3] como resultado de una vulnerabilidad inducida del sistema dopaminérgico. Los mecanismos implicados, entre otros, podrían ser el aumento de la liberación de dopamina y de la expresión de receptores D2 [4], así como un efecto neurotóxico de los antipsicóticos en las neuronas dopaminérgicas [5].
El mecanismo de acción de la mayoría de los antipsicóticos de primera y segunda generación es el bloqueo postsináptico de los receptores D2 estriados y corticales. El parkinsonismo medicamentoso se relaciona entonces con el bloqueo de la vía indirecta estriada, que está regulada por estos receptores. La ECP-NST mejora los signos cardinales de la EP interrumpiendo la vía indirecta, que está hiperactiva, como resultado del déficit de dopamina. De un modo muy simplista, podemos especular incluso si la ECP-NST podría tener un efecto sinérgico en este caso, al incidir ambos mecanismos sobre la vía indirecta estriada. Hasta ahora, el conocimiento sobre la estimulación cerebral profunda en la esquizofrenia se limita a casos concretos en los que la diana es el núcleo accumbens o la región más ventral de la corteza cingulada anterior [6]. No hemos encontrado nada referente a la estimulación cerebral profunda dirigida al núcleo subtalámico para el tratamiento de las manifestaciones motoras en estos pacientes.
Además, hasta la pasada década, la relación entre la ECP-NST y determinados síntomas psiquiátricos relacionados con la EP, como la depresión grave o la apatía, los trastornos de la personalidad, el trastorno del control de los impulsos o las ideas suicidas, ha sido controvertida [7]. Sin embargo, con la experiencia acumulada en los últimos años, la ECP-NST se entiende como segura y debe indicarse en la mayoría de estos casos, sobre todo con el fin de reducir la medicación antiparkinsoniana [8]. El mejor predictor de la respuesta a la ECP-NST es la respuesta dopaminérgica [9]. Sin ella, el potencial beneficio de la intervención se desconoce. En los casos de intolerancia dopaminérgica, la respuesta no se puede evaluar adecuadamente; sin embargo, la ECP-NST no se puede descartar en estos pacientes [10].
Conclusiones
En nuestro conocimiento, éste es el primer caso comunicado sobre la ECP-NST como tratamiento de una EP invalidante y que coexiste con la esquizofrenia. Queremos resaltar el diagnóstico de una EP idiopática en este caso particular, pese al tratamiento antidopaminérgico activo. Hay una ligera mejoría en la condición psiquiátrica, pero la mejoría motora se debe a una ECP-NST efectiva, llevada a cabo en una EP casi no tratada hasta el momento. Recomendamos considerar la ECP-NST en los casos de intolerancia dopaminérgica, sea cual sea su origen, dado el potencial beneficio sobre las manifestaciones motoras de la EP.
Bibliografía
↵ 1. Winter C, Juckel G, Plotkin M, Niehaus L, Kupsch A. Paranoid schizophrenia and idiopathic Parkinson’s disease do coexist: a challenge for clinicians. Psychiatry Clin Neurosci 2006; 60: 639.
↵ 2. Friedman JH. Managing idiopathic Parkinson’s disease in patients with schizophrenic disorders. Parkinsonism Relat Disord 2011; 17: 198-200.
↵ 3. Kuusimäki T, Al-Abdulrasul H, Kurki S, Hietala J, Hartikainen S, Koponen M, et al. Increased risk of Parkinson’s disease in patients with schizophrenia spectrum disorders. Mov Disord 2021; 35: 1353-61.
↵ 4. Brisch R, Saniotis A, Wolf R, Bielau H, Berntein HG, Steiner J, et al. The role of dopamine in schizophrenia from a neurobiological and evolutionary perspective: old fashioned, but still in vogue. Front Psychiatry 2014; 5: 47.
↵ 5. Erro R, Bhatia KP, Tinazzi M. Parkinsonism following neuroleptic exposure: a double-hit hypothesis? Mov Disord 2015; 30: 780-5.
↵ 6. Gault JM, Davis R, Cascella NG, Saks ER, Corripio-Collado I, Anderson WS, et al. Approaches to neuromodulation for schizophrenia. J Neurol Neurosurg Psychiatry 2018; 89: 777-87.
↵ 7. Fasano A, Daniele A, Albanese A. Treatment of motor and non-motor features of Parkinson’s disease with deep brain stimulation. Lancet Neurol 2012; 11: 429-42.
↵ 8. Lhommée E, Klinger H, Thobois S, Schmitt E, Ardouin C, Bichon A, et al. Subthalamic stimulation in Parkinson’s disease: restoring the balance of motivated behaviours. Brain 2012; 135: 1463-77.
↵ 9. Welter ML, Houeto JL, Tezenas du Montcel S, Mesnage V, Bonnet AM, Pillon B, et al. Clinical predictive factors of subthalamic stimulation in Parkinson’s disease. Brain 2002; 125: 575-83.
↵ 10. Fernández-Pajarín G, Sesar A, Ares-Pensado B, Castro A. Intolerance to dopaminergic medication and deep brain stimulation: a report of 3 cases. Neurologia 2020; 35: 664-5.
Subthalamic deep brain stimulation in a case of idiopathic Parkinson’s disease and schizophrenia
Introduction. Parkinson’s disease (PD) and schizophrenia can coexist. Antipsychotics block striatal D2 receptors, which inevitably aggravates the manifestations of PD.
Case report. We report the case of a male patient with idiopathic Parkinson’s disease and schizophrenia, with poor tolerance to minimal doses of levodopa, who underwent a dramatic improvement after bilateral subthalamic deep brain stimulation (DBS-STN). DBS-STN was taken into consideration here, due to the severity of this particular case, as the only possible way to achieve motor improvement.
Conclusions. The diagnosis of idiopathic PD was confirmed despite antidopaminergic treatment. DBS-STN can be considered a treatment option for disabling manifestations of PD, provided that a careful selection of patients is carried out.
Key words. Antidopaminergic medication. Drug-induced Parkinsonism. Idiopathic Parkinson’s disease. Intolerance to dopamine. Schizophrenia. Subthalamic deep brain stimulation.
|
© 2023 Revista de Neurología






