Comorbidities in multiple sclerosis and their influence on the choice of treatment
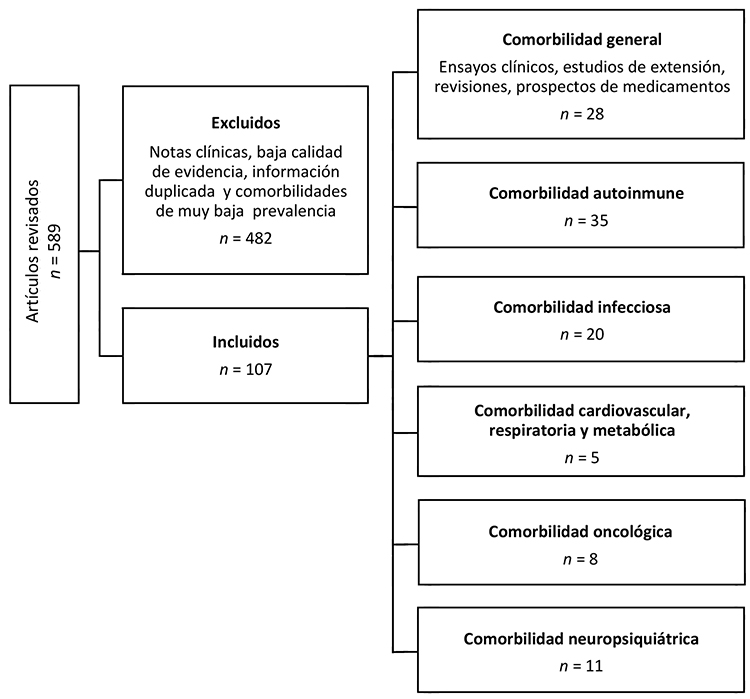
Abstract. Clinical trials of disease-modifying therapies (DMTs) for people with multiple sclerosis (pMS) are conducted in selected populations, excluding patients with comorbidities or concomitant medications. However, a large percentage of pMS have some additional disease, which could affect the response and choice of the DMT. The objective of this review is to assess how concurrent pathologies can impact the choice of DMTs. Relevant articles were selected through a systematic search in PubMed. Comorbidities were grouped for better classification into autoimmune, chronic infections, cardiovascular and metabolic, oncological and neuropsychiatric. In autoimmune pathologies, it is key to take into account the effects of TME on them and the possibility of interaction with their specific treatments. Immunomodulatory therapies are safe for people with chronic infections. Immunosuppressive treatments are generally contraindicated in people with active infections. In cardiovascular and metabolic comorbidities, infusion reactions associated with monoclonal antibodies, and the phenomena of starting treatment with S1P modulators, must be taken into account. DMTs with an immunosuppressive effect are contraindicated in people with active malignancies. Although psychiatric pathology per se does not preclude the use of DMTs, caution should be exercised when new psychiatric symptoms appear. For these reasons, among the multiple factors that must be considered when starting or changing a DMT in pMS, comorbidities constitute a decisive element.
Key words. Autoimmune diseases. Comorbidity. Immunomodulation. Multimorbidity. Multiple sclerosis. Therapeutics.
|