Tabla I. Características demográficas y clínicas de la muestra.
|
n = 90
|
Edad (años)
TE–70
TE+70
|
69,8 ± 11,6; mediana: 72
40 (44,4%)
50 (55,6%)
|
Sexo (varones)
|
57 (63,3%)
|
Tiempo de evolución (años)
|
24,1 ± 14,6
|
Patología vascular cerebral
Fazekas 0 (TE–vasc)
Fazekas 1
Fazekas 2
Fazekas 3
Fazekas ≥ 1 (TE+vasc)
|
17 (18,9%)
49 (54,4%)
20 (22,2%)
4 (4,4%)
73 (81,1%)
|
| |
Basal
|
Seis meses
|
CRST A+B
|
21,9 ± 5,6
|
4,4 ± 4,8
|
CRST C
|
18,8 ± 4,3
|
3,2 ± 4,4
|
CRST total
|
57,3 ± 14,5
|
23,1 ± 13,8
|
CRST: Clinical Rating Scale for Tremor; TE–70: pacientes ≤ 70 años; TE+70: pacientes mayores de 70 años; TE–Vasc: pacientes sin patología vascular cerebral; TE+Vasc: pacientes con patología vascular cerebral.
|
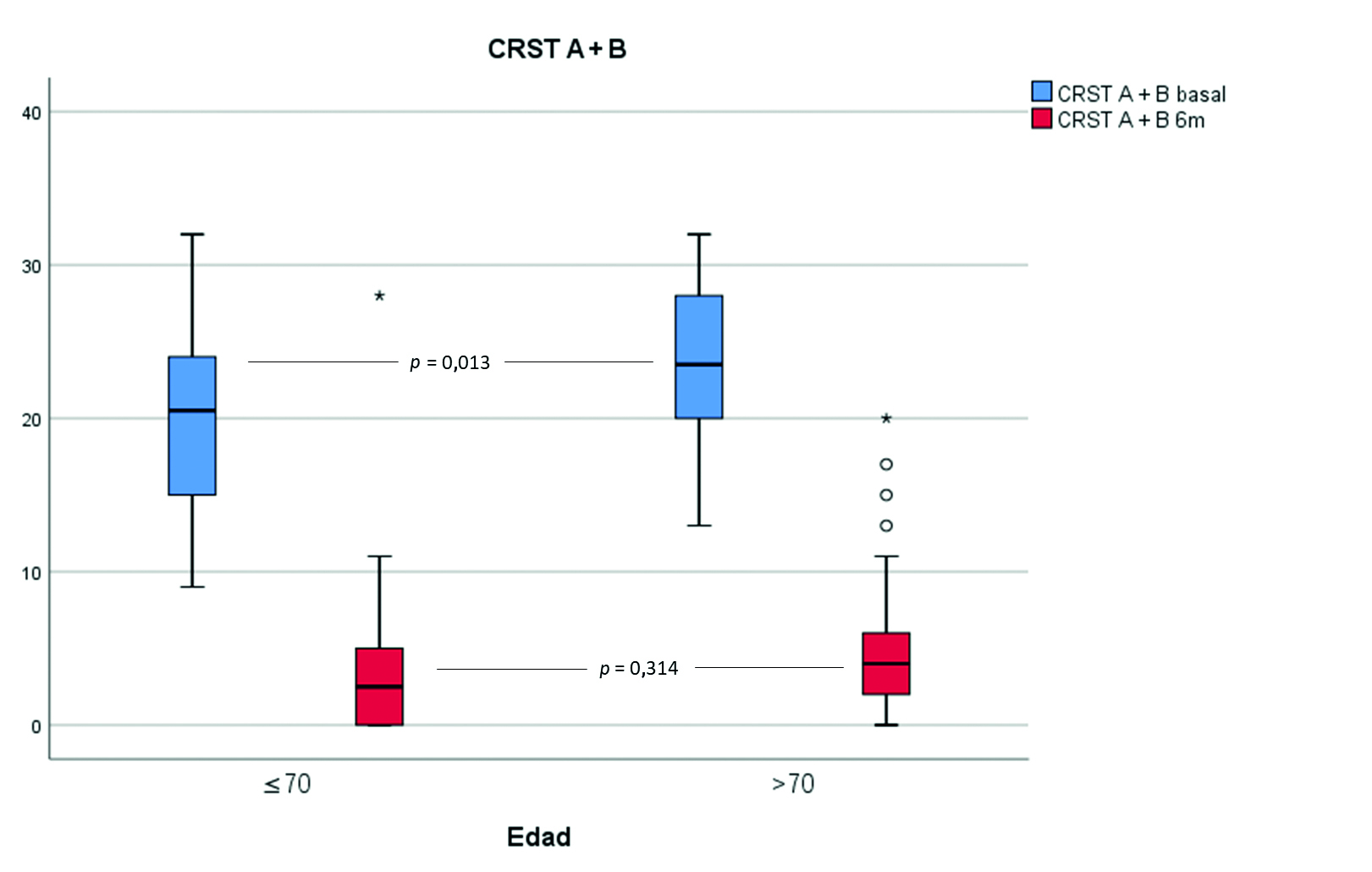
Previamente al tratamiento, los pacientes TE+70 presentaban una gravedad significativamente mayor del temblor, valorado por la CRST A + B, que los pacientes TE–70 (23,3 ± 5,1 y 20,4 ± 5,7;
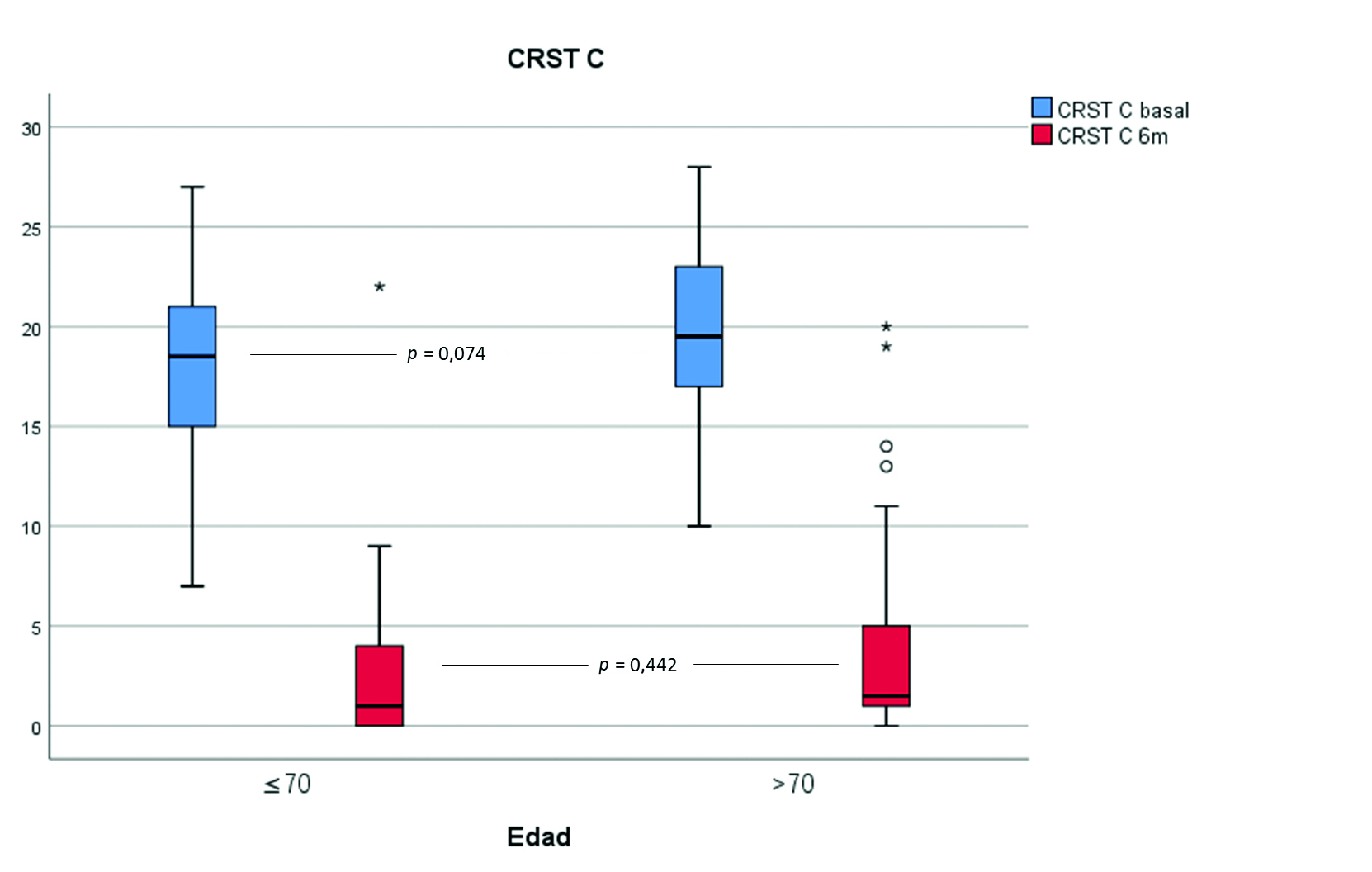
p = 0,013, respectivamente). La repercusión funcional del temblor, cuantificada por la CRST C, era equivalente en ambos grupos etarios (19,5 ± 4 y 17,9 ± 4,5;
p = 0,074). Los pacientes TE+Vasc presentaron medias mayores en ambas escalas que los pacientes TE-Vasc, y sólo existían diferencias estadísticamente significativas en el caso de la CRST C (19,8 ± 6,4 y 22,5 ± 5,3;
p = 0,069; y 15,8 ± 4,9 y 19,4 ± 3,9;
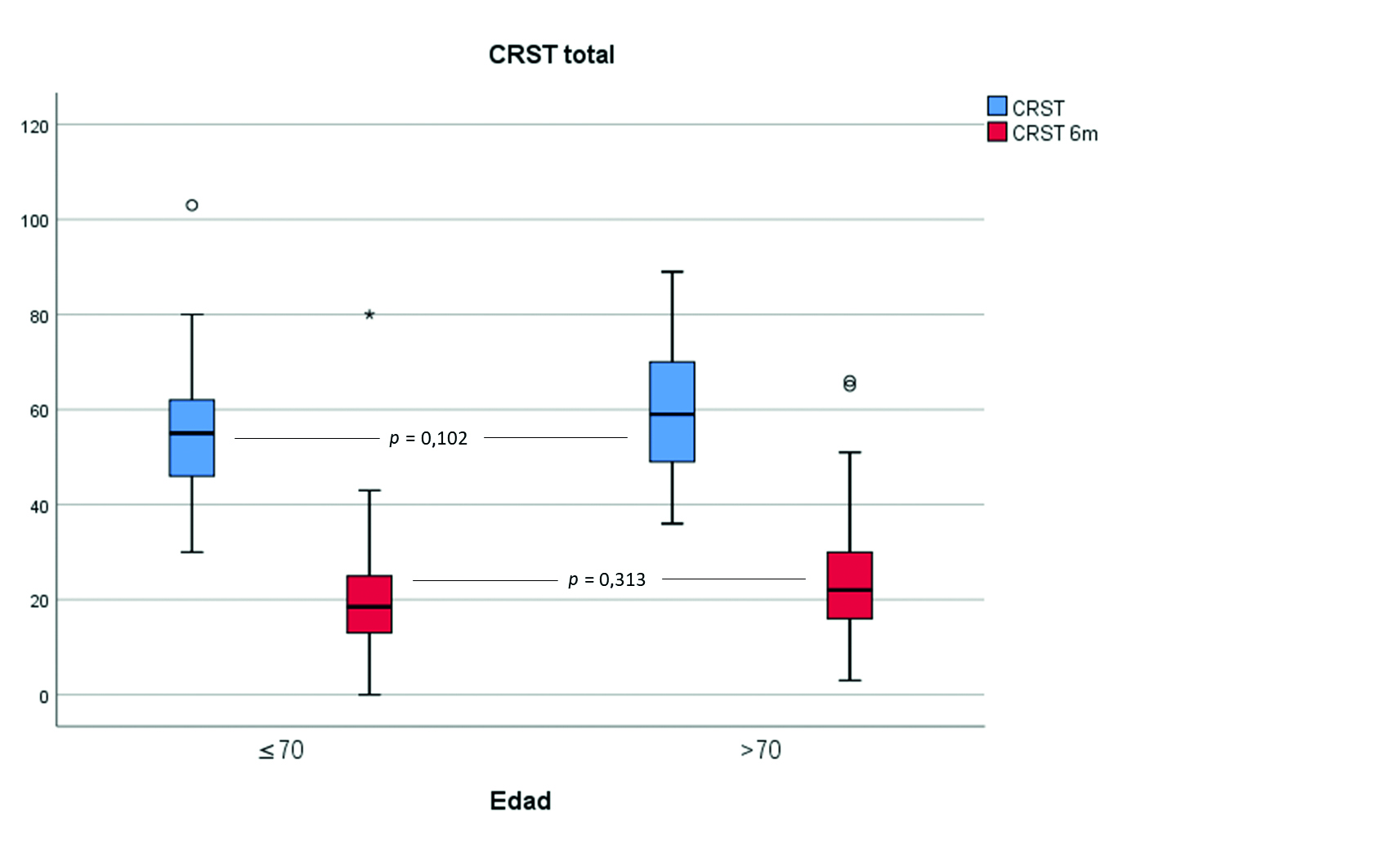
p = 0,001). Estos resultados se reflejan en la tabla II. Tras el tratamiento, no se encontraron diferencias estadísticamente significativas en la CRST A + B, en la CRST C ni en la puntuación total de la CRST entre ambos grupos etarios (Figs. 1 a 3). Al analizar la correlación entre la edad como una variable continua con la CRST A + B, la CRST C y la puntuación total de la CRST después del tratamiento, ésta es despreciable o débil (rho = 0,19,
p = 0,068; rho = 0,22,
p = 0,035; y rho = 0,25,
p = 0,018, respectivamente). Tampoco encontramos diferencias significativas en los resultados del tratamiento según la escala de Fazekas mediante el análisis de la varianza (
p = 0,887,
p = 0,323 y
p = 0,406 para la CRST A + B, la CRST C y la CRST total, respectivamente) ni entre los grupos TE+Vasc y TE–Vasc. Estos datos se recogen también en la tabla II.
Tabla II. Resultados del tratamiento entre grupos etarios y según la presencia o no de patología vascular cerebral.
|
| |
TE–70
n = 40
|
TE+70
n = 50
|
Valor
de p
|
TE–Vasc
n = 17
|
TE+Vasc
n = 73
|
Valor
de p
|
CRST A + B basal
|
20,4 ± 5,7
|
23,3 ± 5,1
|
0,013
|
19,8 ± 6,4
|
22,5 ± 5,3
|
0,069
|
CRST C basal
|
17,9 ± 4,5
|
19,5 ± 4
|
0,074
|
15,8 ± 4,9
|
19,4 ± 3,9
|
0,001
|
CRST total basal
|
54,5 ± 15,3
|
59,6 ± 13,7
|
0,102
|
52,8 ± 16,8
|
58,4 ± 13,9
|
0,154
|
CRST A + B a los
seis meses
|
3,8 ± 5,1
|
4,8 ± 4,5
|
0,314
|
4,6 ± 7,3
|
4,3 ± 4
|
0,832
|
CRST C a los seis meses
|
2,8 ± 4,1
|
3,5 ± 4,8
|
0,442
|
3,7 ± 6,6
|
3 ± 3,8
|
0,574
|
CRST total a los
seis meses
|
21,5 ± 14,2
|
24,4 ± 13,5
|
0,313
|
23,2 ± 19,7
|
23,1 ± 12,2
|
0,986
|
CRST: Clinical Rating Scale for Tremor; TE–70: pacientes ≤ 70 años; TE+70: pacientes mayores de 70 años; TE–Vasc: pacientes sin patología vascular cerebral; TE+Vasc: pacientes con patología vascular cerebral.
|