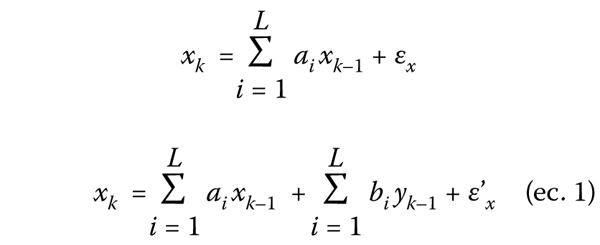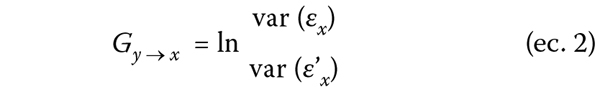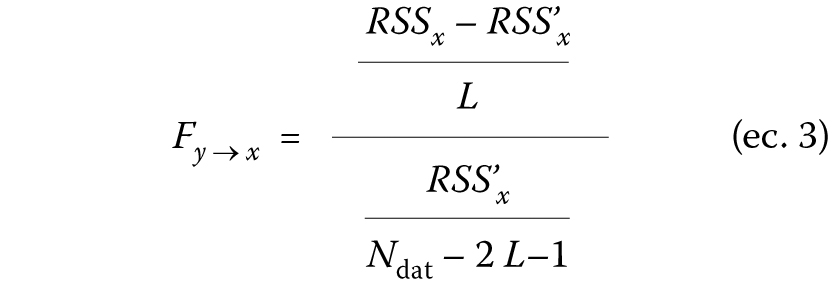Tabla I. Características demográficas y gravedad.
|
Patología
|
Características demográficas
|
Tiempo en UCI y monitorización (días)
|
Gravedad
(escala de
Glasgow b)
|
Fármacos d
|
|
Paciente
|
Sexo
|
Edad
|
Total
|
Previo c
|
Monitorización
|
HSA a (V)
|
A
|
M
|
53
|
41
|
2
|
6
|
4-8/sedado
|
Fentanilo, midazolam, propofol, levetiracetam, ácido valproico, tiopental, nimodipino
|
HSA a (IV)
|
B
|
M
|
26
|
41
|
3
|
4
|
4-8/sedado
|
Fentanilo, midazolam, propofol, levetiracetam, nimodipino
|
HSA a (V)
|
C
|
M
|
55
|
39
|
2
|
8
|
4-8/sedado
|
Fentanilo, midazolam, propofol, fenitoína, levetiracetam, nimodipino
|
HSA a (III)
|
D
|
M
|
76
|
10
|
2
|
6
|
13-15/sedado
|
Fentanilo, midazolam, propofol, ácido valproico, lacosamida, nimodipino
|
HSA a (III)
|
E
|
M
|
65
|
39
|
3
|
4
|
9-12/sedado
|
Fentanilo, midazolam, propofol, nimodipino
|
HSA a (IV)
|
F
|
M
|
50
|
24
|
5
|
5
|
9-12/4-8
|
Fentanilo, midazolam, propofol, levetiracetam, nimodipino
|
TCE
|
G
|
H
|
37
|
20
|
4
|
7
|
4-8/sedado
|
Fentanilo, midazolam, propofol, levetiracetam, fenitoína
|
TCE
|
H
|
H
|
31
|
24
|
1
|
3
|
4-8/4-8
|
Fentanilo, midazolam, propofol, levetiracetam
|
TCE
|
I
|
M
|
54
|
16
|
1
|
6
|
4-8/4-8
|
Fentanilo, midazolam, propofol, levetiracetam
|
TCE
|
J
|
H
|
47
|
25
|
3
|
7
|
9-12/sedado
|
Fentanilo, midazolam, propofol, levetiracetam, cloracepam, tiopental
|
TCE
|
K
|
H
|
58
|
19
|
2
|
3
|
13-15/sedado
|
Fentanilo, midazolam, propofol, levetiracetam
|
TCE
|
L
|
H
|
63
|
15
|
1
|
5
|
4-8/sedado
|
Fentanilo, propofol
|
TCE
|
M
|
H
|
20
|
24
|
2
|
4
|
4-8/sedado
|
Fentanilo, midazolam, propofol, cloracepam
|
TCE
|
N
|
M
|
71
|
41
|
1
|
4
|
3/sedado
|
Fentanilo, midazolam, propofol, levetiracetam, fenitoína
|
TCE
|
O
|
H
|
81
|
7
|
2
|
3
|
13-15/sedado
|
Fentanilo, midazolam, propofol, levetiracetam, ácido valproico, nicardipino
|
TCE
|
P
|
H
|
28
|
14
|
2
|
4
|
13-15/sedado
|
Fentanilo, propofol, ácido valproico, cloracepato, nicardipino
|
TCE
|
Q
|
H
|
22
|
27
|
2
|
4
|
4-8/sedado
|
Fentanilo, midazolam, propofol, levetiracetam, dexmedetomidina, haloperidol, nicardipino
|
TCE
|
R
|
H
|
68
|
28
|
4
|
7
|
9-12/sedado
|
Fentanilo, midazolam, propofol, levetiracetam, ácido valproico, cisatracurio, clorpromacina, cloracepato, nicardipino
|
TCE
|
S
|
M
|
56
|
25
|
3
|
8
|
9/sedado
|
Fentanilo, midazolam, propofol, levetiracetam, ácido valproico, rocuronio, nicardipino
|
TCE
|
T
|
H
|
48
|
36
|
9
|
7
|
9/sedado
|
Fentanilo, midazolam, propofol, levetiracetam, ácido valproico
|
TCE
|
U
|
M
|
75
|
42
|
3
|
9
|
9/sedado
|
Fentanilo, midazolam, propofol, valproato
|
HSA: hemorragia subaracnoidea; TCE: traumatismo craneoencefálico; UCI: unidad de cuidados intensivos. a Se incluye la escala de Hunt-Hess al diagnóstico; b Corresponde en el diagnóstico y a los tres días (diagnóstico/tercer día); c Hace referencia a los días desde el diagnóstico hasta la monitorización de la presión intracraneal con almacenamiento de los datos; d Corresponden a los recibidos durante la monitorización (perfusión o bolos).
|