Introducción
El metronidazol es un antibiótico utilizado para tratar diversos tipos de infección o, de forma preventiva, en la enfermedad inflamatoria intestinal. Su mecanismo de acción se sospecha que consiste en impedir la reparación del ADN, bloqueando la adecuada síntesis de proteínas en las células [1] y en un efecto antioxidante en el metabolismo intracelular [2,3].
Aparte de la neurotoxicidad más conocida, consistente en mareo, neuropatía periférica y crisis epilépticas, en un escaso número de pacientes aparecen síntomas de ataxia, disartria y alteración del nivel de conciencia, junto con unas imágenes características de alteración de la señal en resonancia magnética (RM), simétricas y de singular localización. Estos síntomas y alteraciones radiológicas mejoran o desaparecen tras la suspensión del metronidazol.
La incidencia y el mecanismo patógeno de esta complicación se desconocen [2,4].
En la revisión de la bibliografía se obtienen descripciones de casos aislados o pequeñas series [2,5-7]. Se expone un nuevo caso de encefalopatía relacionada con metronidazol con los característicos hallazgos radiológicos, y con estudio patológico de las lesiones, descrito hasta el momento en pocas ocasiones.
Caso clínico
Mujer de 72 años con antecedentes de hipotiroidismo, asma bronquial, fibrilación auricular paroxística e hipertensión arterial, que presentó un primer brote de enfermedad de Crohn complicado con perforación colónica que precisó colectomía. Un mes más tarde del brote, se detectaron abscesos hepáticos producidos por enterococos sensibles al metronidazol y, posteriormente, una trombosis venosa profunda. Por este motivo se inició tratamiento con heparina de bajo peso molecular, pero fue preciso suspenderlo más adelante por presentar rectorragia debida a un nuevo brote inflamatorio perianal. Durante todo este período de enfermedades consecutivas, el gastroenterólogo observó bradipsiquia y gran dificultad para caminar. Lo interpretó como deterioro general por su enfermedad y las múltiples complicaciones, y continuó el tratamiento con metronidazol. En estos meses, la alimentación fue adecuada y no mostró signos de desnutrición. Tras 87 días tratada con metronidazol en dosis de 500 mg/12 h por vía oral, ingresó de nuevo por enteritis por Aeromonas y para estudio de nuevas lesiones hepáticas, cuyo cultivo fue estéril. Por este motivo se modificó el tratamiento de metronidazol a 500 mg/8 h por vía endovenosa. Pocos días más tarde, presentó importante disminución del nivel de conciencia, dificultad en la emisión del lenguaje y debilidad de las extremidades derechas. No refirió alucinaciones visuales ni se objetivaron crisis epilépticas en ningún momento. La tensión arterial se mantuvo estable, con valores menores de 140/90 mmHg como en los días previos.
En la exploración física estuvo consciente, pero con somnolencia y bradipsiquia, no tenía déficit visual, y presentaba disfasia mixta de predominio motor con leve disartria y hemiparesia derecha de predominio braquial proximal con reflejos exaltados. Además, se observó una leve distonía con hiperpronación de la mano y leve rigidez en rueda dentada en la misma extremidad. No colaboró para pruebas cerebelosas ni fue posible explorar la bipedestación ni la marcha. No mostró signos de irritación meníngea. No se apreciaron soplos carotídeos y los pulsos temporales estuvieron presentes, isopulsátiles e indoloros.
En el electroencefalograma se observó actividad de 7-9 Hz de predominio parietooccipital bilateral y actividad beta anterior de bajo voltaje; sobre esta actividad se entremezclaron en ambos hemisferios ondas más lentas theta y delta con predominio en las regiones posteriores del hemisferio izquierdo.
El hemograma, la glutamato-oxalacetato transaminasa, la glutamato-piruvato transaminasa, la gamma glutamil transpeptidasa, la fosfatasa alcalina, las hormonas tiroideas, el amonio y las vitaminas B1, B12 y A fueron normales. Se detectó una leve hipovitaminosis D.
La tomografía axial computarizada cerebral urgente sólo mostró signos de atrofia panencefálica y leucoaraiosis parcheada. En la RM al día siguiente se observaron los siguientes hallazgos: áreas hiperintensas en secuencias T2 y FLAIR con restricción de la difusión y en los mapas ADC, que afectaban de forma simétrica a la región medial y anterior del mesencéfalo coincidiendo con la localización de los núcleos rojos, a la zona correspondiente a los núcleos dentados cerebelosos, al cuerpo calloso en su parte anterior y el esplenio, y a una zona peor definida confluente de la sustancia blanca de ambas coronas radiadas y los centros semiovales (Figs. 1 y 2). No presentaba captación de contraste. No se realizó punción lumbar al no presentar signos infecciosos ni signos de meningitis.
Figura 1. Resonancia magnética en secuencia FLAIR, planos coronal y axial: áreas hiperintensas, simétricas, que afectan al cuerpo calloso, a la región medial y anterior del mesencéfalo, coincidiendo con los núcleos rojos y la zona paramedial de los hemisferios cerebelosos y con los núcleos dentados.
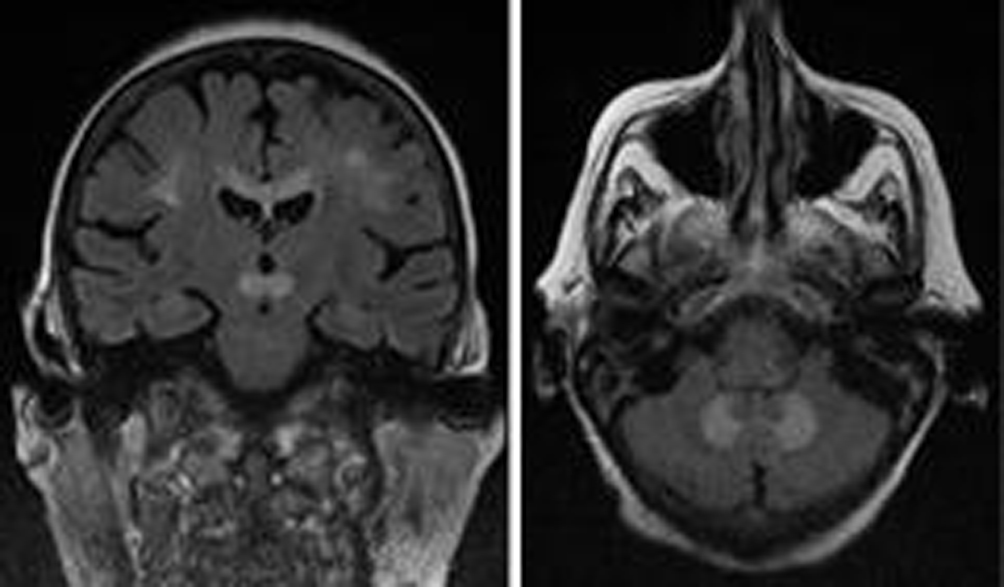
Figura 2. Resonancia magnética en secuencias en difusión y ADC: restricción de la difusión, y en menor grado en los mapas ADC, de las lesiones del esplenio del cuerpo calloso y los núcleos rojos sugestiva de edema citotóxico en la sustancia blanca y gris, respectivamente.

Una vez descartadas razonablemente otras causas de encefalopatía metabólica, suspendimos el tratamiento con metronidazol y tres días más tarde comenzó a mejorar el nivel de conciencia, la afasia y la debilidad y, posteriormente, la postura distónica leve de pronación forzada de la mano derecha, que desapareció en menos de una semana. Tras varios meses sin caminar y con escasa movilidad, la paciente comenzó a levantarse con ayuda en menos de siete días, mantenerse de pie y caminar lentamente por debilidad generalizada, pero sin rasgos atáxicos, inestables ni paréticos. La dosis total de metronidazol recibida en esos 98 días fue de 104,5 g.
A los dos meses volvió a ingresar por sepsis de origen respiratorio y abdominal, y se reinició el metronidazol según criterio del médico especialista en digestivo. Un día más tarde tuvo un franco empeoramiento neurológico y fallo multiorgánico. Ingresó en la unidad de cuidados intensivos y falleció a las 48 horas por neumonía por citomegalovirus, lo que impidió realizar un estudio de neuroimagen de control. Se le realizó la autopsia y se encontró macroscópicamente el cerebro con aspecto edematoso en las circunvoluciones temporales izquierdas y, en la unión del tálamo con el pedúnculo cerebral derecho, un área de aspecto reblandecido. Los núcleos rojos presentaban áreas reblandecidas y de aspecto apolillado necrótico. Microscópicamente presentaba en los cortes estudiados áreas de necrosis con escasa celularidad inflamatoria e intensa desmielinización (Fig. 3).
Figura 3. Parénquima cerebral correspondiente a un área afecta del cuerpo calloso: a) Se observan áreas de necrosis (flecha) con aisladas células inflamatorias e histiocitos y ocasionales depósitos de lipofuscina (HE 2,5×); b). Se observa la presencia de histiocitos en las zonas de necrosis que fagocitan detritos celulares (CD68, 20×); c) Se identifican las áreas de necrosis con intensa desmielinización (flecha) en comparación con el parénquima cerebral circundante (Luxol fast blue, 4×); d) Se observa pérdida de neurofilamentos coincidiendo con las áreas de necrosis (flecha) en comparación con el resto de tejido cerebral, que conserva una tinción intensa (tinción para neurofilamentos, 10×).

Discusión
El metronidazol de forma excepcional produce efectos adversos en el sistema nervioso central. Existen pocos casos publicados en los que aparecen síntomas de afectación del sistema nervioso central, con alteraciones en la RM, que mejoran con la suspensión de este fármaco. Por este motivo, una vez que se han descartado otras causas, principalmente una encefalopatía de Wernicke [2] o una enfermedad de Marchiafava-Bignami, que son los principales diagnósticos diferenciales, debe valorarse esta opción.
Los síntomas característicos de esta encefalopatía, por orden de frecuencia, son [8]: 75%, disfunción cerebelosa (disartria, 66%; ataxia, 56%; dismetría, 33%, y nistagmo, 8%); 33%, alteración del estado mental; y 13%, crisis epilépticas, y en el 17% aparecen conjuntamente disfunción cerebelosa y alteración del estado mental.
Las llamativas imágenes de RM son de gran importancia diagnóstica en el contexto adecuado, ya que el tratamiento consiste en la pronta suspensión del metronidazol y medidas sintomáticas y de soporte [4,6,8]. Característicamente aparecen hiperintensidades simétricas en las secuencias T2 y FLAIR, con mínima una hiperintensidad en T1, localizadas en los núcleos dentados del cerebelo, el mesencéfalo (generalmente periacueductales), el esplenio del cuerpo calloso, el dorso de la protuberancia, el bulbo raquídeo, el colículo inferior, la sustancia blanca subcortical, los ganglios basales, el tálamo y los pedúnculos cerebelosos medios en orden decreciente de frecuencia y similares a las observadas en el caso presentado. Generalmente, estas lesiones restringen en la difusión, con valores variables de ADC [2,4], lo cual sugiere un distinto mecanismo lesional [5]. La captación de contraste es muy poco frecuente [2,5].
La patogenia de esta encefalopatía se desconoce [2,6-10]. Se piensa en una alteración metabólica por la distribución radiológica [2,4,7]. Se sospecha una inhibición competitiva con la tiamina [10,11] por su similitud clínica y radiológica con la encefalopatía de Wernicke [7,11,12]. También se ha relacionado con una disfunción mitocondrial transitoria por la presencia de un pico de lactato en la espectroscopia por RM [12] o por estudios en los que el metronidazol parece tener acción antioxidante en la enfermedad de Crohn [3]. Asimismo, parece que puede estar implicada en este efecto adverso una modulación del receptor de GABA, interacciones con el ADN y ARN neuronales [2,7] o un acúmulo en el tejido intersticial cerebral que ocasione un edema vasógeno [7,13,14], aunque también hay datos de edema citotóxico [5,13]. Incluso se postula un distinto mecanismo de acción del metronidazol en la sustancia gris y en la blanca [2,5].
Dada la resolución de los síntomas con la suspensión del metronidazol, no suelen existir datos anatomopatológicos en humanos. En el único caso que hemos encontrado descripción patológica [15] se describen tumefacción, infiltración de macrófagos, vacuolización y desmielinización leve con relativo respeto axonal. Existen casos en animales de experimentación de lesión cerebelosa por metronidazol [2] con hallazgos similares a los observados en nuestro caso y en el descrito previamente [15], y similares a los observados en la encefalopatía de Wernicke en humanos [7,9].
La encefalopatía no tiene clara relación con la dosis diaria de metronidazol ni con el tiempo de exposición al metronidazol [8], ya que hay casos en los que está relacionado [6] y en otros no [7].
No se conocen los motivos por los que la encefalopatía aparece en un reducido número de pacientes en relación con todos los expuestos [12], y no se conoce su incidencia [2,4]. Claramente la mayoría de los pacientes mejoran al cesar la exposición al metronidazol desapareciendo los síntomas [6] y normalizándose la RM en pocos meses en la mayoría de los pacientes [8,13]. El síntoma que peor se recupera en los casos publicados suele ser la ataxia [8]. No hay una correlación de la mejoría clínica con la evolución radiológica [7,8]. La sospecha diagnóstica, junto con las características imágenes, orienta a suspender el metronidazol y llegar a la solución, evitando una exposición más prolongada y dosis más altas, factores que puedan haber influido en los contados casos fatales [6,7].
En el caso que presentamos es posible que la sintomatología apareciera poco después de iniciar el metronidazol, pero al ser de leve o moderada intensidad y generalizada, el especialista en gastroenterología la pasó por alto al ponerla en relación con un período de convalecencia tras el primer brote de enfermedad de Crohn, la colectomía por perforación y los abscesos hepáticos que aparecieron de forma consecutiva. La rápida mejoría de la movilidad de la paciente al suspender el antibiótico orienta a un efecto adverso de éste, similar a lo descrito en la bibliografía [5]. La etiología infecciosa queda descartada de forma razonable, dada la mejoría clínica en ausencia de fármacos antimicrobianos, así como la ausencia de signos de infección. Además, otros posibles diagnósticos quedaron descartados gracias a los hallazgos en la neuroimagen, como la enfermedad de Marchiafava.
El incremento de la dosis diaria de metronidazol parece ser el factor desencadenante del brusco agravamiento de esta paciente que llevó a realizar la RM que condujo al diagnóstico. Esta paciente no tuvo ningún otro signo de desnutrición o malnutrición, infección, crisis hipertensiva ni otra disfunción vascular (una vez descartado cardioembolismo) o fármaco añadido que favoreciese la exacerbación y la focalidad hemisférica izquierda que presentó y que no tiene correlación con la imagen.
También presentó una distonía asimétrica leve y transitoria sin correlación con la imagen simétrica de afectación de los tálamos. Nuestro caso es de los pocos descritos en la bibliografía en el que la encefalopatía por metronidazol provoca un trastorno del movimiento [13] sin clara correlación clinicorradiológica.
Para evaluar la causalidad del metronidazol en este caso se utilizaron el algoritmo de Karch y Lasagna. La puntuación total de este es de 7 (reacción probable grave). Esta puntuación se justifica por: una secuencia temporal compatible, pero no coherente (+1), al no conocerse el mecanismo de acción del metronidazol implicado en este efecto; esta reacción adversa se conoce en referencias ocasionales (+1); la reacción adversa mejora al retirar el fármaco (+2); aparece un empeoramiento neurológico similar al anterior tras la reintroducción (+3); otras posibles causas son igual o menos verosímiles que la reacción adversa (–1); se desconoce si había factores que pudiesen haber contribuido a la presentación de la reacción adversa (0); y la exploración radiológica es compatible con lo descrito en la bibliografía como reacción adversa al metronidazol (+1).
Se trata de uno de los pocos casos publicados con hallazgos anatomopatológicos con esta sospecha diagnóstica. Con la presentación de este caso queremos dar a conocer este efecto –al parecer idiosincrático– poco frecuente del metronidazol y alertar al gran número de prescriptores de su existencia y rápida solución con la suspensión del antibiótico, cuyo diagnóstico depende de su sospecha diagnóstica. Los hallazgos histológicos, aunque inespecíficos, pueden en el futuro ayudar a dilucidar el mecanismo patógeno de esta alteración relacionada con el metronidazol.
Bibliografía
↵ 1. Freeman CD, Klutman NE, Lamp KC. Metronidazole: a therapeutic review and update. Drugs 1997; 54: 679-708.
↵ 2. Kim E, Na DG, Kim EY, Kim JH, Son KR, Chang KH. MR imaging of metronidazole-induced encephalopathy: lesion distribution and diffusion-weighted imaging findings. AJNR Am J Neuroradiol 2007; 28: 1652-8.
↵ 3. Pelissier MA, Marteau P, Pochart P. Antioxidant effects of metronidazole in colonic tissue. Dig Dis Sci 2007; 52: 40-4.
↵ 4. Roy U, Panwar A, Pandit A, Das SK, Joshi B. Clinical and neuroradiological spectrum of metronidazole induced encephalopathy: our experience and the review of literature. J Clin Diagn Res 2016; 10: OE01-9.
↵ 5. Furukawa S, Yamamoto T, Sugiyaba A, Ohira K, Aotsuka Y, Molde K, et al. Metronidazole-induced encephalopathy with contrast enhancing lesions on MRI. J Neurol Sci 2015; 352: 129-31.
↵ 6. Groothoff MV, Hofmeijer J, Sikma MA, Meulenbelt J. Irreversible encephalopathy after treatment with high-dose intravenous metronidazole. J. Clin Ther 2010; 32: 60-4.
↵ 7. Hobbs K, Stern-Nezer S, Buckwalter MS, Fichbein N, Finley Caulfield A. Metronidazole-induced encephalopathy: not always a reversible situation. Neurocrit Care 2015; 22: 429-36.
↵ 8. Kuriyama A, Lackson JL, Doi A, Kamiya T. Metronidazole-induced central nervous system toxicity: a systematic review. Clin Neuropharmacol 2011; 34: 241-7.
↵ 9. Patel K, Green-Hopkins I, Lu S, Tunkel AR. Cerebellar ataxia following prolonged use of metronidazole: case report and literature review. Int J Infect Dis 2008; 12: e111-4.
↵ 10. Sørensen CG, Karlson WK, Amin FM, Lindelof M. Convulsive seizures as presenting symptom of metronidazole-induced encephalopathy: a case report. Case Rep Neurol 2018; 10: 34-7.
↵ 11. Iwadate D, Sato K, Kanzaki M, Komiyama C. Thiamine deficiency in metronidazole-induced encephalopathy: a metabolic correlation? J Neurol Sci 2017; 379: 324-6.
↵ 12. Bhattacharyya S, Darby RR, Raibagkar P, González-Castro LN, Berkowitz AL. Antibiotic-associated encephalopathy. Neurology 2016; 86: 963-71.
↵ 13. Cecil KM, Halsted MJ, Schapiro M, Dinopoulos A, Jones BV. Reversible MR imaging and MR spectroscopy abnormalities in association with metronidazole therapy. J Comput Assist Tomogr 2002; 26: 948-51.
↵ 14. Gálvez M, Brahm J, Miranda M. Movement disorders as a manifestation of metronidazole-induced encephalopathy in a patient with chronic liver disease. Mov Disord 2009; 24: 1864-5.
↵ 15. Fukumoto T, Katada F, Sato S, Shibayama H, Murayama S, Fukutake T. A case of acute encephalopathy induced by a combination of 5-fluorouracil and metronidazole. Clin Neurol 2018; 58: 118-23.
Metronidazole-induced encephalopathy: description of a case with radiological and anatomopathological findings
Introduction. Metronidazole is a widely known and used antibiotic. In exceptional cases, an encephalopathy with characteristic lesions on magnetic resonance imaging (MRI), usually located in the cerebellum and splenium of the corpus callosum, may be an adverse effect. The incidence and pathogenesis are unknown. The suspension of the treatment usually resolves the symptoms and normalizes the MRI in a few weeks. Due to the usual good prognosis, the anatomopathological findings are exceptional. We present a clinical case with the radiological findings suggestive of metronidazole-induced encephalopathy and, exceptionally, we provide the anatomopathological findings.
Case report. A 72 years-old woman with severe Crohn’s disease who, months after starting treatment with metronidazole, presented a slowly progressing bradypsychia and difficulty walking until she came to coma. In MRI it showed hyperintense images in T2 in the corpus callosum, red and dentate nuclei. He improved by stopping metronidazole but later developed sepsis and died. At autopsy, softening of the red nucleus was observed and, microscopically, cell necrosis and demyelination.
Conclusion. With the publication of the clinical, radiological and anatomopathological information of our case we intend to promote the knowledge of this infrequent treatable cause of subacute encephalopathy and provide data that help to clarify its pathogenesis.
Key words. Cerebellar toxicity. Corpus callosum. Drug toxicity. Encephalopathy. Metronidazole. Neurotoxicity syndromes. Red nucleus.
|
© 2019 Revista de Neurología








