Pharmacological management of Parkinson’s disease motor symptoms: update and recommendations from an expert
Introduction. Parkinson’s disease (PD) is a neurodegenerative multisystemic disorder that affects approximately 1% of the population over 55 years old, with the mean age of onset at 60 years old, and the prevalence of the disease constantly growing.
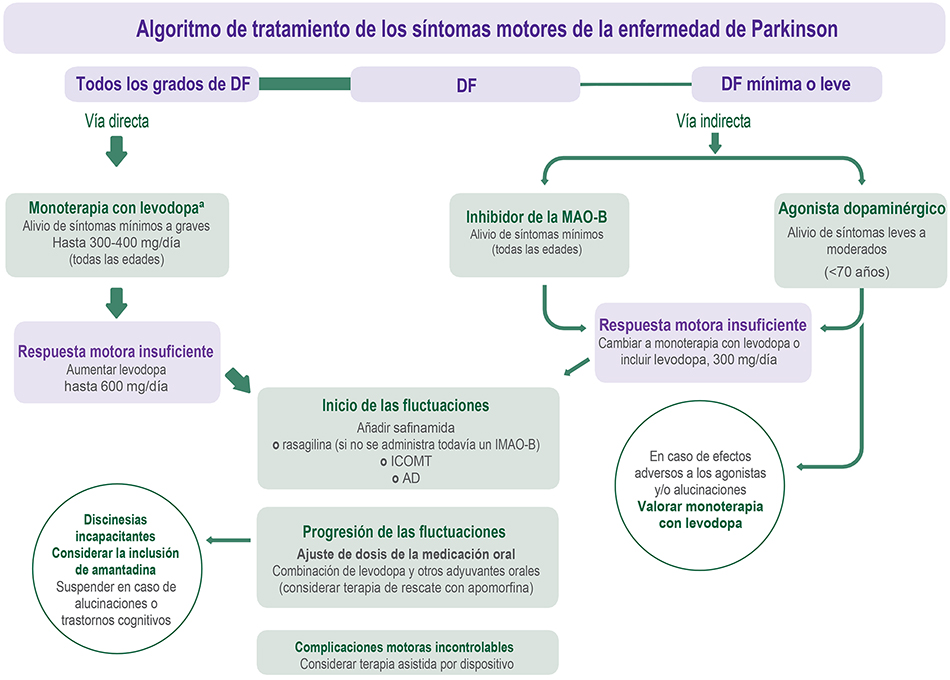
Development. PD is a progressive disease characterized by motor and non-motor symptoms that compromise patients’ daily activities. It has a variable profile of onset and clinical evolution. Although currently available treatments have failed to clinically demonstrate neuroprotective properties, most motor symptoms are acceptably managed with dopaminergic medication. More than 50 years after launching levodopa, it remains the most effective treatment of motor symptoms in PD, able to provide sustained benefit throughout the entire course of the disease. Nevertheless, after two to three years of treatment, certain fluctuations start to appear in motor and non-motor responses to different doses of levodopa. Early identification and treatment of these fluctuations have a strong positive impact on the quality of life of the patient. Frequently accompanied by involuntary movements, proper control of fluctuations requires periodical adjustments of the medication and expert supplementation with dopaminergic and non-dopaminergic adjuvants.
Conclusions. The main purpose of this work is to offer a practical, updated guideline for neurologists regarding the use of dopaminergic agents from the initial stages of PD. Special emphasis is placed on the critical period after the end of the ‘honeymoon’ phase when variations in the symptomatology presented by each patient appear, forcing re-adjustment of the medication to fit their individual needs.
Key words. Algorithm. Levodopa. MAO-B inhibitors. Motor fluctuations. Parkinson’s disease. Treatment.
|
 Castellano
Castellano
 English
English