Original corto
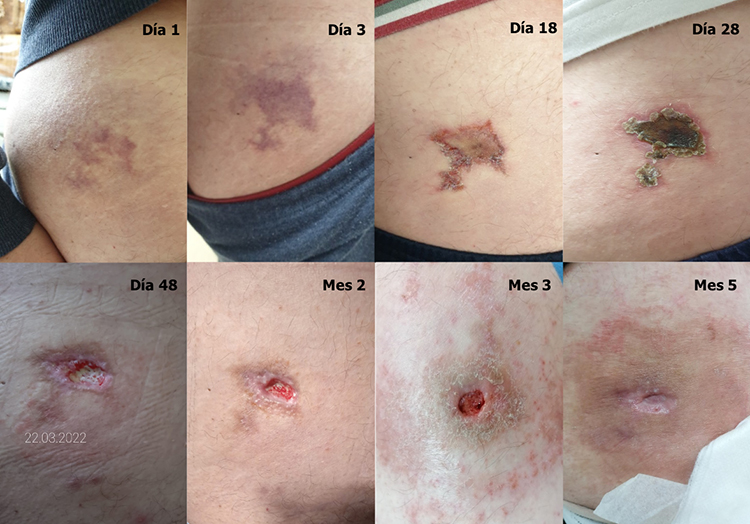
Síndrome de Nicolau por fármacos autoinyectables en la esclerosis múltiple
M.J. Neri, P. Mulero, N. Téllez [REV NEUROL 2023;77:75-78] PMID: 37466133 DOI: https://doi.org/10.33588/rn.7703.2022430Volumen 77 | Número 03 | Nº de lecturas del artículo 4.765 | Nº de descargas del PDF 61 | Fecha de publicación del artículo 01/08/2023