Tabla I. Características demográficas y clínicas del grupo caso (n = 31).
|
| |
Media
|
DE
|
Tiempo de evolución de la migraña (años)
|
15,34
|
7,48
|
DMM
|
3,16
|
2,41
|
Uso de triptanes días/mes
|
1,06
|
1,63
|
Uso de antiinflamatorios días/mes
|
3,1
|
2,29
|
Intensidad
|
7,26
|
1,34
|
MIDAS
|
13,48
|
15,85
|
HIT-6
|
61,19
|
10,27
|
DE: desviación estándar; DMM: días de migraña al mes; HIT-6: Headache Impact Test; MIDAS: Migraine Dissability Assessment Scale.
|
Tras analizar los resultados obtenidos por el grupo de grupo de Katsarava et al [
26], en el que se presenta una muestra de 41 personas, con una media de latencias de 44,7 ± 7,3 ms y una media en las diferencias de la respuesta izquierda y derecha de 0,4 ± 2,1 ms, se procedió a construir un
power test, con un α de 0,05,
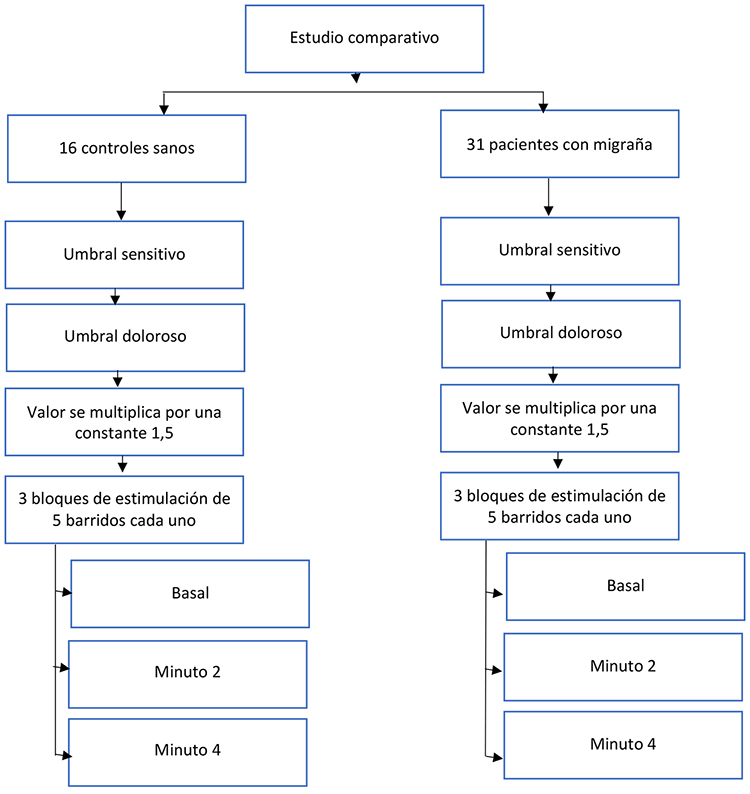
power de 0,8, media estandarizada 0,9 y se verificó la necesidad de 47 personas divididas en 16:31 individuos, confirmando que nuestra muestra es suficiente para conseguir nuestros objetivos.
En los umbrales de percepción de estímulo no encontramos diferencias significativas entre ambos grupos (0,99 frente a 1,15;
p = 0,011 izquierdo, 0,96 frente a 1,16;
p = 0,022 derecho).
Mediante un gráfico
boxplot de 12 variables, es decir, de todos los bloques, se observó una fuerte correlación entre ellos, lo que impide utilizar ningún método de regresión con sus valores directos.
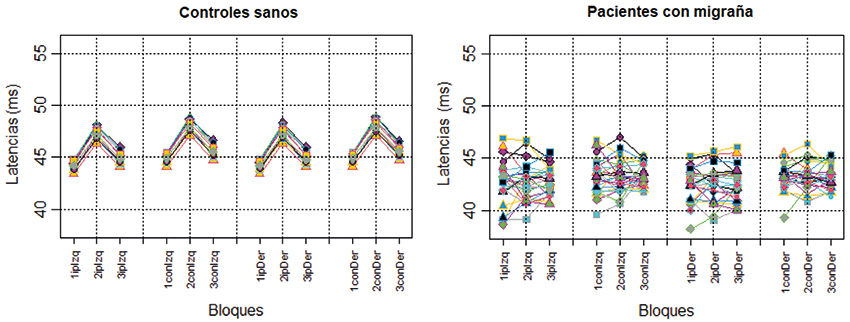
Para verificar la simetría de las mediciones se compararon los bloques según su número de orden y lateralidad, y no se encontraron diferencias significativas en el grupo control (Tabla II), al contrario de los pacientes migrañosos, los cuales sí que demuestran una diferencia significativa; de esta manera, lo que originalmente eran 12 variables, se agruparon en seis al eliminarse la lateralidad izquierda/derecha.
Tabla II. Diferencia de medias según lado y bloque en el grupo control.
|
| |
Izquierda
|
Derecha
|
Valor de p
|
Bloque 1
|
Ipsilateral
|
44,3
|
44,3
|
0,91
|
Contralateral
|
45
|
45
|
0,94
|
Bloque 2
|
Ipsilateral
|
47,2
|
47,2
|
0,96
|
Contralateral
|
47,9
|
47,9
|
0,93
|
Bloque 3
|
Ipsilateral
|
45,1
|
45
|
0,99
|
Contralateral
|
45,7
|
45,7
|
0,99
|
Respecto al análisis de distancias, ya en la comparación entre el bloque 1 y el bloque 2 se obtienen diferencias significativas tanto en la distancia Manhattan como en la euclidiana (control, <0,5; caso, >1,6; y control, <0,3; caso >0,9, respectivamente); las mismas que se incrementan al estudiar la combinación bloque 1-bloque 2-bloque 3 (control, <0,6; caso, >2,2; y control, <0,3; caso, >1; Manhattan y euclidiana, respectivamente).
Finalmente, al estudiar en el grupo caso los valores medios de los bloques se observa un incremento de las latencias tanto del bloque 2 como del 3 al compararlos con el 1, que no se observa en el grupo de pacientes con migraña, con una diferencia estadísticamente significativa (Tabla III; Fig. 3).
Tabla III. Prolongación de los valores medios de las latencias por bloque según lateralidad.
|
| |
|
Bloque 1
|
Bloque 2
|
Bloque 3
|
Controles
|
Ipsilateral izquierdo
|
44,3
|
47,2 (<0,0001)a
|
45,1 (0,0005)b
|
Contralateral izquierdo
|
45
|
47,9 (<0,0001)a
|
45,7 (0,0004)b
|
Ipsilateral derecho
|
44,3
|
47,2 (<0,0001)a
|
45 (0,0007)b
|
Contralateral derecho
|
45
|
47,9 (<0,0001)a
|
45,7 (0,0004)b
|
Pacientes con migraña
|
Ipsilateral izquierdo
|
43,8
|
44 (0,83)a
|
44,2 (0,74)b
|
Contralateral izquierdo
|
44,5
|
44,9 (0,96)a
|
44,8 (0,92)b
|
Ipsilateral derecho
|
43,8
|
43,9 (0,68)a
|
44,1 (0,7)b
|
Contralateral derecho
|
44,6
|
44,9 (0,63)a
|
45 (0,8)b
|
a Valor de p de comparación del bloque 1 con el bloque 2; b Valor de p de comparación del bloque 1 con el bloque 3.
|