Tabla I. Modelos de pronóstico para predecir la fenoconversión en pacientes con trastorno de conducta del sueño con movimientos oculares rápidos.
|
| |
Odds ratio
|
Inferior-superior (IC 95%)
|
Valor de t
|
Valor de p
|
Evaluaciones clínicas
|
|
|
|
|
Sexo masculino
|
0,788
|
0,163-3,794
|
0,147
|
0,772
|
Edad ≥60 años
|
12,923
|
1,43-116,785
|
2,887
|
0,006a
|
Pérdida de la visión del color
|
1,111
|
0,192-6,44
|
0,115
|
0,909
|
Síntomas depresivos
|
0,203
|
0,036-1,148
|
–1,957
|
0,057
|
Estreñimiento
|
0,486
|
0,349-0,677
|
2,841
|
0,007a
|
Pérdida del olfato
|
0,865
|
0,761-0,982
|
1,093
|
0,281
|
Sexo masculino + síntomas depresivos + estreñimiento + pérdida del olfato
|
1,619
|
0,146-17,935
|
0,388
|
0,7
|
Sexo masculino + estreñimiento + pérdida del olfato
|
3,1
|
0,579-16,586
|
1,362
|
0,18
|
Edad ≥60 años + pérdida de la visión del color
|
8,1
|
1,398-46,944
|
2,72
|
0,009a
|
Edad ≥60 años + pérdida del olfato
|
14,583
|
1,607-132,334
|
3,09
|
0,004a
|
Edad ≥60 años + estreñimiento
|
36,167
|
3,735-350,187
|
4,935
|
<0,001a
|
Edad ≥60 años + estreñimiento + pérdida del olfato
|
44,8
|
4,503-445,734
|
5,457
|
<0,001a
|
Estreñimiento + pérdida del olfato
|
0,378
|
0,25-0,572
|
3,544
|
0,001a
|
Medidas cuantitativas
|
Desaceleración del EEG espectral
|
0,405
|
0,274-0,599
|
3,348
|
0,002a
|
Edad ≥60 años + desaceleración del EEG espectral
|
36,167
|
3,735-350,187
|
4,935
|
<0,001a
|
Estreñimiento + desaceleración del EEG espectral
|
0,216
|
0,117-0,399
|
5,264
|
<0,001a
|
Pérdida del olfato + desaceleración del EEG espectral
|
0,324
|
0,204-0,516
|
3,991
|
<0,001a
|
Edad ≥60 años + estreñimiento + pérdida del olfato + desaceleración del EEG espectral
|
122,5
|
9,72-1.543,836
|
8,3
|
<0,001a
|
EEG: electroencefalograma; IC 95%: intervalo de confianza al 95%. a Valor de p < 0,05.
|
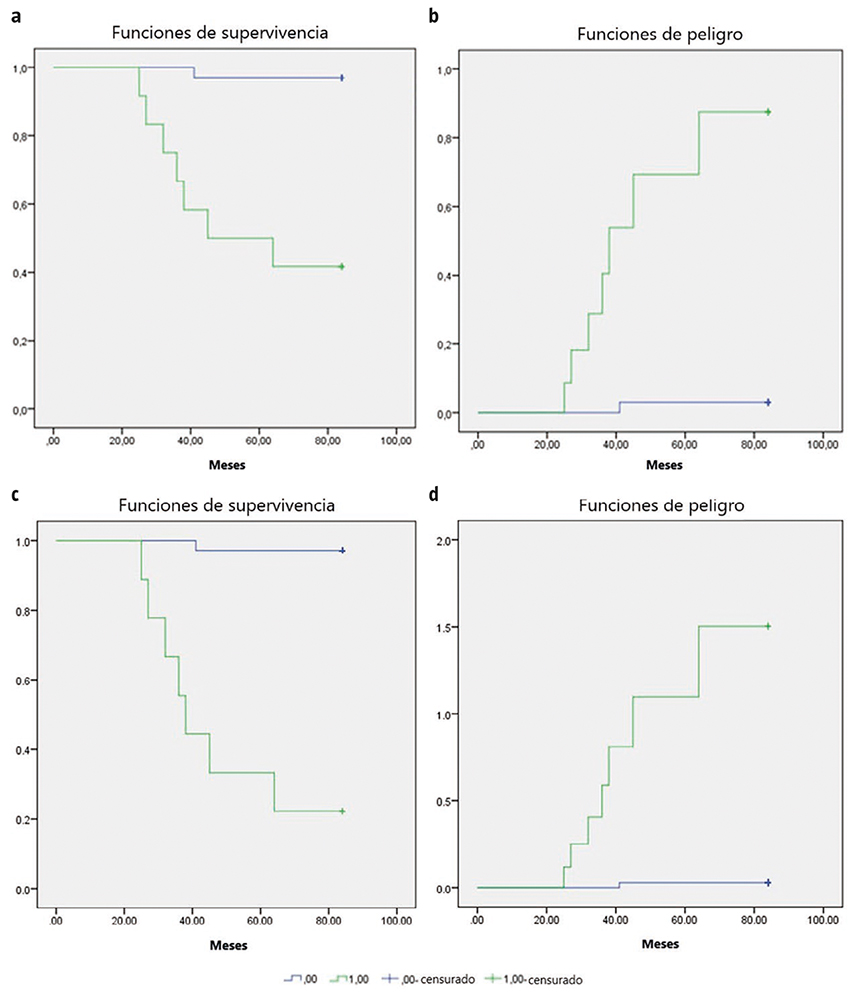
Figura 2. El análisis de supervivencia de Kaplan-Meier (a) y el análisis de la función de Hazard (b) para el modelo incluyen edad ≥60 años, anosmia y estreñimiento; y análisis de supervivencia de Kaplan-Meier (c) y análisis de la función de riesgo (d) para el modelo que incluye las medidas clínicas (edad ≥60 años, anosmia y estreñimiento) y cuantitativas (desaceleración del espectro electroencefalográfico).
Los datos de polisomnografía no mostraron diferencias significativas entre los pacientes con iRBD con y sin fenoconversión (Tabla II). El sueño REM sin atonía se detectó en la electromiografía del mentón en la mayoría (80%), seguido de los músculos del mentón y tibial anterior (15,5%), y sólo en las extremidades inferiores (4,5%). El tipo de sueño REM sin atonía fue fásico y tónico en el 71,1% de los pacientes, seguido del sueño REM sin atonía fásico (17,7%) y tónico (11,2%). Si bien el sueño REM sin atonía se detectó principalmente en la electromiografía de mentón en tipo mixto (fásico y tónico) en pacientes con fenoconversión, ni la localización (
p = 0,331) ni el tipo (
p = 0,291) de sueño REM sin atonía mostraron una asociación significativa con la fenoconversión. El análisis de regresión mostró que un aumento en la latencia del sueño se correlacionaba positivamente con la fenoconversión (
r = 0,38;
p = 0,022; Tabla III). El análisis del huso del sueño no mostró diferencias significativas entre los pacientes con y sin fenoconversión (Tabla II). El análisis de regresión tampoco logró demostrar una correlación significativa entre la duración, la frecuencia o la densidad de los husos del sueño con la fenoconversión (Tabla III).
Tabla II. Análisis del uso del sueño en pacientes con trastorno de conducta del sueño con movimientos oculares rápidos con y sin fenoconversión.
|
| |
Pacientes con fenoconversión
(n = 8)
|
Pacientes sin fenoconversión
(n = 37)
|
Valor de p
|
Parámetros del polisomnograma
|
|
|
|
Tiempo total de sueño (minutos)
|
398,6 ± 45,3
|
376,6 ± 46,2
|
0,327
|
Latencia del sueño (minutos)
|
35,2 ± 44,6
|
13,4 ± 12,2
|
0,597
|
Latencia del sueño REM (minutos)
|
149,8 ± 114,4
|
162,6 ± 103
|
0,56
|
Eficiencia del sueño (%)
|
85,2 ± 10,1
|
83,6 ± 9,1
|
0,59
|
Vigilia (%)
|
11,6 ± 9,6
|
14,2 ± 9
|
0,41
|
Etapa de sueño N1 (%)
|
5,6 ± 3
|
6,9 ± 3,4
|
0,36
|
Etapa de sueño N2 (%)
|
49,5 ± 14,6
|
43,2 ± 10,2
|
0,2
|
Etapa de sueño N3 (%)
|
18,3 ± 11
|
18,4 ± 9,6
|
0,893
|
Etapa de sueño R (%)
|
14,9 ± 5,8
|
18 ± 12,2
|
0,463
|
Índice de movimientos periódicos de piernas (por hora)
|
14,2 ± 32,6
|
11,2 ± 16,1
|
0,61
|
Análisis del huso del sueño
|
Duración (segundos)
|
0,6 ± 0,07
|
0,6 ± 0,1
|
0,673
|
Frecuencia (Hz)
|
12,6 ± 1,2
|
12,4 ± 0,6
|
0,716
|
Densidad (número por minuto)
|
5,5 ± 2,4
|
5,4 ± 2,3
|
0,694
|
 Castellano
Castellano
 English
English