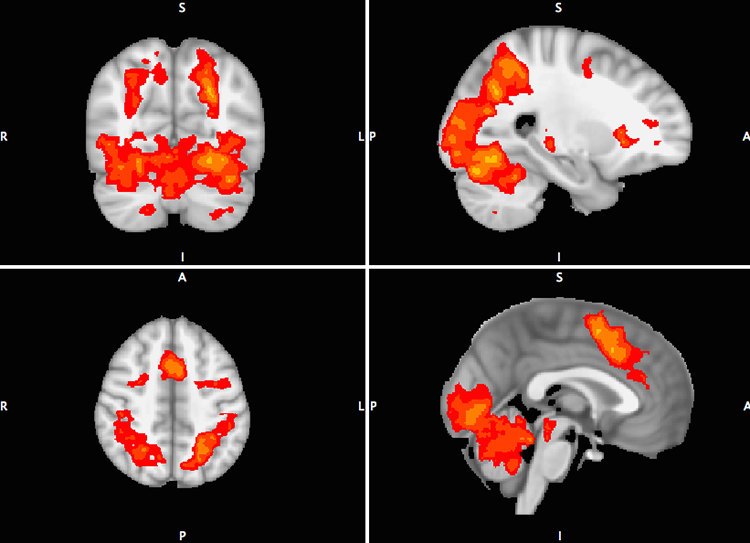
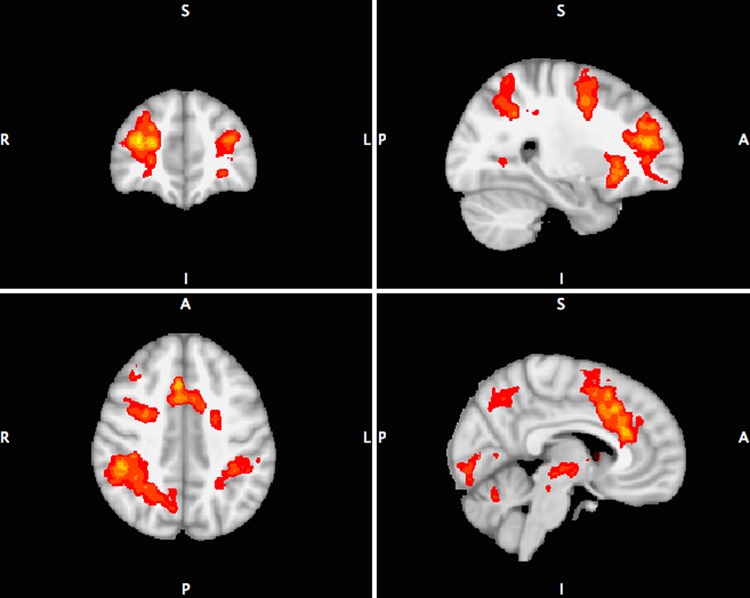
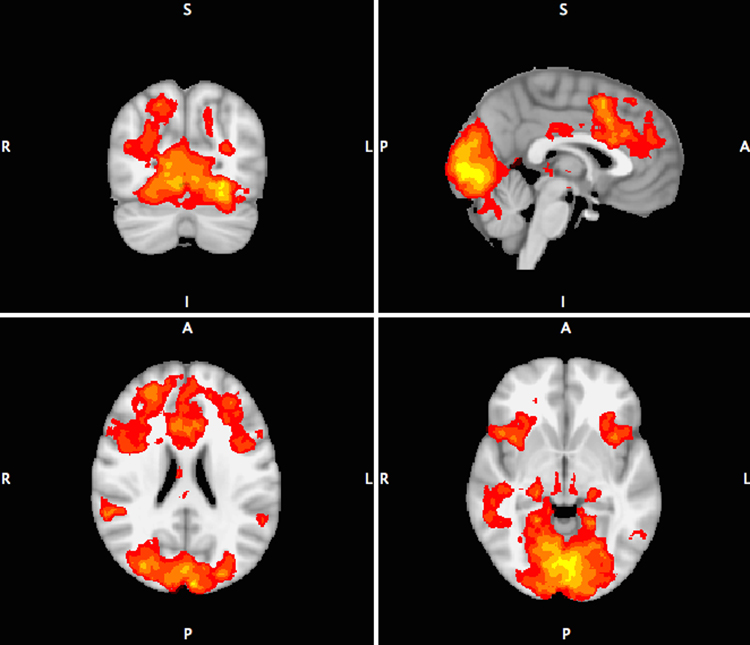
Tabla II. Descripción de los diferentes paradigmas utilizados en resonancia magnética funcional.
|
Paradigma
|
Test de atención inhibitoria con letras (Go/No Go)
|
Test de atención inhibitoria con alimentos (Go/No Go)
|
Test de Atención Continua-Pares Idénticos (CPT-IP)
|
Descripción
|
Se muestran las letras aleatorias, se debe presionar un botón al ver cualquier letra excepto ‘x’
|
Se muestran imágenes de alimentos, se debe presionar un botón al ver alimentos saludables y no hacerlo con alimentos no saludables
|
Se muestran números de cuatro dígitos, se debe responder si son iguales o diferentes
|
Ciclos
|
Tres ciclos de activación y cuatro ciclos de descanso
|
Tres ciclos de activación y cuatro ciclos de descanso
|
Cuatro bloques de activación y cinco bloques de descanso
|
Duración del ciclo
|
20 segundos
|
20 segundos
|
30 segundos
|
Contenido durante los ciclos de activación
|
Letras aleatorias con 25% de probabilidad de ‘x’ y 75% de otras letras
|
Imágenes de alimentos con 75% saludables y 25% no saludables
|
Números de cuatro dígitos con 50% de probabilidad de ser iguales
|
Contenido durante los ciclos de descanso
|
No se muestran las letras ‘x’
|
Imágenes de alimentos saludables
|
Número ‘1111’ inmóvil
|
Parámetros de adquisición
|
70 volúmenes; 25 cortes por volumen; TR: 2.000 ms; tiempo total: 2 minutos, 33 segundos
|
70 volúmenes; 25 cortes por volumen, TR: 2.000 ms; tiempo total: 2 minutos, 22 segundos
|
Tiempo total: 4 minutos, 30 segundos; 90 volúmenes, 25 cortes por volumen
|
Tiempo de Eco
|
30 ms
|
30 ms
|
30 ms
|
Tamaño de vóxel
|
2,6 x 2,6 x 5 mm
|
2,6 x 2,6 x 5 mm
|
2,6 x 2,6 x 5 mm
|
Porcentaje de fase de field of view
|
240
|
240
|
240
|
Grosor de corte
|
5 mm
|
5 mm
|
5 mm
|
Espacio entre cortes
|
1 m
|
1 m
|
1 m
|
Ángulo de inclinación del pulso de radiofrecuencia
|
90 grados
|
90 grados
|
90 grados
|
TR: tiempo de repetición.
|