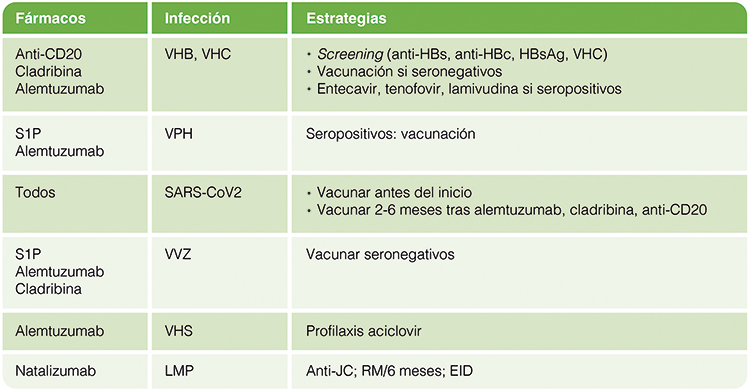
MAGNIFY-MS [90]
|
Estratificación de 211 pacientes en función de la presencia de lesiones CUA en basal y tras 24 meses de iniciar el tratamiento:
- Sin lesiones CUA (BL CUA = 0, M24 CUA = 0)
- Resolución de lesiones CUA
(BL CUA > 0, M24 CUA = 0)
- Con lesiones residuales
(BL CUA > 0, M24 CUA > 0)
|
Cambio en el recuento de subconjuntos linfocitarios y su relación con los resultados de RM
|
- Reducción de lesiones CUA en el grupo con lesiones CUA resueltas en M24 y lesiones residuales
- El grupo de lesión CUA residual muestra un mayor aumento de células B de memoria desde el nadir en el mes 12
|
Análisis retrospectivo del estudio CLARITY [91]
|
Análisis retrospectivo sobre patrones de atrofia en pacientes tratados con cladribina y placebo durante dos años de seguimiento
|
Atrofia de volumen cerebral global, sustancia gris profunda, tálamo y tronco cerebral [91]
|
El tratamiento con cladribina se asoció con una menor atrofia regional
|
CLOBAS [92]
|
Estudio de fase IV en curso de seis años de seguimiento, que incorpora biomarcadores clínicos, hematológicos, bioquímicos, epigenéticos, radiológicos y cognitivos de la enfermedad
|
Relación entre los niveles basales de NfL y GFAP con la probabilidad de alcanzar NEDA-3 en los 30 primeros meses en 156 pacientes
|
Sólo se observó una asociación significativa entre los niveles basales de NfL y NEDA-3
|
MAVEN-4 [93]
|
Estudio observacional prospectivo en curso de siete años de seguimiento
|
Datos actualizados tras dos años en 246 pacientes
|
Tras dos años de tratamiento con cladribina:
- La TAB se redujo en un 68% (siendo superior en pacientes naive para el TME)
- El 85% de los pacientes estaba libres de progresión
- El 96,4% no requirió un cambio de tratamiento
- Menor persistencia del fármaco en pacientes procedentes de TME de alta eficacia
Conclusión: funciona mejor en fases precoces de EM
|
Serie italiana [94]
|
Estudio observacional prospectivo de dos años de seguimiento
|
Datos a dos años en 106 pacientes naive
|
Tras dos años de tratamiento con cladribina:
- El 80% de los pacientes estaba libre de brotes
- El 75% alcanzó el estado NEDA-3
Conclusiones:
- El paciente naive es el candidato ideal para el uso de cladribina
- El uso temprano potenciaría el beneficio del fármaco
|
Serie australiana [95]
|
Estudio prospectivo de cinco años de seguimiento
|
Datos a cuatro años en 255 pacientes con una edad media > 50 años y 2,7 tratamientos previos
|
Tras cuatro años de tratamiento con cladribina:
- El 80% de los pacientes no empeora en su EDSS, incluso el 20% mejora
- Reducción de la TAB a partir del mes 12, que se mantiene
- La cinética de linfopenia se compara con la de pacientes más jóvenes
- El porcentaje de pacientes con linfopenia de grado 4 es del 0,5%
- La incidencia de AA de infección es similar a la de los estudios pivotales y otras series
- Los niveles de IgG e IgM no disminuyen de forma significativa
|
Serie española unicéntrica del Hospital Clínico San Carlos [96]
|
Cohorte observacional de cinco años de seguimiento en estadios tempranos de la enfermedad
|
Actividad de la enfermedad y necesidad de cursos adicionales en 100 pacientes
- Datos a 3-4 años (n = 45)
- Datos a cinco años (n = 21)
|
- El 82% están libres de actividad
- 13/45 pacientes muestran actividad y 10 necesitan un tercer ciclo de cladribina
- 15/21 pacientes están estables clínica y radiológicamente, pero inician un ciclo adicional de cladribina basándose en factores de mal pronóstico
|
Serie española del Hospital Virgen de
la Arrixaca [97]
|
Cohorte observacional de cuatro y cinco años de seguimiento en estadios tempranos de la enfermedad
|
Fatores de riesgo para el retratamiento en 92 pacientes:
- Datos a cuatro años (n = 31)
- Datos a cinco años (n = 12)
|
Paciente respondedor:
- >45 años
- Tratamiento precoz
- Sin lesiones Gd/lesiones medulares
|
Serie española del Hospital Virgen de
la Macarena [98]
|
Cohorte observacional en estadios tempranos de la enfermedad
|
Datos a cinco años
|
- Estabilización de la EDSS
- Reducción mantenida de la TAB
|
CLADRIGAL [99]
|
Cohorte observacional en estadios tempranos de la enfermedad
|
Datos a dos años
|
- Estabilización de la EDSS
- Reducción mantenida de la TAB
|
CLARENCE [100]
|
Cohorte observacional de cinco años de seguimiento
|
Análisis de la persistencia al tratamiento tras cinco años
(n = 2.684) y evolución de la EDSS tras dos años (n = 955)
|
- El 7% necesitó un cambio de tratamiento, debido a un fracaso terapéutico en el 3,6%
- El 85% no mostró un empeoramiento de la EDSS
|
Evobrutinib
|
OLE [101]
|
Fase de extensión abierta (OLE) del ensayo clínico de fase II doble ciego comparado con placebo
|
Nuevos datos a cinco años en pacientes que cambiaron desde evobrutinib 75 mg/día (durante 49,8 semanas) a 75 mg/2 × día
|
- Reducción en la TAB de 0,2 (75 mg/día) a 0,11 (75 mg/2 × día)
- Aumento en el porcentaje de pacientes libres de lesiones Gd (70,9%, 75 mg/día, frente a 76,1%, 75 mg/2 × día)
- El 87,1% de los pacientes no mostró empeoramiento clínico (sin brotes y sin progresión de la discapacidad) en el quinto año
- No se observaron hallazgos de seguridad inesperados
- El 2,4% experimentó AA graves relacionados
|
Phase II [102]
|
Ensayo clínico de fase II aleatorizado doble ciego y controlado con placebo
|
Nuevos datos de vitalidad y salud mental medidas con la escala de salud SF-36 a 48 semanas
|
- Los dominios fatiga, vitalidad y salud mental mejoraron de forma significativa con la dosis 75 mg/2 × día
|
evolutionRMS (1 y 2) [103]
|
Ensayos clínicos de fase III aleatorizados doble ciegos y con doble simulación de evobrutinib (45 mg/2 × día) frente a teriflunomida
|
Análisis de las características basales
|
- El 96,1%, con EMRR
- El 67%, mujeres
- Duración media de la enfermedad: 4,7 años
- Puntuación media de la EDSS: 2,8
- El 63,5%, naIve para TME
Importante: son los primeros ensayos clínicos que incluyen como objetivos secundarios el análisis de biomarcadores y PRO
|
AA: acontecimiento adverso; BL: basal; CUA: lesiones activas únicas combinadas; EDSS: Expanded Disability Status Scale; EM: esclerosis múltiple; EMRR: esclerosis múltiple remitente-recurrente; Gd: gadolinio; GPFA: proteína acídica fibrilar glial; Ig: inmunoglobulina; M24: mes 24; NEDA: no evidencia de la actividad de la enfermedad; NfL: neurofilamentos de cadena ligera; PRO: patient-reported outcomes; RM: resonancia magnética; TAB: tasa anualizada de brotes; TME: tratamiento modificador de la enfermedad.
|