Introducción
El diagnóstico de epilepsia se basa en la historia clínica, pero se apoya en el electroencefalograma (EEG) como la prueba más relevante. El EEG contribuye a confirmar el diagnóstico clínico de crisis y a establecer un riesgo de recurrencia, y resulta de gran ayuda en la clasificación de las crisis o tipo de epilepsia y en la selección terapéutica más adecuada. El EEG consiste en el registro gráfico de la sumación de los potenciales eléctricos generados por las neuronas corticales, que dan lugar a oscilaciones rítmicas, bien caracterizadas morfológicamente. Su interpretación se basa en el análisis visual de estos grafoelementos y su clasificación de acuerdo con unos criterios estandarizados [1,2]. Aun así, esta interpretación puede estar sujeta a considerable variabilidad interobservador, muchas veces marcada por un insuficiente entrenamiento o experiencia en la lectura del EEG [3,4]. La correcta interpretación del EEG es esencial, tanto por identificar hallazgos patológicos como por saber diferenciarlos de artefactos, anomalías inespecíficas y de variantes de la normalidad.
Una de las alteraciones más relevantes que podemos encontrar en un EEG es la actividad epileptiforme, definida por unos criterios globalmente aceptados. La Federación Internacional de Neurofisiología Clínica ha establecido una definición práctica de descarga epileptiforme interictal (DEI) [1], validada clínicamente [5], que exige una serie de características que debe cumplir un potencial para ser considerado como epileptiforme. Estos criterios incluyen morfología de onda bi- o trifásica de aspecto agudo, duración (<70 ms para la punta y 70-200 ms para la onda aguda), asimetría (pendiente ascendente pronunciada y pendiente descendente más gradual), presencia de onda lenta posterior, distorsión asociada de la actividad de fondo y una distribución espacial lógica o campo. Para que un potencial sea considerado epileptiforme con un nivel de certeza elevado, se deben cumplir cinco de estos seis criterios [5].
De acuerdo con lo anterior, la presencia de potenciales de aspecto agudo en el EEG no necesariamente debe implicar un diagnóstico de epilepsia. En primer lugar, porque la epilepsia viene definida por criterios clínicos [6]. Por otro lado, es posible encontrar actividad epileptiforme en un 1,74% de los EEG de personas sin epilepsia [7]. Esta cifra se incrementa en ancianos y sobre todo en niños, con estudios que encuentran DEI en niños asintomáticos entre el 0,6 y el 6,5% según las series [8].
Una de las fuentes de error más habituales a la hora de informar un EEG es considerar a todo potencial agudo como epileptiforme. Se da el caso de que algunos artefactos, fluctuaciones de la actividad de fondo de aspecto afilado, cambios relacionados con la hiperventilación o el sueño y variantes normales de aspecto epileptiforme pueden ser confundidas con DEI con relativa frecuencia [9] (Tabla I). Algunos de estos elementos pueden presentar un aspecto agudo, una morfología sugerente o tener un campo de distribución con una ‘inversión de fase’, pero no reúnen los suficientes criterios como para ser considerados DEI. Es importante recordar que la presencia de una inversión de fase en un montaje bipolar nos permite localizar la zona de potencial máximo de un elemento y hacernos una idea de su distribución espacial, pero no es indicativa de su naturaleza (epileptiforme o no) [10,11].
Tabla I. Principales diferencias entre variantes epileptiformes benignas y descargas epileptiformes.
|
Variantes epileptiformes benignas
|
Descargas epileptiformes
|
- Morfología constante
- Distribución amplia/bilateral/cambiante
- Sin distorsión de la actividad de fondo
- Onda lenta posterior variable
- Sin evolución (SREDA, RMTD)
- Preferencia somnolencia/sueño ligero
- Jóvenes (salvo SREDA)
|
- Morfología y amplitud variables
- Distribución fija, constante
- Distorsión de la actividad de fondo
- Onda lenta posterior de igual o mayor amplitud
- Evolución espaciotemporal en patrones ictales
- Vigilia y sueño (todas las fases)
- Cualquier edad
|
RMTD: descarga rítmica temporal media; SREDA: descarga rítmica epileptiforme subclínica del adulto.
|
Las variantes normales de aspecto epileptiforme, también llamadas variantes de significado incierto, patrones pseudoepileptiformes o variantes epileptiformes benignas (VEB), consisten en grafoelementos del electroencefalograma que tienen una apariencia epileptiforme, pero no presentan relación con crisis epilépticas [12-18]. Inicialmente se describieron en personas con epilepsia y patologías neuropsiquiátricas, dado que la mayor parte de los estudios EEG se realizaban en este tipo de pacientes. Con el tiempo, se observó que estas variantes también aparecían en pacientes sin epilepsia o con enfermedades muy diversas, por lo que se llegó a la conclusión de que suponían hallazgos poco específicos, sin valor diagnóstico. También se describen varios elementos del EEG normal que pueden tener un aspecto ‘sospechoso’, con los que estamos más familiarizados, como son los positive occipital sharp transients of sleep, las ondas de vértex en sueño, las ondas lambda o los cambios inducidos por la hiperventilación. Las principales VEB (Tabla II) son elementos menos frecuentes, que precisan un cierto grado de experiencia y su conocimiento específico por parte de los responsables del informe electroencefalográfico, para evitar confusión con descargas epileptiformes genuinas.
Tabla II. Actividad normal de aspecto epileptiforme en el electroencefalograma.
|
| |
Aspecto interictal
|
Aspecto ictal
|
Ondas con morfología aguda
|
- Actividad de sueño: ondas V, POST
- Ondas lambda
|
- Ritmo mu,
- Actividad alfa fragmentada
- Ritmo de brecha (defecto óseo)
|
Variantes epileptiformes benignas
|
- Punta/ritmo en empalizada (wicket)
- Puntas benignas del sueño
- Puntas positivas a 14 y 6 Hz
- Punta-onda a 6 Hz (punta-onda fantasma)
|
- Descarga rítmica temporal media (RMTD)
- SREDA
|
POST: positive occipital sharp transients; RMTD: descarga rítmica temporal media; SREDA: descarga rítmica epileptiforme subclínica del adulto.
|
Características de las variantes epileptiformes benignas
Desconocemos la prevalencia de las VEB en población general, salvo por algunos estudios que recogen los datos obtenidos de personal aéreo militar y civil, en los que el EEG forma parte de la valoración médica necesaria para su admisión [19-22]. No obstante, en dichos estudios se describen fundamentalmente la presencia de DEI y variantes normales de aspecto inespecífico sin apenas datos sobre variantes normales de aspecto epileptiforme. La prevalencia global de las VEB está fundamentalmente caracterizada en series de pacientes referidos para realización de EEG. La mayoría de las series son retrospectivas y agrupan a pacientes con epilepsia y otras patologías. Los resultados son extremadamente heterogéneos, con cifras que oscilan desde el 3,3 hasta el 28,8% de los EEG revisados (Tabla III) [15-17,23-29]. Salvo la descarga rítmica epileptiforme subclínica del adulto (SREDA), que es una variante infrecuente en todas las series, el resto de las VEB muestran cifras muy variables en los distintos trabajos. Esta variabilidad se debe a diferencias metodológicas, como el tipo de estudios EEG seleccionados (vigilia o sueño) y el empleo de métodos de activación (privación de sueño), además de su duración (breves frente a monitorizaciones prolongadas). La edad de los pacientes influye en la presencia de determinadas VEB, y la mayor parte predomina en pacientes jóvenes. Por otro lado, en la era analógica del EEG cobraban gran importancia el tipo de montajes empleados, ya que hay ciertas variables que por su distribución y amplitud se observan bien en montajes con referencia a las orejas [30]. El tipo de electrodos (de superficie o scalp frente a nasofaríngeos, ovales o profundos) también ofrece resultados diferentes, con mucha mayor presencia de estas VEB cuando se emplean electrodos invasivos o semiinvasivos [31]. Además, estas cifras se ven afectadas por sesgos de interpretación e incluso por el tipo de variantes analizadas, ya que muchos estudios engrosan sus series añadiendo variantes de la normalidad inespecíficas y de aspecto no epileptiforme [27].
Tabla III. Datos de prevalencia de variantes epileptiformes benignas en distintas series publicadas (ampliado de [15]).
|
| |
n pacientes
|
Tipo de EEG
|
Total %
|
SSS %
|
WS %
|
14-6 Hz %
|
P-O 6 Hz %
|
RMTD %
|
SREDA %
|
Gibbs, 1963
|
50.000
|
Vigilia/sueño
|
–
|
–
|
–
|
–
|
–
|
0,5
|
–
|
Lombroso, 1966
|
155
(13-15 años)
|
Vigilia/sueño
|
–
|
–
|
–
|
58
|
–
|
–
|
–
|
White, 1977
|
599
|
Vigilia/sueño + privación sueño
|
–
|
20 electrodos nasofaríngeos
|
–
|
–
|
–
|
–
|
–
|
Reiher, 1977
|
4.458
|
Vigilia/sueño
|
–
|
–
|
0,8
|
–
|
–
|
–
|
–
|
Hughes, 1980
|
61.467
|
Vigilia/sueño
|
–
|
–
|
–
|
–
|
2,5
|
–
|
–
|
Westmoreland, 1997
|
108
|
Vigilia/sueño
|
–
|
–
|
–
|
–
|
–
|
–
|
0,04
|
Radhakrishnan, 1999
|
1.778
|
Vigilia/sueño
|
18,3
|
8,16
|
0,96
|
5,68
|
2,76
|
0,79
|
0
|
Santoshkumar, 2009
|
35.249
|
Vigilia/sueño
|
3,7
|
1,9
|
0,04
|
0,52
|
1,02
|
0,12
|
0,07
|
Mothersill, 2012
|
2.122
|
MVEEGP
|
–
|
3,8
|
7
|
–
|
1,8
|
–
|
–
|
Dash, 2013
|
5.200
|
Vigilia/sueño
|
14
|
5,1
|
2,6
|
4,7
|
0,19
|
1,3
|
0,07
|
Iste, 2020
|
22.234
|
–
|
–
|
–
|
–
|
–
|
–
|
–
|
0,06
|
Rathore, 2021
|
1.862
|
Vigilia/sueño
|
12,6
|
3,7
|
6,8
|
0,6
|
0,9
|
0,4
|
0,2
|
Macorig, 2021
|
1.163
|
MVEEGP
|
28,8
|
3,3
|
15
|
8,3
|
0,1
|
2,15
|
0
|
Wüstanhagen, 2022
|
2.319
|
Vigilia/sueño
|
28,8
|
1,05
|
19,2a
|
1,83
|
0,69
|
6
|
0,03
|
Ananthasubramanian, 2023
|
3.000
|
Vigilia/sueño
|
11,8
|
3,8
|
3,8
|
1,3
|
1,8
|
1,1
|
0,03
|
14-6 Hz: puntas positivas a 14 y 6 Hz; MVEEGP: monitorización videoelectroencefalográfica prolongada; P-O 6 Hz: punta-onda a 6 Hz; RMTD: descarga rítmica temporal media; SREDA: descarga rítmica epileptiforme subclínica del adulto; SSS: puntas benignas del sueño; WS: punta en empalizada (wicket spike). a Incluye todos los elementos agudos, además de WS.
|
La confusión de un grafoelemento normal o de una VEB con actividad epileptiforme es más frecuente de lo deseable y ocurre en más de un 30% de los EEG revisados de una institución [9]. Este problema se puede producir por varios motivos, pero habitualmente se suma la inexperiencia o falta de familiaridad con estas variantes con los sesgos de interpretación (‘ajustar’ el informe del EEG a la sospecha clínica) y de percepción (buscar ‘intensamente’ las puntas en pacientes con sospecha de epilepsia) [32]. Múltiples trabajos insisten en la necesidad de mejorar el conocimiento de estos elementos y realizar un abordaje más ‘conservador’ a la hora de informarlos por encima de una interpretación excesiva [33-37]. El diagnóstico de epilepsia basado en la sobreinterpretación del EEG acarrea graves implicaciones no sólo desde el punto de vista terapéutico, sino por las consecuencias laborales, personales y sociales que conlleva dicho diagnóstico [38,39].
Los patrones más susceptibles de diagnóstico erróneo en el EEG son las VEB, la hipersincronía hipnagógica y los cambios relacionados con hiperventilación, pero, cuando se analiza este problema en algunas series, en la mayoría de los casos se encuentra que son las wicket spikes y simples fluctuaciones de la actividad de fondo de aspecto afilado ‘sin nombre’ o incluso actividad alfa fragmentada [9,10,25,40,41].
Punta en empalizada (wicket spike)
La describieron inicialmente Reiher y Lebel en una serie de 4.458 pacientes con una frecuencia del 2,9%, similar en pacientes con y sin epilepsia [42]. Consisten en ondas monofásicas a 6-11 Hz, de aspecto arciforme o afilado, que aparecen de forma aislada o integradas en trenes de breve duración (0,5-3 segundos), con una amplitud media y polaridad negativa (Fig. 1). Se distribuyen a nivel temporal anterior y medio, y se observan en la vigilia y el sueño superficial, fundamentalmente. Habitualmente son más fáciles de diferenciar cuando se integran en trenes, que pueden ser uni- o bilaterales (wicket rhythm o ritmo en empalizada) [43-45]. Algunos trabajos encuentran mayor predominio temporal izquierdo [46]. Probablemente constituyen una actividad alfa temporal fragmentada [43]. Cuando aparecen de forma aislada, pueden ser confundidas con DEI temporales si no se analizan adecuadamente. El hecho de que no se sigan de una onda lenta posterior y de que no distorsionen la actividad de fondo es un dato que apoya su diagnóstico. Para algunos autores, ésta es una de las variantes que con más frecuencia se etiqueta erróneamente como epileptiforme [9,47] y puede originar no sólo diagnósticos de epilepsia en pacientes con otras patologías, sino considerar que pacientes con una epilepsia generalizada tengan una epilepsia focal [48]. Su frecuencia de aparición es variable, por lo general baja en trabajos previos, entre el 0,03 y el 2,9%. En series recientes aparece con mayor frecuencia, entre el 6,8 y el 15% en estudios de monitorización EEG [15-17,23-29,49]. Predominan en adultos en edades medias, en torno a los 30 años. Algunos estudios previos han encontrado mayor presencia de esta variante en pacientes con migrañas, patología cerebrovascular o vértigo. Estudios de casos y controles posteriores han demostrado que la presencia de wicket spikes es incluso menor en pacientes con epilepsia frente a otras patologías [27], y que la mayor frecuencia de esta variante en pacientes con cefaleas o patología cerebrovascular desaparece cuando se ajustan los resultados por grupos de edad [50,51].
Figura 1. Punta en empalizada o wicket spike. Mujer de 43 años. Pérdida subjetiva de memoria. Punta aislada a nivel temporal anterior y medio izquierdo, sin morfología compatible con criterios de descarga epileptiforme interictal. No distorsiona la actividad de fondo y no hay asimetría de pendientes.
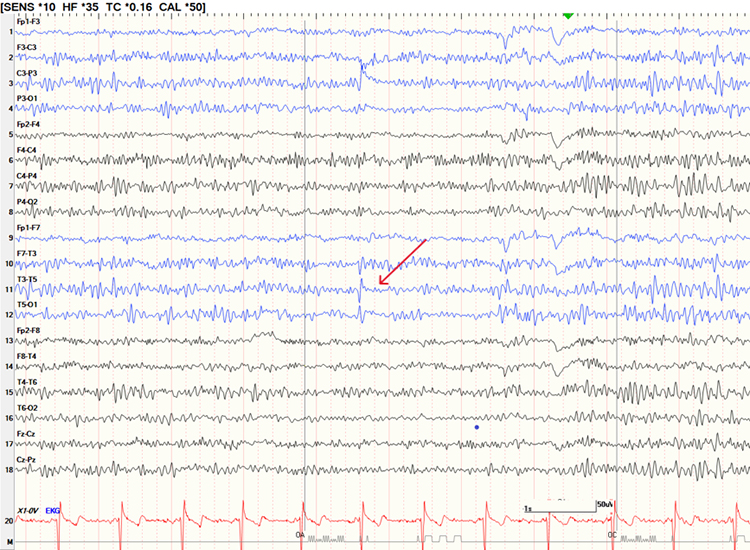
No obstante, un trabajo diferencia dos tipos de wicket spikes. Por un lado, las que aparecen integradas en trenes breves que se alternan bilateralmente y son más frecuentes en somnolencia, que suponen un hallazgo inespecífico. Por otro lado, aquéllas que aparecen de forma aislada, consistentemente unilaterales y en vigilia, serían más características de pacientes con epilepsia [24].
Ondas agudas epileptiformes benignas del sueño
También se conocen como pequeñas puntas agudas –small sharp spikes (SSS)– y puntas esporádicas benignas del sueño. Fueron descritas inicialmente por Gibbs [52]. Son puntas mono- o bifásicas de baja amplitud (<50 µV) y corta duración (<50 ms) que aparecen de forma aislada, sin disrupción de la actividad de fondo, con un dipolo horizontal que se distribuye en un campo amplio, anterior y temporal medio (Fig. 2). En algunos casos pueden ir seguidas de una pequeña onda lenta posterior, siempre de menor amplitud. Se registran durante la somnolencia y son más habituales en adultos de edad media, excepcionales en niños [43,45,53]. Es una de las variantes más frecuentes, con prevalencias del 1-8% [15-17,23-29]. El trabajo de White et al [54] encontró una prevalencia muy elevada, del 20% en casi 600 sujetos, pero se trataba de registros EEG de sueño con privación previa y empleando electrodos nasofaríngeos, que incrementaban sustancialmente la sensibilidad para detectar estos potenciales de baja amplitud.
Figura 2. Pequeñas puntas agudas –small sharp spikes (SSS)–, o BETS. Varón de 38 años. Síncope. Electroencefalograma en fase de sueño superficial. Se recogen varias puntas monofásicas de baja amplitud (<50 μV) y corta duración (<50 ms) que aparecen de forma aislada, sin disrupción de la actividad de fondo, con distribución amplia en ambas regiones temporales.
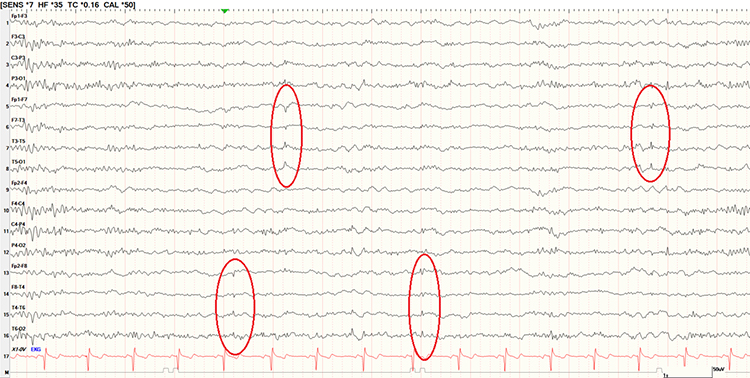
Es otra de las variantes más confundidas con DEI [17] y que suscita más debate sobre su significado clínico. Las descripciones iniciales consideraron que eran un tipo de DEI y se asociaban con crisis epilépticas [52]. El hecho de que su presencia se incremente con la privación de sueño fue otro argumento a favor [55]. Algunos encuentran que es un hallazgo que se vincula con mayor frecuencia a epilepsia, aunque sería un patrón que implica ‘epileptogenicidad moderada’ [53,56], y su aparición en edades más precoces se asociaría a epilepsia con mucha más frecuencia que cuando se registra en ancianos [56]. Trabajos posteriores encuentran SSS en una proporción similar en pacientes con y sin epilepsia [54,57,58].
Estudios con electrodos de superficie y monitorización EEG prolongada ofrecen resultados contradictorios. Por un lado, no se encuentra incremento de SSS en grupos con epilepsia frente a pacientes sin epilepsia [27]. Otros autores defienden que hay dos tipos de SSS, las que aparecen bilateralmente, sin relación con la epilepsia, y las que son persistentemente unilaterales, mucho más frecuentes en pacientes con epilepsia [24]. En un análisis sobre la presencia de actividad epileptiforme en EEG de 24 horas de sujetos con enfermedad de Alzheimer precoz se encuentra que, además de la presencia de DEI, un número elevado de SSS unilaterales se asocia con mayor riesgo de desarrollo de epilepsia en estos pacientes [59].
De forma más reciente se incorporan los datos de publicaciones sobre pacientes con epilepsias focales refractarias a los que se estudia simultáneamente con electrodos profundos y superficiales. Varios trabajos encuentran que, de forma síncrona con las SSS observadas en el EEG de superficie, subyacen descargas epileptiformes originadas en el hipocampo [60-62]. Por otro lado, aunque gran parte de las puntas hipocampales no se llegan a registrar en EEG de superficie, se han encontrado distintos correlatos de las descargas originadas en el hipocampo, como SSS, ondas agudas, ondas lentas afiladas y puntas. Parece que las SSS en EEG de superficie se observan cuando las puntas del hipocampo quedan confinadas a zonas mesiales y no involucran a la corteza lateral temporal, mientras que una mayor extensión a la corteza de esta actividad epileptiforme del hipocampo se traduciría en actividad epileptiforme clara en la superficie (puntas y ondas agudas) [63]. Esto puede implicar que las SSS se consideren en algunos casos un marcador poco sensible, pero precoz y específico, de la epilepsia temporal mesial [63], aunque este hallazgo entra en conflicto con el hecho de que esta variante se registre en pacientes sin epilepsia. Trabajos con magnetoencefalografía en un escaso número de pacientes encuentran SSS con mayor frecuencia en pacientes con epilepsia temporal frente a extratemporal y observan que algunas SSS se corresponden con DEI de baja amplitud identificadas por magnetoencefalografía [64].
A la vista de todo lo anterior, es necesario, en primer lugar, saber diferenciar morfológicamente las SSS de puntas temporales que constituyen claras DEI; y, en segundo lugar, tener en cuenta el contexto clínico y otros hallazgos asociados en el EEG para poder determinar qué subtipo de SSS pueden estar vinculadas a epilepsia, siendo muy cautelosos en nuestras conclusiones [65,66].
Punta-onda a 6 Hz
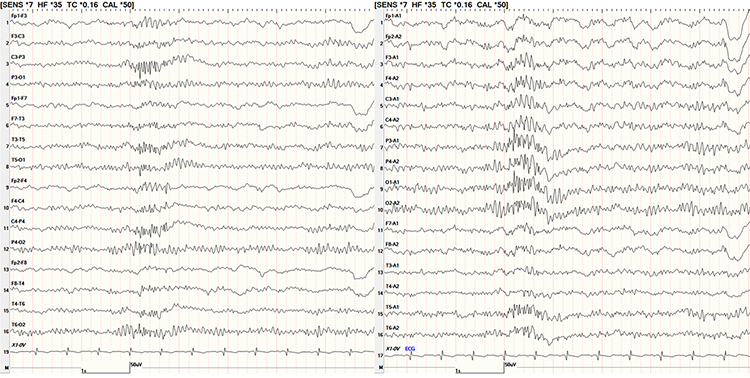
Se denominó inicialmente ‘punta-onda fantasma’ o ‘larvada’, para destacar que la punta tiene baja amplitud y a veces es difícil distinguirla de la onda lenta posterior, mucho más prominente. La punta es de amplitud baja, <40 µV, y duración muy breve. Aparece organizada en brotes cortos bilaterales de 1-2 segundos con una frecuencia de 5-6 Hz. Una de las primeras descripciones diferenció dos tipos [67]: el primero, con predominio anterior, punta de mayor amplitud (>45 µV ) y que se observaba en vigilia, sobre todo en varones (WHAM) (Fig. 3a); y el otro tipo, con distribución predominantemente posterior, baja amplitud, que aparecía en somnolencia y con predomino en mujeres, descrito con el acrónimo FOLD (Fig. 3b). Mientras que la variante FOLD apenas se relacionaba con la presencia de crisis, la variante de aspecto WHAM se observaba con mucha mayor frecuencia en pacientes con epilepsia [24,67]. El estudio de un paciente con variante WHAM lo suficientemente frecuente como para poder testarlo clínicamente, encontró una mayor latencia de reacción ante estímulos durante la descarga [68]. De hecho, trabajos posteriores con monitorización EEG prolongada encuentran también otras DEI generalizadas típicas, con correlato clínico de ausencias en estos pacientes que presentan una variante WHAM en el EEG [24].
Figura 3. Punta-onda a 6 Hz o punta-onda fantasma. Se muestra el mismo elemento en montaje bipolar longitudinal y referencial a las orejas para apreciar mejor la pequeña punta que antecede a la onda, de mayor amplitud. a) WHAM. Varón de 22 años. Historia de convulsiones en la infancia, años libre de crisis. Electroencefalograma vigilia que muestra paroxismo bilateral asimétrico de tres segundos de punta-onda a 5 Hz, de predominio anterior, más de 100 μV amplitud; b) FOLD. Chica de 15 años, control de epilepsia focal benigna de la infancia centro-temporal, libre de crisis. Punta-onda a 6 Hz, de baja amplitud, distribución temporal posterior y occipital, en somnolencia.

La frecuencia de esta VEB es baja, entre el 0,1 y el 2,7% de los estudios EEG [15-17,23-29].
Una gran amplitud, distribución más anterior o generalizada, frecuencia <5 Hz y persistencia en sueño lento son datos de alarma para esta variante. En estos casos existe una sospecha alta de que constituyan verdaderas DEI, de aspecto atípico, en el seno de epilepsias generalizadas idiopáticas [69].
Puntas positivas a 14 y 6 Hz
Su otra denominación es la de puntas ctenoides, por su parecido con las púas de un peine [70]. Tienen morfología de arco, baja amplitud (<75 µV) y aparecen en brotes breves de 0,5-2 segundos. Las puntas positivas aparecen en frecuencias de 14 Hz (rango: 13-17) y 6 Hz (rango: 5-7). La frecuencia de 14 Hz suele ser más prevalente en adolescentes, y la de 6 Hz, en niños [71]. Son máximas en las regiones temporales posteriores, con mayor frecuencia de forma bilateral asimétrica o asíncrona. Dada su distribución y baja amplitud, se observan mucho mejor en montajes que incluyan referencia a la oreja contralateral o con mayor distancia interelectrodo (Fig. 4), y pueden pasar desapercibidas en montajes bipolares [30]. A veces se solapan con punta-onda a 6 Hz [43].
Figura 4. Puntas positivas a 14-6 Hz o puntas ctenoides. Niña de 11 años, episodios de caída con movimientos abigarrados, etiquetados como crisis pseudo epilépticas. Electroencefalograma en vigilia que muestra paroxismo breve de baja amplitud, de puntas positivas a 14 y 6 Hz, con morfología de arco, duración de un segundo. Distribución temporal posterior bilateral discretamente asimétrica. Se observan mejor en montaje con referencia a la oreja.
Su incidencia es dependiente de la edad: son más frecuentes en la infancia, con un pico en la adolescencia para desaparecer en los adultos mayores. Característicamente, al igual que muchas otras VEB, se observan en la somnolencia y el sueño superficial, y desaparecen en la vigilia y el sueño profundo. La prevalencia en las distintas series oscila entre el 0,5 y el 5,7% [15-17,23-29], aunque es mucho mayor en el grupo de edad adolescente y de adultos jóvenes [70,72].
Se han notificado en casos de encefalopatías metabólicas, sobre todo hepáticas, en escasos trabajos [71]. También se han relacionado con multitud de patologías, pero en la actualidad no se les otorga ningún significado clínico [45]. De hecho, estudios con electrodos profundos encuentran que estos complejos de 14-6 Hz son descargas fisiológicas originadas en el hipocampo, denominadas ‘barcas del hipocampo’ por su morfología, y que no están vinculadas a descargas epileptiformes [73-75]. Otro estudio prospectivo encuentra que las puntas positivas a 14 y 6 Hz y punta-onda a 6 Hz son, de hecho, menos prevalentes en EEG prolongados de pacientes con epilepsia [27].
Descarga rítmica temporal media
Es una variante de aspecto ictal, también conocida como variante psicomotora de Gibbs, porque se describió inicialmente en pacientes con epilepsia del lóbulo temporal [76]. Posteriormente se denominó actividad theta rítmica temporal de la somnolencia [77] y, más tarde, descarga rítmica temporal media [78]. Consiste en trenes de actividad theta a 4-7 Hz, con morfología afilada o no, que tienen aspecto rítmico, frecuencia constante y amplitud media, y son máximos a nivel temporal medio. Su duración es variable, entre segundos y escasos minutos, aunque excepcionalmente se puede llegar a prolongar varias horas [79]. Su distribución es fundamentalmente temporal, pero se puede extender a las regiones parasagitales y posteriores (Fig. 5). Puede ser uni- o bilateral, y se describe una cierta predominancia izquierda [44]. Como su nombre inicial indicaba, aparece casi siempre durante la somnolencia y el sueño superficial, y más raramente se ve en la vigilia [80] o el sueño REM. Es característica de adultos jóvenes y su prevalencia se estima entre el 0,1 y el 6% [15-17,23-29].
Figura 5. Descarga rítmica temporal media. Niño de 7 años. Migrañas con aura visual. Descarga prolongada de actividad theta a 6 Hz, con morfología arciforme y aspecto rítmico, frecuencia constante y amplitud media, con distribución amplia máxima a nivel temporal medio. Somnolencia superficial; véase ritmo alfa occipital al final de la imagen.

Por su aspecto, puede ser confundida con una descarga temporal ictal. Un dato clave es que esta actividad theta no evoluciona. Puede fluctuar, aparecer y desaparecer, pero no evoluciona en frecuencia, morfología o localización, aunque la amplitud pueda variar ligeramente al inicio y al final del brote [44]. En ocasiones se puede solapar con un ritmo wicket, dado que ambos predominan en somnolencia y con una distribución similar. No obstante, la descarga rítmica temporal media suele tener una menor frecuencia y mayor duración que el ritmo wicket, y el aspecto de las ondas que forman la descarga rítmica temporal media suele ser más mellado que agudo, debido a la superposición de frecuencias rápidas [44].
Aunque se ha vinculado con diversas patologías además de la epilepsia [78,81], ninguna de ellas parece tener una asociación causal. Un estudio con magnetoencefalografía indica que la fuente de esta actividad se localiza en la corteza de la región temporal posteroinferior, sin que se encuentre relación con actividad epileptiforme corregistrada [82]. Sólo un trabajo retrospectivo en seis pacientes con epilepsia temporal sometidos a estudio prequirúrgico con electrodos profundos encontró una correlación entre descargas ictales hipocampales y registro de descarga rítmica temporal media en electrodos de superficie, asociados a manifestaciones clínicas en algunos de esos pacientes [83].
Descarga rítmica epileptiforme subclínica del adulto
Es, probablemente, la variante menos frecuente y de características más llamativas. A diferencia del resto de las VEB, sucede fundamentalmente en mayores de 50 años, aparece en vigilia y se puede confundir fácilmente con una crisis elevctroencefalográfica. Consiste en la aparición brusca de ondas lentas a 1-2 Hz, monomorfas, de aspecto afilado, que se repiten de forma rítmica y habitualmente evolucionan a un patrón theta rítmico difuso que se puede mantener desde 40 segundos hasta varios minutos. La amplitud suele ser media, pero oscila entre 40 y 150 µV [43,45,84]. A veces, el inicio se produce segundos después de una primera onda lenta de aspecto agudo de mayor amplitud, que luego se sigue de la secuencia anterior [84]. Suele ser bilateral, aunque puede ser asimétrica, y el inicio con mayor frecuencia es a nivel parietotemporal posterior (Fig. 6). Aparece en vigilia, pero habitualmente en fases de reposo, con cierta frecuencia después de la hiperventilación. Hay descritos casos en los que también se ha observado durante el sueño en registros EEG prolongados [84,85]. Se describen formas típicas y formas atípicas, en las que este patrón theta rítmico monomorfo, y de frecuencia persistente, evoluciona en frecuencias theta y delta, con un fin que puede ser gradual o brusco [86-88]. Su prevalencia es muy baja, entre el 0 y el 0,2% de los EEG [15-17,23-29], aunque una serie breve encuentra una frecuencia mayor, del 1,2% [89].
Figura 6. Descarga rítmica epileptiforme subclínica del adulto. Mujer de 68 años. Síncope convulsivo en contexto de reacción alérgica. a) Inicio brusco durante la hiperventilación en el cuadrante posterior de ondas lentas a 2 Hz, monomorfas, de aspecto afilado, amplitud media, que se repiten de forma rítmica; b) Evolución a un patrón theta rítmico difuso; c) y d) Se mantiene sin apenas variación en frecuencia ni amplitud, fluctuante, durante más de tres minutos. Paciente alerta, exploración normal durante toda la descarga.

Dadas sus características y su escasa prevalencia, SREDA es una variante de difícil diagnóstico para los no familiarizados con su existencia, especialmente las formas atípicas. Las claves que la diferencian de un patrón ictal son, en primer lugar, la ausencia de sintomatología acompañante, con pacientes que no muestran alteración del nivel de conciencia ni déficits cognitivos durante la descarga. Por otro lado, aunque es un patrón que puede prolongarse varios minutos, una vez establecido, sorprende la falta de evolución en frecuencia y amplitud que sucedería en cualquier crisis. Es habitual que fluctúe, y aparezca y cese parcialmente, pero se reanuda con similar morfología y frecuencia. Tampoco se observa un enlentecimiento ni una atenuación posterior [84]. Además, es habitual, como sucede con muchas otras variantes, que se repita varias veces en un mismo EEG o consistentemente a lo largo de sucesivos estudios [84,88], lo que es excepcional en las crisis. Estudios con tomografía computarizada por emisión monofotónica (SPECT) encuentran que no existe una hiperperfusión regional cerebral asociada a la descarga, a diferencia de lo que sucede con una crisis [90].
Su descripción inicial la vinculó con la insuficiencia vascular, al suceder en personas de mayor edad, muchas veces relacionada con la hiperventilación y en una localización que coincide con territorio frontera vascular [84,91]. Se ha relacionado con amnesia global transitoria [92], migrañas [93] y síncope, y también se han descrito casos excepcionales en niños [94,95]. Su presencia en el hemisferio no lesionado en pacientes con antecedente de ictus puede apoyar la idea de que es necesaria una relativa preservación cortical para generar este ritmo no patológico [28,96].
No se ha encontrado con mayor frecuencia en pacientes con epilepsia [14,28,29,84]. Recientemente se ha descrito un patrón ictal temporal estrictamente unilateral de características parecidas en varios pacientes con encefalitis autoinmune por anticuerpos anti-LGI1 [97].
Conclusiones
Las VEB son un reto diagnóstico y una fuente no despreciable de confusión en la interpretación del EEG, con las consecuencias clínicas y terapéuticas que conlleva. Salvo SREDA y las puntas wicket o en empalizada, son mucho más habituales en fases de somnolencia y sueño superficial de adolescentes y adultos jóvenes.
Datos que apoyan su diagnóstico son la presencia frecuente a lo largo del registro, habitualmente de forma bilateral o alternando lateralización, sin distorsión de la actividad de fondo. Para las que tienen un aspecto ‘ictal’, la falta de evolución y propagación típica de las crisis y un comportamiento fluctuante apoyan la sospecha de VEB. La aparición casi sistemática de estas variantes en sucesivos EEG de un mismo sujeto también es un dato altamente sugerente.
En general, son elementos que no se presentan con mayor frecuencia en pacientes con epilepsia ni tienen clara significación patológica. Posibles excepciones son las SSS estrictamente unilaterales y la punta-onda a 6 Hz de aspecto WHAM. Ambas variantes deben interpretarse con prudencia y en un contexto clínico.
Además del conocimiento de estas variantes y de contar con la experiencia suficiente en el análisis del EEG, debemos aplicar la máxima de que la sobreinterpretación y sus consecuencias (establecer diagnóstico de epilepsia) son mucho más perjudiciales que la actitud expectante, en la que se deben repetir o prolongar los estudios hasta tener un diagnóstico de certeza.
Bibliografía
↵ 1. Kane N, Acharya J, Benickzy S, Caboclo L, Finnigan S, Kaplan PW, et al. A revised glossary of terms most commonly used by clinical electroencephalographers and updated proposal for the report format of the EEG findings. Revision 2017. Clin Neurophysiol Pract 2017; 2: 170-85.
↵ 2. Beniczky S, Aurlien H, Brøgger JC, Hirsch LJ, Schomer DL, Trinka E, et al. Standardized computer-based organized reporting of EEG: SCORE - Second version. Clin Neurophysiol 2017; 128: 2334-46.
↵ 3. Jing J, Herlopian A, Karakis I, Ng M, Halford JJ, Lam A, et al. Interrater reliability of experts in identifying interictal epileptiform discharges in electroencephalograms. JAMA Neurol 2020; 77: 49-57.
↵ 4. Dericioglu N, Ozdemir P. The success rate of neurology residents in EEG interpretation after formal training. Clin EEG Neurosci 2018; 49: 136-40.
↵ 5. Kural MA, Duez L, Sejer Hansen V, Larsson PG, Rampp S, Schulz R, et al. Criteria for defining interictal epileptiform discharges in EEG: a clinical validation study. Neurology 2020; 94: e2139-47.
↵ 6. Fisher RS, Acevedo C, Arzimanoglou A, Bogacz A, Cross JH, Elger CE, et al. ILAE official report: a practical clinical definition of epilepsy. Epilepsia 2014; 55: 475-82.
↵ 7. Aschner A, Kowal C, Arski O, Crispo JAG, Farhat N, Donner E. Prevalence of epileptiform electroencephalographic abnormalities in people without a history of seizures: A systematic review and meta-analysis. Epilepsia 2024; 65: 583-99.
↵ 8. Borusiak P, Zilbauer M, Jenke ACW. Prevalence of epileptiform discharges in healthy children--new data from a prospective study using digital EEG. Epilepsia 2010; 51: 1185-8.
↵ 9. Nguyen DK, Girard ME, Cossette P, Saint-Hilaire JM. Audit of EEG reporting temporal abnormalities. Can J Neurol Sci J Can Sci Neurol 2010; 37: 819-25.
↵ 10. Benbadis SR. Errors in EEGs and the misdiagnosis of epilepsy: importance, causes, consequences, and proposed remedies. Epilepsy Behav 2007; 11: 257-62.
↵ 11. Kara SD, Amin U, Benbadis SR. Reversing the myth of phase reversals. Expert Rev Neurother 2020; 20: 3-5.
↵ 12. Zivin L, Marsan CA. Incidence and prognostic significance of ‘epileptiform’ activity in the EEG of non-epileptic subjects. Brain J Neurol 1968; 91: 751-78.
↵ 13. Klass D, Westmoreland B. Nonepileptogenic epileptiform electroencephalographic activity. Ann Neurol 1985; 18: 627-35.
↵ 14. Westmoreland BF. Epileptiform electroencephalographic patterns. Mayo Clin Proc 1996; 71: 501-11.
↵ 15. Santoshkumar B, Chong JJR, Blume WT, McLachlan RS, Young GB, Diosy DC, et al. Prevalence of benign epileptiform variants. Clin Neurophysiol 2009; 120: 856-61.
↵ 16. Radhakrishnan K, Santoshkumar B, Venugopal A. Prevalence of benign epileptiform variants observed in an EEG laboratory from South India. Clin Neurophysiol 1999; 110: 280-5.
↵ 17. Rathore C, Prakash S, Rana K, Makwana P. Prevalence of benign epileptiform variants from an EEG laboratory in India and frequency of their misinterpretation. Epilepsy Res 2021; 170: 106539.
↵ 18. Sheng S, Nalleballe K, Yadala S. EEG benign variants. In Stat Pearls. Treasure Island (FL): Stat Pearls Publishing; 2024.
↵ 19. Trojaborg W. EEG abnormalities in 5,893 jet pilot applicants registered in a 20-year period. Clin Electroencephalogr 1992; 23: 72-8.
↵ 20. Jabbari B, Russo MB, Russo ML. Electroencephalogram of asymptomatic adult subjects. Clin Neurophysiol 2000; 111: 102-5.
↵ 21. Oh DA, Kim H, Bae EK. Electroencephalographic abnormalities in the screening for pilot applicants in Korea. J Clin Neurol Seoul Korea 2018; 14: 212-4.
↵ 22. Monin J, Pruvost-Robieux E, Huiban N, Marchi A, Crepon B, Dubourdieu D, et al. Prevalence of benign epileptiform variants during initial EEG examination in French military aircrew. Clin Neurophysiol 2018; 48: 171-9.
↵ 23. Macorig G, Crespel A, Nilo A, Tang NPL, Valente M, Gigli GL, et al. Benign EEG variants in the sleep-wake cycle: a prospective observational study using the 10-20 system and additional electrodes. Clin Neurophysiol 2021; 51: 233-42.
↵ 24. Mothersill I. A reappraisal of the value of interictal EEG findings in diagnosing epilepsy plus a critical review of controversial «normal variants», utilising long-term ambulatory EEG recordings. Schweiz Arch Für Neurol Psychiatr 2012; 163: 11.
↵ 25. Wuestenhagen S, Terney D, Gardella E, Larsen PM, Romer C, Aurlien H, et al. EEG normal variants: a prospective study using the SCORE system. Clin Neurophysiol Pract 2022; 7: 183-200.
↵ 26. Ananthasubramanian ST, Viswanathan L, Asranna A, Kenchiah R, Ravindranadh CM, Sinha S. Beyond the norm: unraveling benign epileptiform variants in EEG and the coexistence with epileptiform discharges in 3000 patients. J Neurol Sci 2023; 455: 178.
↵ 27. Macorig G, Crespel A, Nilo A, Tang NPL, Gigli GL, Gélisse P. Can epilepsy affect normal EEG variants? A comparative study between subjects with and without epilepsy. Clin Neurophysiol 2024; 54: 102935.
↵ 28. Dash GK, Radhakrishnan A. What does ‘subclinical rhythmic electrographic discharge of adults’ in EEG signify? J Clin Neurophysiol 2013; 30: 255-60.
↵ 29. Iste FA, Filik FIT, Saygi S. SREDA: a rare but confusing benign EEG variant. J Clin Neurophysiol 2020; 37: 225-30.
↵ 30. Bergen DC. Benign EEG patterns: is there more to learn? Epilepsy Curr 2010; 10: 34-5.
↵ 31. White JC, Langston JW, Pedley TA. Benign epileptiform transients of sleep. Clarification of the small sharp spike controversy. Neurology 1977; 27: 1061-8.
↵ 32. Nascimento FA, Jing J, Beniczky S, Olandoski M, Benbadis SR, Cole AJ, et al. EEG reading with or without clinical information – a real-world practice study. Clin Neurophysiol 2022; 52: 394-7.
↵ 33. Benbadis SR. ‘Just like EKGs!’ Should EEGs undergo a confirmatory interpretation by a clinical neurophysiologist? Neurology 2013; 80 (1 Suppl 1): S47-51.
↵ 34. Nascimento FA, Jing J, Beniczky S, Benbadis SR, Gavvala JR, Yacubian EMT, et al. One EEG, one read: a manifesto towards reducing interrater variability among experts. Clin Neurophysiol 2022; 133: 68-70.
↵ 35. Tatum WO. Normal «suspicious» EEG. Neurology 2013; 80 (1 Suppl 1): S4-11.
↵ 36. Miller JW, Henry JC. Solving the dilemma of EEG misinterpretation. Neurology 2013; 80: 13-4.
↵ 37. Benbadis SR, Thomas P. When EEG is bad for you. Clin Neurophysiol 2017; 128: 656-7.
↵ 38. Benbadis SR. The tragedy of over-read EEGs and wrong diagnoses of epilepsy. Expert Rev Neurother 2010; 10: 343.
↵ 39. Benbadis SR, Kaplan PW. The dangers of over-reading an EEG. J Clin Neurophysiol 2019; 36: 249.
↵ 40. Benbadis SR, Tatum WO. Overintepretation of EEGs and misdiagnosis of epilepsy. J Clin Neurophysiol 2003; 20: 42-4.
↵ 41. Hernandez-Frau PE, Benbadis SR. Pearls & oysters: errors in EEG interpretations: what is misinterpreted besides temporal sharp transients? Neurology 2011; 76: e57-9.
↵ 42. Reiher J, Lebel M. Wicket spikes: clinical correlates of a previously undescribed EEG pattern. Can J Neurol Sci J Can Sci Neurol 1977; 4: 39-47.
↵ 43. Mari-Acevedo J, Yelvington K, Tatum WO. Normal EEG variants. Handb Clin Neurol 2019; 160: 143-60.
↵ 44. Kang JY, Krauss GL. Normal variants are commonly overread as interictal epileptiform abnormalities. J Clin Neurophysiol 2019; 36: 257-63.
↵ 45. Amin U, Nascimento FA, Karakis I, Schomer D, Benbadis SR. Normal variants and artifacts: Importance in EEG interpretation. Epileptic Disord 2023; 25: 591-648.
↵ 46. Azzam RH, Arain AM, Azar NJ. Revisiting the laterality of wicket spikes with continuous EEG. J Clin Neurophysiol 2015; 32: E8-11.
↵ 47. Krauss GL, Abdallah A, Lesser R, Thompson RE, Niedermeyer E. Clinical and EEG features of patients with EEG wicket rhythms misdiagnosed with epilepsy. Neurology 2005; 64: 1879-83.
↵ 48. Crespel A, Velizarova R, Genton P, Coubes P, Gélisse P. Wicket spikes misinterpreted as focal abnormalities in idiopathic generalized epilepsy with prescription of carbamazepine leading to paradoxical aggravation. Clin Neurophysiol 2009; 39: 139-42.
↵ 49. Dash GK, Sundaran S, Radhakrishnan A. Subclinical rhythmic EEG discharge of adults: ‘SREDA in a child’. Seizure 2013; 22: 246-8.
↵ 50. Batista MSA, Coelho CF, De Lima MM, Silva DF. Wicket spikes: a case-control study of a benign eletroencephalographic variant pattern. Arq Neuropsiquiatr 1999; 57: 561-5.
↵ 51. Vallabhaneni M, Baldassari LE, Scribner JT, Cho YW, Motamedi GK. A case-control study of wicket spikes using video-EEG monitoring. Seizure 2013; 22: 14-9.
↵ 52. Gibbs FA, Gibbs EL. Atlas of electroencephalography. Vol. 2. Epilepsy. Reading, MA: Addison-Wesley; 1952.
↵ 53. Koshino Y, Niedermeyer E. Clinical significance of small sharp spikes in electroencephalogram. Clin Electroencephalogr 1975; 6: 131-40.
↵ 54. White J, Langston J, Pedley T. Benign epileptiform transients of sleep - clarification of small sharp spike controversy. Neurology 1977; 27: 1061-8.
↵ 55. Molaie M, Santana H, Otero C, Cavanaugh W. Effect of epilepsy and sleep-deprivation on the rate of benign epileptiform transients of sleep. Epilepsia 1991; 32: 44-50.
↵ 56. Hughes J, Gruener G. Small sharp spikes revisited: further data on this controversial pattern. Clin Electroencephalogr 1984; 15: 208-13.
↵ 57. Gutrecht J. Clinical implications of benign epileptiform transients of sleep. Electroencephalogr Clin Neurophysiol 1989; 72: 486-90.
↵ 58. Beun AM, van Emde Boas W, Dekker E. Sharp transients in the sleep EEG of healthy adults: a possible pitfall in the diagnostic assessment of seizure disorders. Electroencephalogr Clin Neurophysiol 1998; 106: 44-51.
↵ 59. Lam AD, Sarkis RA, Pellerin KR, Jing J, Dworetzky BA, Hoch DB, et al. Association of epileptiform abnormalities and seizures in Alzheimer disease. Neurology 2020; 95: E2259-70.
↵ 60. Epitashvili N, San Antonio-Arce V, Brandt A, Schulze-Bonhage A. Intracranial correlates of small sharp spikes. Clin Neurophysiol 2021; 132: 2146-51.
↵ 61. Issa NP, Wu S, Rose S, Towle VL, Warnke PC, Tao JX. Small sharp spikes as EEG markers of mesiotemporal lobe epilepsy. Clin Neurophysiol 2018; 129: 1796-803.
↵ 62. Chen Z, Issa NP, Wu S, Liu X, Sun T, Bodnya J, et al. The clinical significance of small sharp spikes: a retrospective study of 909 patients in epilepsy monitoring unit. Epilepsy Res 2020; 168: 106477.
↵ 63. Bruzzone MJ, Issa NP, Wu S, Rose S, Esengul YT, Towle VL, et al. Hippocampal spikes have heterogeneous scalp EEG correlates important for defining IEDs. Epilepsy Res 2022; 182: 106914.
↵ 64. Agari D, Jin K, Kakisaka Y, Kanno A, Ishida M, Kawashima R, et al. Magnetoencephalography to confirm epileptiform discharges mimicking small sharp spikes in temporal lobe epilepsy. Clin Neurophysiol 2021; 132: 1785-9.
↵ 65. Issa NP, Tao JX. Placing BETS on a spectrum of small sharp spikes. Clin Neurophysiol 2020; 131: 2910-1.
↵ 66. Issa NP, Lee S, Wu S, Rose S, Towle VL, Warnke PC, et al. Reply to ‘which small sharp spikes are benign epileptiform transients of sleep?’ Clin Neurophysiol 2018; 129: 2495-6.
↵ 67. Hughes JR. Two forms of the 6/sec spike and wave complex. Electroencephalogr Clin Neurophysiol 1980; 48: 535-50.
↵ 68. Hughes JR, Fino JJ. Changes in reactivity during the 6/second spike and wave complex. Clin Electroencephalogr 1992; 23: 31-6.
↵ 69. Mushtaq R, Van Cott AC. Benign EEG variants. Am J Electroneurodiagnostic Technol 2005; 45: 88-101.
↵ 70. Lombroso CT, Schwartz IH, Clark DM, Muench H, Barry PH, Barry J. Ctenoids in healthy youths. Controlled study of 14- and 6-per-second positive spiking. Neurology 1966; 16: 1152-8.
↵ 71. Sanariya K, Garg A, More A, Bansal AR. 6 and 14 Hz positive spikes on scalp electroencephalogram. Int J Epilepsy 2018; 5: 9-12.
↵ 72. Velizarova R, Crespel A, Serafini A, Gelisse P. A new approach for the detection of the fourteen- and six-Hertz positive bursts (6-14 Hz): the lower temporal line. Clin Neurophysiol 2011; 122: 1272-3.
↵ 73. Jain P, Borlot F, Morrison-Levy N, Ochi A, Whitney R. 14- and 6-Hz positive bursts and N waves: Lesser known benign EEG variants in adolescents. Neurol India 2019; 67: 936-7.
↵ 74. Kokkinos V, Zaher N, Antony A, Bagic A, Richardson RM, Urban A. The intracranial correlate of the 14&6/sec positive spikes normal scalp EEG variant. Clin Neurophysiol 2019; 130: 1570-80.
↵ 75. Kokkinos V, Hussein H, Sakelliadou DG, Mark Richardson R, Bagić AΙ, Urban A. Hippocampal barques and their manifestation as 14&6 Hz positive spikes during sleep. Clin Neurophysiol 2024; 157: 37-43.
↵ 76. Gibbs FA, Rich CL, Gibbs EL. Psychomotor variant type of seizure discharge. Neurology 1963; 13: 991-8.
↵ 77. Westmoreland BF, Klass DW. Unusual EEG patterns. J Clin Neurophysiol 1990; 7: 209-28.
↵ 78. Lipman IJ, Hughes JR. Rhythmic mid-temporal discharges (RMTD): an electro-clinical study. Epilepsia 1969; 10: 416-7.
↵ 79. Hughes JR. The continuous rhythmic mid-temporal discharge. Clin Electroencephalogr 2001; 32: 10-3.
↵ 80. Koutroumanidis M, Hennessy MJ, Sparkes M, Binnie CD. Continuous bitemporal rhythmic subclinical epileptiform activity in an adult without epileptic seizures. Clin Neurophysiol 2000; 111: 600-3.
↵ 81. Hennessy MJ, Koutroumanidis M, Hughes E, Binnie CD. Psychomotor EEG variant of Gibbs: an association with underlying structural pathology. Clin Neurophysiol 2001; 112: 686-7.
↵ 82. Lin YY, Wu ZA, Hsieh JC, Yu HY, Kwan SY, Yen DJ, et al. Magnetoencephalographic study of rhythmic mid-temporal discharges in non-epileptic and epileptic patients. Seizure 2003; 12: 220-5.
↵ 83. Sun T, Liu X, Issa NP, Rose S, Wu S, Wang Q, et al. RTTBD-like activity in association with hippocampal ictal discharges in patients with temporal lobe epilepsy. Epileptic Disord 2020; 22: 462-72.
↵ 84. Westmoreland BF, Klass DW. A distinctive rhythmic EEG discharge of adults. Electroencephalogr Clin Neurophysiol 1981; 51: 186-91.
↵ 85. Fleming WE, Avidan A, Malow BA. Subclinical rhythmic electrographic discharge of adults (SREDA) in REM sleep. Sleep Med 2004; 5: 77-81.
↵ 86. Westmoreland BF, Klass DW. Unusual variants of subclinical rhythmic electrographic discharge of adults (SREDA). Electroencephalogr Clin Neurophysiol 1997; 102: 1-4.
↵ 87. O’Brien TJ, Sharbrough FW, Westmoreland BF, Busacker NE. Subclinical rhythmic electrographic discharges of adults (SREDA) revisited: a study using digital EEG analysis. J Clin Neurophysiol 1998; 15: 493-501.
↵ 88. Gonzalez A, Pana R, Dubeau F, Kobayashi E. Four atypical cases of subclinical rhythmic electroencephalogram discharge of adults: case series and review. J Clin Neurophysiol 2024; 41: e1.
↵ 89. Begum T, Ikeda A, Takahashi J, Tomimoto H, Shimohama S, Satow T, et al. Clinical outcome of patients with SREDA (subclinical rhythmic EEG discharge of adults). Intern Med Tokyo Jpn 2006; 45: 141-4.
↵ 90. Thomas P, Migneco O, Darcourt J, Chatel M. Single photon emission computed tomography study of subclinical rhythmic electrographic discharge in adults. Electroencephalogr Clin Neurophysiol 1992; 83: 223-7.
↵ 91. Zumsteg D, Andrade DM, Del Campo JM, Wennberg R. Parietal lobe source localization and sensitivity to hyperventilation in a patient with subclinical rhythmic electrographic discharges of adults (SREDA). Clin Neurophysiol 2006; 117: 2257-63.
↵ 92. Brigo F, Bongiovanni LG, Fiaschi A. Subclinical rhythmic electrographic discharges of adults and transient global amnesia: a causal or casual association? Epileptic Disord 2010; 12: 321-4.
↵ 93. Burakgazi E, Akbar U, Kelly J. Subclinical rhythmic electrographic discharges of adults in a patient with migraine. Clin EEG Neurosci 2012; 43: 165-8.
↵ 94. Nagarajan L, Gregory PB, Hewitt IK, Gubbay SS, Parry TS. Subclinical rhythmic EEG discharge of adults: SREDA in two children. Pediatr Neurol 2001; 24: 313-6.
↵ 95. Goeden M, Bansal LR. Subclinical rhythmic EEG discharge of adult (SREDA) in a child with generalized epilepsy and literature review of SREDA in children. J Clin Neurophysiol 2018; 35: 270-2.
↵ 96. Campbell ZM, Kaplan PW, Edwards JC. Unilateral SREDA in a patient with stroke. Clin EEG Neurosci 2017; 48: 72-4.
↵ 97. Steriade C, Mirsattari SM, Murray BJ, Wennberg R. Subclinical temporal EEG seizure pattern in LGI1-antibody-mediated encephalitis. Epilepsia 2016; 57: e155-60.
Normal variants with an epileptiform appearance in electroencephalograms. A literature review and clinical implications
Abstract. Normal epileptiform-like variants or benign epileptiform variants are a diagnostic challenge in the interpretation of electroencephalograms, which require the knowledge and extensive experience of those responsible for the electroencephalographic report. They include a heterogeneous group of findings, some quite uncommon, initially related to epilepsy and various neurological conditions. Most of them are currently considered variants with no pathological significance, and their over-interpretation usually leads to misdiagnosis and the establishment of unnecessary treatments. Prevalence data are variable and usually come from selected populations, so they are difficult to extrapolate to a healthy population. Studies with invasive electrodes and recent series link some of these variants with epilepsy. We aim to review the characteristics and prevalence of the main benign epileptiform variants and to update their clinical significance.
Key words. Benign epileptiform variants. Differential diagnosis. Electroencephalography. Misdiagnosis. SREDA. Wicket spike.
|
© 2024 Revista de Neurología








